Bula do Foslamer
Princípio Ativo:Cloridrato de Sevelâmer
Foslamer, para o que é indicado e para o que serve?
Foslamer® é indicado para o controle do fósforo no sangue de pacientes com doença renal crônica sob diálise. Em pacientes sob diálise, Foslamer® reduz a incidência de excesso de cálcio no sangue comparado ao tratamento com cálcio para o controle de fósforo.
Como o Foslamer funciona?
Foslamer® contém cloridrato de sevelâmer, uma substância que se liga ao fosfato no trato digestivo, impedindo sua absorção pelo corpo, reduzindo, portanto o seu nível sanguíneo.
Em estudos clínicos, o tempo médio estimado para início da ação terapêutica do medicamento foi de duas semanas.
Quais as contraindicações do Foslamer?
Você não deve usar Foslamer® se apresentar diminuição da quantidade de fósforo no sangue (hipofosfatemia) ou obstrução intestinal.
Você também não deve usar Foslamer® se tiver alergia conhecida ao cloridrato de sevelâmer ou a qualquer um dos componentes da fórmula.
Este medicamento é contraindicado para uso por pacientes com hipofosfatemia ou obstrução intestinal.
Como usar o Foslamer?
Foslamer® deve ser tomado por via oral, com as refeições.
Os comprimidos de Foslamer® devem ser engolidos intactos e não devem ser triturados, mastigados ou quebrados antes da administração.
Se você não está usando outro medicamento para diminuir o fósforo no sangue:
A dose inicial recomendada é de 800 a 1600 mg, a qual pode ser tomada usando-se um a dois comprimidos de Foslamer® 800 mg, com cada refeição, com base no nível de fósforo no sangue.
Dose inicial quando não se está utilizando outro medicamento para diminuir o fosfato no sangue
|
Fósforo no sangue |
Foslamer® 800 mg |
|
> 5,5 e < 7,5mg/dL (> 1,78 e < 2,42 mmol/L) |
1 comprimido, 3 vezes por dia com as refeições |
|
≥ 7,5 e < 9,0 mg/dL (≥ 2,42 e < 2,91 mmol/L) |
2 comprimidos, 3 vezes por dia com as refeições |
|
≥ 9,0 mg/dL (≥ 2,91 mmol/L) |
2 comprimidos, 3 vezes por dia com as refeições |
Se você está substituindo o tratamento com acetato de cálcio por Foslamer®:
A dose de Foslamer® deve ser equivalente à dose de acetato de cálcio, que estava sendo tomada anteriormente.
Dose inicial quando o tratamento com acetato de cálcio está sendo substituído por Foslamer®
|
Acetato de cálcio 667 mg (comprimidos por refeição) |
Foslamer® 800 mg (comprimidos por refeição) |
|
1 comprimido |
1 comprimido |
|
2 comprimidos |
2 comprimidos |
|
3 comprimidos |
3 comprimidos |
Os níveis de fósforo sérico devem ser rigorosamente monitorados e a dose de Foslamer® ajustada em conformidade com a diminuição pretendida de fósforo sérico para 1,78 mmol/L (5,5 mg/dL), ou menos. Seu médico realizará análises sanguíneas a cada 2 a 3 semanas até que um nível estável de fósforo sérico seja atingido e após este nível ser atingido, seu médico realizará exames regulares.
A dose máxima diária estudada de cloridrato de sevelâmer foi de 13 gramas.
Uso em idosos:
Se você for um paciente idoso, o seu médico deverá selecionar a dose de Foslamer® com cautela, geralmente iniciando com a dose mais baixa do intervalo de dose.
Siga a orientação do seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Não interrompa o tratamento sem o conhecimento do seu médico.
Este medicamento não deve ser partido, aberto ou mastigado.
O que devo fazer quando eu me esquecer de usar o Foslamer?
Converse com o seu médico o mais rápido possível, caso você esqueça de tomar Foslamer® ou pense que pode ter deixado de tomar uma dose ou ter vomitado após tomar o comprimido.
Não tome uma dose dobrada para compensar os comprimidos esquecidos.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Superdose: o que acontece se tomar uma dose do Foslamer maior do que a recomendada?
Como Foslamer® não é absorvido pelo intestino, o risco de intoxicação é muito baixo.
Em caso de uso de grande quantidade deste medicamento procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Quais cuidados devo ter ao usar o Foslamer?
Se você for um paciente idoso, o seu médico deverá selecionar a dose de Foslamer® com cautela, geralmente iniciando com a dose mais baixa do intervalo de dose.
A segurança e eficácia de cloridrato de sevelâmer não foram estabelecidas em pessoas com menos de 18 anos de idade ou em pessoas na pré-diálise.
A segurança e eficácia de cloridrato de sevelâmer não foram estabelecidas em pessoas com disfagia (dificuldade para engolir), distúrbios de deglutição, distúrbios graves de motilidade gastrointestinal, incluindo constipação (prisão de ventre) grave ou que fizeram uma cirurgia grande no trato gastrointestinal. Foslamer® deve ser tomado com cuidado se você apresentar algum problema gastrointestinal. Informe seu médico se você tiver algum problema gastrointestinal antes de tomar Foslamer®.
Casos incomuns de dificuldade de engolir os comprimidos de cloridrato de sevelâmer têm sido relatados.
Muitos destes casos envolvem pacientes que já apresentam condições que contribuem para afetar a capacidade de engolir, incluindo problemas de deglutição ou anormalidades oroesofágicas (da boca ou do esôfago).
Foslamer® deve ser tomado com cuidado se você apresentar algum destes problemas.
Se você tiver insuficiência renal poderá desenvolver níveis baixos ou excesso de cálcio no sangue.
Foslamer® não contém cálcio. Seu médico realizará análises sanguíneas para monitorar a concentração de cálcio no seu sangue e pode prescrever um suplemento de cálcio, se você desenvolver baixos níveis de cálcio no sangue.
Se você tiver doença renal crônica, você pode desenvolver acidose metabólica (acidez excessiva no sangue). Foslamer® não contém suplementação alcalina. Seu médico realizará análises sanguíneas para determinar a concentração de bicarbonato e cloreto, para monitorar a acidez do sangue.
Dependendo da alimentação e da natureza da doença renal crônica, os pacientes sob diálise podem desenvolver baixos níveis de vitamina A, D, E e K. Portanto, se você não estiver tomando essas vitaminas, seu médico pode realizar análises sanguíneas para monitorar a concentração dessas vitaminas no seu sangue e lhe indicará um suplemento vitamínico, se necessário.
Foram relatados casos graves de transtornos inflamatórios do trato gastrointestinal [incluindo complicações graves como sangramento, perfuração, ulceração (lesão localizada no estômago ou duodeno), necrose (morte de células) e colite (inflamação do intestino grosso)] associados à presença de cristais de sevelâmer. No entanto, não foi demonstrada causalidade dos cristais de sevelâmer no início de tais distúrbios. O cloridrato de sevelâmer deve ser reavaliado por seu médico caso você desenvolva sintomas gastrointestinais graves.
Não foi observado nenhum efeito sobre a capacidade de dirigir veículos e operar máquinas com o uso de Foslamer®.
Não há informações que sugerem que o cloridrato de sevelâmer possa causar doping.
Em estudos com animais, não houve qualquer evidência de que o cloridrato de sevelâmer tenha causado toxicidade embriofetal (no embrião e/ou feto).
Quais as reações adversas e os efeitos colaterais do Foslamer?
A seguinte classificação de frequência é utilizada, quando aplicável:
- Muito comum ≥ 10%;
- Comum ≥ 1 e < 10%;
- Incomum ≥ 0,1 e < 1%;
- Rara ≥ 0,01 e < 0,1%;
- Muito rara < 0,01%;
- Desconhecida (não pode ser estimada a partir dos dados disponíveis).
Em estudos clínicos, reações adversas reportadas com cloridrato de sevelâmer foram similares àquelas reportadas para o grupo controle.
As reações adversas, que ocorreram mais frequentemente (≥ 5% dos pacientes), emergentes do tratamento, possivelmente ou provavelmente relacionadas com cloridrato de sevelâmer, foram todos na classe de sistema de órgãos de distúrbios gastrointestinais de acordo com a Tabela abaixo.
Neste estudo, a principal razão para o abandono do tratamento com cloridrato de sevelâmer foram as reações adversas gastrointestinais.
Resumo das reações adversas que ocorreram mais frequentemente (≥ 5% dos pacientes) emergentes do tratamento, possivelmente ou provavelmente relacionadas com cloridrato de sevelâmer
|
Classe de Sistemas de Órgãos |
Reação adversa |
% de Pacientes |
|
Distúrbios gastrointestinais |
Vômito |
10,1 |
|
Náusea |
10,1 |
|
|
Indigestão |
9,1 |
|
|
8,1 |
||
|
Dor Abdominal |
5,1 |
|
|
Flatulência |
5,1 |
Em um estudo as reações adversas possivelmente ou provavelmente relacionadas com cloridrato de sevelâmer incluíram indigestão (8,3%) e vômito (4,2%). Em outro estudo as reações adversas possivelmente ou provavelmente relacionadas com cloridrato de sevelâmer incluíram indigestão (8,5%), diarreia (4,9%), náusea (4,9%), vômitos (4,9%), anorexia (redução ou perda do apetite) (3,7%) e distúrbio gastrointestinal (3,7%). Em um estudo de longo prazo, as reações adversas possivelmente ou provavelmente relacionadas com cloridrato de sevelâmer incluíram náusea (7,3%), dor abdominal (5,2%) e indigestão (4,7%).
Em um estudo os eventos adversos relatados para o cloridrato de sevelâmer em pacientes sob diálise peritoneal foram similares aos eventos adversos observados em pacientes sob hemodiálise. As reações adversas possivelmente relacionadas com o cloridrato de sevelâmer incluíram: indigestão (12,4%), diarreia (5,2%), náuseas (5,2%), constipação (4,1%), prurido (coceira e/ou ardência) (4,1%), distensão abdominal (3,1%), vômitos (3,1%), fadiga (3,1%), anorexia (3,1%) e dor nas juntas (3,1%).
Durante a experiência pós-comercialização, as seguintes reações adversas foram relatadas em pacientes que receberam cloridrato de sevelâmer, embora nenhuma relação direta com o cloridrato de sevelâmer pôde ser estabelecida: hipersensibilidade (alergia ou intolerância), prurido, erupções cutâneas, dor abdominal e casos incomuns de obstrução intestinal, de íleo e perfuração intestinal.
Informe ao seu médico, cirurgião-dentista, ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento. Informe também a empresa através do seu serviço de atendimento.
População Especial do Foslamer
Gravidez e amamentação
Este medicamento não deve ser utilizado durante a amamentação sem orientação médica. A segurança de cloridrato de sevelâmer não foi estabelecida em mulheres grávidas ou lactantes (mulheres amamentando).
Foslamer® somente deve ser administrado a mulheres grávidas ou lactantes se for estritamente necessário e após ter sido realizada uma análise cuidadosa do risco/benefício, tanto para mãe como para o feto ou lactente (crianças em fase de amamentação). Não há estudos adequados e bem controlados em mulheres lactantes. Também não há estudos adequados e bem controlados em mulheres grávidas.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Interação medicamentosa: quais os efeitos de tomar Foslamer com outros remédios?
Os estudos de interação medicamentosa não foram realizados em pacientes sob diálise.
Em estudos de interação medicamentosa em pessoas sadias, o cloridrato de sevelâmer não teve efeito sobre a absorção de medicamentos como digoxina, varfarina, enalapril, metoprolol ou ferro.
Entretanto, quando o medicamento ciprofloxacino foi ingerido ao mesmo tempo que o cloridrato de sevelâmer, existiu uma diminuição da sua absorção em 50% e, assim, pode haver uma diminuição da sua eficácia.
Consequentemente, Foslamer® não deve ser tomado juntamente com ciprofloxacino.
Durante a experiência pós-comercialização, concentrações reduzidas de ciclosporina, micofenolato de mofetila e tacrolimo têm sido relatadas quando coadministrados com cloridrato de sevelâmer em pacientes transplantados, sem quaisquer consequências clínicas (por exemplo, a rejeição do enxerto). A possibilidade de uma interação não pode ser excluída e deve ser considerado um acompanhamento rigoroso das concentrações sanguíneas de ciclosporina, micofenolato de mofetila e tacrolimo durante o uso de qualquer um destes medicamentos em combinação com sevelâmer e após a sua suspensão.
Casos muito raros de aumento dos níveis de hormônio tireotrófico (TSH) foram relatados em pacientes tomando o cloridrato de sevelâmer em conjunto com levotiroxina. Seu médico realizará análises sanguíneas para monitorar a concentração de TSH no seu sangue, caso você tenha que utilizar ambos os medicamentos.
Durante a experiência pós-comercialização, casos muito raros de aumento dos níveis de fosfato foram reportados em pacientes que receberam coadministração de inibidores da bomba de prótons com cloridrato de sevelâmer.
Foslamer® pode afetar a absorção de outros medicamentos, portanto você deve tomar outros medicamentos uma hora antes ou três horas após o uso de cloridrato de sevelâmer. Você deve informar o seu médico sempre que estiver utilizando outros medicamentos, pois ele poderá monitorar a quantidade dessas medicações no seu sangue.
Não foram feitos estudos de interação medicamentosa de cloridrato de sevelâmer com medicamentos antiarrítmicos e anticonvulsivantes. Se você utiliza medicamentos antiarrítmicos, para controle de arritmias cardíacas, ou medicações anticonvulsivantes, para o controle de distúrbios epiléticos, informe seu médico para que ele possa tomar as precauções necessárias.
Em estudos de interação medicamentosa com animais, não houve qualquer efeito adverso quando cloridrato de sevelâmer foi administrado em conjunto com verapamil, quinidina, calcitriol, tetraciclina, varfarina, ácido valproico, digoxina, propranolol, estrona e L-tiroxina.
Não há estudos adequados e bem controlados sobre interações de cloridrato de sevelâmer com alimentos.
Não há incompatibilidades farmacêuticas conhecidas.
Não foram realizados estudos de interação medicamento-substância química, incluindo álcool e nicotina.
Nenhuma interação medicamento-exame laboratorial e não laboratorial foi observada Foslamer®.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
Qual a ação da substância do Foslamer?
Resultados de Eficácia
A capacidade de Cloridrato de Sevelâmer para reduzir o fósforo sérico, em pacientes com doença renal crônica (DRC) sob hemodiálise, foi demonstrada em seis estudos clínicos; um estudo de 2 semanas, duplo-cego, controlado por placebo (Cloridrato de Sevelâmer N = 24); dois estudos de 8 semanas, abertos, não-controlados (Cloridrato de Sevelâmer N = 220) e três estudos abertos com controle ativo, com duração de tratamento de 8 a 52 semanas (Cloridrato de Sevelâmer N = 256) 1,2,3,4,5,6. Os três estudos com controle ativo estão descritos a seguir. Um estudo foi um ensaio cruzado com dois períodos de 8 semanas comparando Cloridrato de Sevelâmer com acetato de cálcio. O segundo estudo foi um ensaio paralelo de 52 semanas comparando Cloridrato de Sevelâmer com acetato de cálcio ou carbonato de cálcio. O terceiro foi um estudo paralelo de 12 semanas comparando Cloridrato de Sevelâmer e acetato de cálcio em pacientes sob diálise peritoneal.
Estudo cruzado de Cloridrato de Sevelâmer e acetato de cálcio1:
Oitenta e quatro (84) pacientes com DRC, sob hemodiálise, que estavam hiperfosfatêmicos (fósforo sérico > 6 mg/dL), após um período de suspensão do uso de quelantes de fosfato (washout) por 2 semanas, foram randomizados para receber Cloridrato de Sevelâmer por 8 semanas2 , seguido por acetato de cálcio por 8 semanas, ou acetato de cálcio por 8 semanas, seguido de Cloridrato de Sevelâmer por 8 semanas. Os períodos de tratamentos foram separados por um período de suspensão do uso de quelantes de fosfato (washout) por 2 semanas. Os pacientes iniciaram o tratamento com cápsulas de Cloridrato de Sevelâmer ou comprimidos de acetato de cálcio, 3 vezes por dia, com as refeições. Durante cada período de tratamento de 8 semanas, em três pontos distintos de tempo, a dose de um ou outro agente podia ser titulada até um comprimido ou cápsula por refeição (3 por dia), para controlar o fósforo sérico. Tanto Cloridrato de Sevelâmer como o acetato de cálcio diminuíram significativamente o fósforo sérico médio em cerca de 2 mg/dL.
Tabela 1: Fósforo Sérico Médio (mg/dL) Basal e no Ponto Final
| - | Cloridrato de Sevelâmer (N=81) |
Acetato de cálcio |
|
Valor basal no final da suspensão do uso do quelante de fosfato (washout) |
8,4 |
8,0 |
|
Alteração em relação ao valor basal no ponto final (Intervalo de confiança de 95%) |
-2,0* (-2,5; -1,5) |
-2,1* |
* p <0,0001, dentro da comparação do grupo de tratamento.
A figura 1 mostra que a proporção de pacientes que atingiram um determinado nível de redução de fósforo sérico é comparável entre os dois grupos de tratamento. Por exemplo, cerca de metade dos pacientes em cada grupo teve uma redução de pelo menos 2 mg/dL ao final do estudo. 2
Figura 1: Porcentagem cumulativa de pacientes (eixo-Y) que atingiu uma alteração no nível de fósforo em relação ao valor basal, tão significativa quanto o valor apresentado no eixo-X. A mudança à esquerda da curva indica uma melhor resposta
O consumo médio diário no final do tratamento foi de 4,9 g de Cloridrato de Sevelâmer (intervalo de 0 a 12,6 g) e 5,0 g de acetato de cálcio (intervalo de 0 a 17,8 g). Durante o tratamento com acetato de cálcio, 22% dos pacientes apresentaram cálcio sérico ≥ 11 mg/dL, em pelo menos uma ocasião, contra 5% no tratamento com Cloridrato de Sevelâmer (p < 0,05). Assim, o risco de desenvolvimento de hipercalcemia com Cloridrato de Sevelâmer é menor, em comparação com acetato de cálcio.2
O colesterol de baixa densidade (LDL) médio e o colesterol total médio diminuíram significativamente no tratamento com Cloridrato de Sevelâmer (-24% e -15%, respectivamente). Nem o LDL nem o colesterol total mudaram no tratamento com acetato de cálcio. Os triglicérides, o colesterol de lipoproteínas de alta densidade (HDL) e a albumina não se alteraram nos dois tratamentos.
Reduções similares no fósforo sérico e no colesterol LDL foram observadas em um estudo aberto, nãocontrolado de 8 semanas em 172 pacientes com doença renal terminal sob hemodiálise.1
Estudo paralelo de Cloridrato de Sevelâmer e acetato de cálcio ou carbonato de cálcio
Duzentos pacientes com DRC, sob hemodiálise, que estavam hiperfosfatêmicos (fósforo sérico > 5,5 mg/dL), após um período de suspensão do uso de quelantes de fosfato (washout) por 2 semanas, foram randomizados para receber comprimidos de Cloridrato de Sevelâmer 800 mg (N = 99) ou cálcio, sendo acetato de cálcio (N = 54) ou carbonato de cálcio (N = 47).3 O acetato de cálcio e o carbonato de cálcio produziram diminuições comparáveis no fósforo sérico. Na semana 52, usando a abordagem com base na observação mais recente, tanto Cloridrato de Sevelâmer como cálcio, diminuíram significativamente o fósforo sérico médio.
Tabela 2: Fósforo Sérico Médio (mg /dL) e Produto Iônico (mg2 /dL2 ) Basal e no Final do Tratamento
| - | - | Cloridrato de Sevelâmer (N=94) |
Cálcio |
|
Fósforo |
Valor basal Alteração do valor basal ao final do estudo |
7,5 -2,1 |
7,3 |
|
Cálcio X Produto iônico fósforo |
Valor basal Alteração do valor basal ao final do estudo |
70,5 -19,4 |
68,4 |
Sessenta e um por cento dos pacientes tratados com Cloridrato de Sevelâmer e 73% dos pacientes tratados com cálcio completaram as 52 semanas de tratamento.3 A principal razão para o abandono do tratamento com Cloridrato de Sevelâmer foram eventos adversos gastrointestinais.
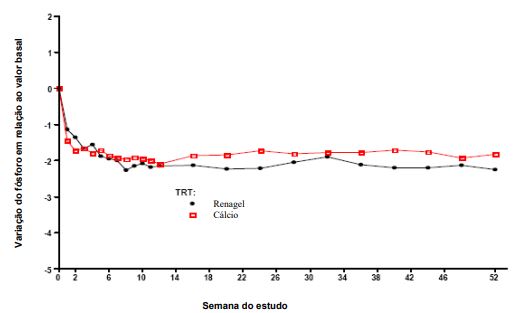
A Figura 2, um gráfico da variação do fósforo em relação ao valor basal, para os pacientes que completaram o tratamento, mostra a durabilidade da resposta nestes pacientes.3
Figura 2: Alteração média de fósforo em relação ao valor basal para os pacientes que completaram o tratamento de 52 semanas
O consumo médio diário no final do tratamento foi de 6,5 g de Cloridrato de Sevelâmer (intervalo de 0,8 a 13 g), ou cerca de oito comprimidos de 800 mg (intervalo de 1 a 16 comprimidos), 4,6 g de acetato de cálcio (intervalo de 0,7 a 9,5 g) e 3,9 g de carbonato de cálcio (intervalo de 1,3 a 9,1 g). Durante o tratamento com cálcio, 34% dos pacientes apresentaram cálcio sérico corrigido para a albumina ≥ 11,0 mg/dl em pelo menos uma ocasião contra 7% no tratamento com Cloridrato de Sevelâmer (p <0,05). Assim, o risco de desenvolvimento de hipercalcemia com Cloridrato de Sevelâmer é menor em comparação com quelantes a base de cálcio.3
O colesterol LDL médio e o colesterol total médio diminuíram significativamente (p < 0,05) no tratamento com Cloridrato de Sevelâmer (-32% e -20%, respectivamente), em comparação com tratamento com cálcio (+0,2% e -2%, respectivamente). Os triglicérides, o colesterol HDL e a albumina não se alteraram.3
Estudo paralelo de Cloridrato de Sevelâmer ou acetato de cálcio em pacientes sob diálise peritoneal
Cento e quarenta e três (143) pacientes sob diálise peritoneal que estavam hiperfosfatêmicos (fósforo sérico > 5,5 mg/dL), após um período de duas semanas de suspensão do uso de quelantes de fosfato (washout), foram randomizados para receber comprimidos de Cloridrato de Sevelâmer 800 mg (N = 97) ou acetato de cálcio (N = 46). O tratamento durante 12 semanas com Cloridrato de Sevelâmer foi não-inferior ao acetato de cálcio na redução de fósforo sérico. Houve mudanças estatisticamente significativas nos níveis de fósforo sérico (p <0,001) relativamente ao valor basal, tanto para o grupo do Cloridrato de Sevelâmer (-1,61 mg/dL de 7,48 mg/dL) como para o grupo do acetato de cálcio (-1,81 mg/dL de 7,29 mg/dL).5
O consumo médio diário no final do tratamento foi de 5,9 g de Cloridrato de Sevelâmer (intervalo de 0,8 a 14,3 g) e 4,3 g de acetato de cálcio (intervalo de 1,7 a 9,0 g). Durante o tratamento com acetato de cálcio, 18% dos pacientes tinham, no final do estudo, um cálcio sérico corrigido para a albumina ≥ 11,0 mg/dL contra 2% para o Cloridrato de Sevelâmer (p = 0,001).5
Uma diminuição estatisticamente significativa do valor basal do colesterol total, LDL e colesterol não-HDL foi observada no grupo tratado com Cloridrato de Sevelâmer, mas não no grupo tratado com cálcio.5
Referências Bibliográficas
1. Protocol No. GTC-36-302: An Open Label, Dose Titration Study of Renagel® in Hemodialysis Patients. Disponível em: Acesso em: 10 de novembro de 2017
2. Protocol GTC-36-301. An Open Label, Cross-over Study of Renagel® and Calcium Acetate in Hemodialysis Patients. Disponível em: < http://en.sanofi.com/img/content/study/GTC-36- 301_summary.pdf> Acesso em: 10 de novembro de 2017
3. Protocol GTC-49-301: A Randomized, Open Label, Parallel Design Study of Sevelamer Hydrochloride (Renagel®) and Calcium-Based Phosphate Binders in Hemodialysis Patients – Treat to Goal. Disponível em: Acesso em: 10 de novembro de 2017
4. Protocol GTC-10-201: A Randomized, Double-Blind, Placebo-Controlled, Parallel Design Evaluation of Renagel® in Lowering Serum Phosphorus in Hemodialysis Patients. Disponível em: Acesso em: 10 de novembro de 2017
5. SCIENTIFIC DISCUSSION. Procedure No: EMEA/H/C/000254/II/56. Disponível em: < http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Scientific_Discussion_- _Variation/human/000254/WC500052258.pdf> Acesso em: 10 de novembro de 2017
6. Protocol GTC-10-202: An Open Label Dose Titration Study of Renagel® in Hemodialysis Patients. Disponível em: Acesso em: 10 de novembro de 2017
Características Farmacológicas
Os pacientes com doença renal crônica retêm fósforo e podem desenvolver hiperfosfatemia. Altas concentrações de fósforo podem precipitar o cálcio sérico, resultando em calcificação ectópica. Quando o produto das concentrações séricas de cálcio e fósforo (Ca x P) excede a 55 mg2 /dL2 , há um risco aumentado para a ocorrência de calcificação ectópica. A hiperfosfatemia pode levar ao desenvolvimento de hiperparatireoidismo secundário na insuficiência renal. Um aumento nos níveis de paratormônio (PTH) é característico dos pacientes com doença renal crônica. Níveis aumentados de PTH podem levar à osteíte fibrosa. Uma diminuição no fósforo sérico pode diminuir os níveis de PTH sérico.
O tratamento da hiperfosfatemia inclui a redução da ingestão alimentar de fosfato, a inibição da absorção intestinal de fosfato com quelantes de fosfato e a remoção do fosfato por diálise. Cloridrato de Sevelâmer, tomado com as refeições mostrou diminuição das concentrações de fósforo sérico em pacientes com doença renal crônica que estão sob hemodiálise. Estudos in vitro demonstraram que as formulações em cápsula e em comprimido ligam-se ao fosfato na mesma proporção.
O tratamento com Cloridrato de Sevelâmer também resulta numa diminuição da lipoproteína de baixa densidade (LDL) e dos níveis de colesterol sérico total.
Propriedades Farmacodinâmicas
Cloridrato de Sevelâmer contém Cloridrato de Sevelâmer, um polímero de poli (cloridrato de alilamina), ligante de fosfato não-absorvido, isento de metal e cálcio. Este contém aminas múltiplas separadas por um carbono da cadeia polimérica. Estas aminas ficam numa forma parcialmente protonada no intestino e interagem com moléculas de fosfato através de ligação iônica e de hidrogênio. Por ligação com o fosfato do trato digestivo, o Cloridrato de Sevelâmer diminui a concentração de fosfato no soro.
Em estudos clínicos, o Cloridrato de Sevelâmer demonstrou ser eficaz na redução de fósforo sérico em pacientes sob hemodiálise ou diálise peritoneal.
O Cloridrato de Sevelâmer diminui a incidência de episódios hipercalcêmicos em comparação com pacientes usando quelantes de fosfato a base de cálcio isolado. Foi demonstrado que os efeitos sobre o fosfato e o cálcio foram mantidos ao longo de um estudo com um ano de acompanhamento.
O Cloridrato de Sevelâmer demonstrou se ligar aos ácidos biliares in vitro e in vivo em modelos experimentais com animais. A ligação aos ácidos biliares por resinas de troca iônica é um método bem estabelecido de redução de colesterol no sangue. Em estudos clínicos, tanto o colesterol total médio como o colesterol LDL, diminuíram em 15-31%. Este efeito é observado após 2 semanas e é mantido com o tratamento de longo prazo. Os triglicérides, o colesterol HDL e a albumina não se alteraram.
Nos estudos clínicos em pacientes sob hemodiálise, o Cloridrato de Sevelâmer isolado, não teve um efeito consistente e clinicamente significativo sobre o paratormônio intacto sérico (iPTH). Em pacientes com hiperparatireoidismo secundário, Cloridrato de Sevelâmer deve ser utilizado dentro do contexto de uma abordagem terapêutica múltipla, que pode incluir suplementos de cálcio e 1,25-diidroxi vitamina D3 ou um dos seus análogos, para diminuir os níveis de paratormônio intacto (iPTH).
Propriedades Farmacocinéticas
Um estudo de equilíbrio de massa, utilizando Cloridrato de Sevelâmer marcado com C14, em 16 voluntários sadios do sexo masculino e feminino, mostrou que o Cloridrato de Sevelâmer não é absorvido sistemicamente. Não foram realizados estudos de absorção em pacientes com doença renal.
Em estudos clínicos, o tempo médio estimado para início da ação terapêutica do medicamento foi de duas semanas.
Qual a composição do Foslamer?
Cada comprimido revestido contém:
|
Cloridrato de sevelâmer* |
800 mg |
|
Excipiente** q.s.p |
1 comprimido revestido |
*Equivalente a 656 mg de sevelâmer.
**Celulose microcristalina + dióxido de silício, copovidona, hipromelose + macrogol + povidona e ácido esteárico.
Apresentação do Foslamer
Foslamer® comprimido revestido de 800 mg - Embalagem contendo 60, 120 e 180 comprimidos revestidos.
Uso oral.
Uso adulto acima de 18 anos de idade.
Medicamento similar equivalente ao medicamento de referência.
Como devo armazenar o Foslamer?
Conservar em temperatura ambiente (15 º C e 30º C). Proteger da luz e manter em lugar seco. Manter o recipiente bem fechado e em sua embalagem original.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com prazo de validade vencido. Guarde-o em sua embalagem original.
Características do medicamento
Comprimido revestido oblongo, de cor branca a amarelada, biconvexo e bissectado. Ao abrir o frasco, o produto pode apresentar um odor característico de amônia, sem prejuízo da segurança e eficácia ao paciente.
Antes de usar observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Dizeres Legais do Foslamer
Registro MS nº: 1.0583.0653
Farm.Resp.:
Dra. Maria Geisa P. de Lima e Silva
CRF - SP nº. 8.082
Registrado por:
Germed Farmacêutica Ltda.
Rod. Jornalista Francisco Aguirre Proença, Km 08 Chácara Assay,
Hortolândia – SP
CEP 13186-901
CNPJ: 45.992.062/0001-65
Indústria Brasileira
Fabricado e embalado por:
EMS S/A
Hortolândia / SP
SAC:
0800-7476000
Doenças relacionadas
Quer saber mais?
Consulta também aBula do Cloridrato de Sevelâmer
O conteúdo desta bula foi extraído manualmente da bula original, sob supervisão técnica do(a) farmacêutica responsável: Karime Halmenschlager Sleiman (CRF- PR 39421). Última atualização: 18 de Março de 2025.