Bula do Skyrizi
Princípio Ativo:Risanquizumabe
Classe Terapêutica:Inibidores Da Interleucina
Skyrizi, para o que é indicado e para o que serve?
Psoríase em placas
Skyrizi® (risanquizumabe) é indicado para o tratamento de psoríase em placas (doença da pele relativamente comum, crônica e não contagiosa que forma placas secas, avermelhadas com escamas prateadas ou esbranquiçadas) moderada a grave em pacientes adultos que são candidatos a terapia sistêmica ou fototerapia.
Artrite psoriásica
Skyrizi® (risanquizumabe), em monoterapia ou em combinação com metotrexato (MTX), é indicado para o tratamento da artrite psoriática ativa em adultos que tiveram uma resposta inadequada ou que foram intolerantes a um ou mais medicamentos antirreumáticos modificadores da doença (DMARDs).
Doença de Crohn
Skyrizi® (risanquizumabe) é indicado para o tratamento da doença de Crohn (DC) ativa, moderada a grave em pacientes adultos.
Colite ou retocolite ulcerativa
Skyrizi® (risanquizumabe) é indicado para o tratamento da colite ou retocolite ulcerativa (RCU) ativa moderada a grave em pacientes adultos.
Como o Skyrizi funciona?
O Skyrizi® (risanquizumabe) funciona bloqueando uma proteína do organismo chamada IL-23, que causa inflamação.
Psoríase em placas
Skyrizi® (risanquizumabe) reduz o processo inflamatório e portanto, ajuda a melhorar as lesões e aspecto da pele e a aparência das unhas. Também reduz os sintomas da psoríase em placas, como queimação, coceira, dor, vermelhidão e descamação.
Artrite psoriásica
Skyrizi® (risanquizumabe) reduz a inflamação e pode, portanto, ajudar a reduzir a dor, rigidez e inchaço nas articulações e ao redor delas, dor e rigidez na coluna, lesões de psoríase na pele e nas unhas, e pode limitar os danos aos ossos e cartilagem das articulações. Esses efeitos podem melhorar as atividades diárias normais, reduzir o cansaço e melhorar a qualidade de vida.
Doença de Crohn
O Skyrizi® (risanquizumabe) reduz a inflamação e pode, portanto, ajudar a reduzir os sinais e sintomas da doença, como dor abdominal, diarreia e cansaço, bem como melhorar a cicatrização do intestino, o que pode ajudar a melhorar a qualidade de vida.
Colite ou Retocolite Ulcerativa
Skyrizi® (risanquizumabe) reduz a inflamação e pode, portanto, ajudar a reduzir os sinais e sintomas da doença, como diarreia, sangue nas fezes e cansaço, bem como induzir e manter a cicatrização do intestino nestes pacientes, com isso, reduzindo e/ou descontinuando o uso de corticosteroide, o que pode ajudar a melhorar a qualidade de vida.
Quais as contraindicações do Skyrizi?
Skyrizi® (risanquizumabe) não deve ser usado em pacientes alérgicos ao risanquizumabe ou a qualquer um dos componentes da formulação e em pacientes com infecções clinicamente ativas importantes (por exemplo: tuberculose ativa).
Como usar o Skyrizi?
Utilize este medicamento exatamente como indicado pelo seu médico, farmacêutico ou enfermeiro. Fale com o seu médico, farmacêutico ou enfermeiro se tiver dúvidas sobre como usar este medicamento.
Psoríase em placas e artrite psoriásica
Skyrizi® (risanquizumabe) é administrado na forma de 2 injeções sob a pele (chamadas “injeções subcutâneas”).
Você e o médico, farmacêutico ou enfermeiro decidirão se você deve injetar Skyrizi® (risanquizumabe) por conta própria. Não administre Skyrizi® (risanquizumabe), a menos que você tenha sido treinado por um médico, farmacêutico ou enfermeiro. Um cuidador do paciente também pode administrar as injeções após o treinamento.
Se você for utilizar Skyrizi® (risanquizumabe) 75 mg/0,83 mL, devem ser administradas, consecutivamente, 2 injeções.
Cada seringa pronta para uso ou caneta preenchida são de uso único.
Os pacientes não devem administrar a injeção em áreas onde a pele está sensível, machucada, avermelhada, endurecida ou afetada por psoríase. A administração de Skyrizi® (risanquizumabe) na parte superior externa do braço só pode ser realizada por um profissional de saúde ou cuidador.
Skyrizi® (risanquizumabe) 150 mg/mL em caneta preenchida
Antes da administração da caneta preenchida, os pacientes devem remover a embalagem do refrigerador e aguardar que ela atinja a temperatura ambiente, sem contato direto com a luz solar (30 a 90 minutos), sem retirar a caneta preenchida da embalagem.
Skyrizi® (risanquizumabe) 75 mg/0,83 mL em seringa pronta para uso
Antes da administração da seringa pronta para uso, os pacientes devem remover a embalagem do refrigerador e aguardar que ela atinja a temperatura ambiente, sem contato direto com a luz solar (15 a 30 minutos), sem retirar a(s) seringa(s) preenchida(s) da embalagem.
Qualquer medicamento não utilizado ou resíduos devem ser eliminados de acordo com a regulamentação local.
Leia as instruções completas antes de usar Skyrizi® (risanquizumabe).
Skyrizi® (risanquizumabe) 75 mg/0,83 mL – seringa pronta para uso
Informações importantes para saber como aplicar Skyrizi® (risanquizumabe)
- Leia atentamente as instruções sobre como aplicar Skyrizi® (risanquizumabe) antes de administrar uma injeção e siga-as passo a passo. Fale com o médico, farmacêutico ou enfermeiro se precisar de ajuda;
- Marque as datas no seu calendário para saber quando usar o Skyrizi® (risanquizumabe);
- Mantenha o Skyrizi® (risanquizumabe) na embalagem original para protegê-lo da luz até a hora de usá-lo;
- Não injete se o líquido estiver turvo ou contiver flocos ou partículas grandes. O líquido deve estar incolor a ligeiramente amarelo e pode conter pequenas partículas brancas ou translúcidas;
- Não use se a seringa pronta para uso estiver vencida;
- Não use se o líquido tiver sido congelado (mesmo se descongelado);
- Não agite a seringa;
- Não use se a seringa pronta para uso tiver sido derrubada ou danificada;
- Não use se a tampa da seringa estiver quebrada ou faltando. Devolva este medicamento à farmácia;
- Não remova a tampa da agulha até o momento da injeção.
Para uma administração mais confortável:
Retire a embalagem da geladeira e deixe-a em temperatura ambiente, longe da luz direta do sol, por 15 a 30 minutos antes da injeção.
- Não retire as seringas da embalagem até o momento da aplicação;
- Não aqueça o Skyrizi® (risanquizumabe) de qualquer outra forma. Por exemplo, não aqueça em micro-ondas ou em água quente.
Siga as etapas abaixo cada vez que utilizar Skyrizi® (risanquizumabe) 75 mg/0,83 mL – seringa pronta para uso:
Passo 1
- Coloque os seguintes itens sobre uma superfície limpa e plana:
- 2 seringas preenchidas e 2 lenços umedecidos com álcool;
- 2 bolas de algodão ou compressas de gaze;
- Recipiente de descarte especial.
- Lave e seque as mãos;
- Comece com uma seringa para a primeira injeção;
- Para uma dose completa, são necessárias 2 injeções, uma após a outra.
Passo 2
- Escolha a partir destas 3 áreas o local da injeção:
- Frente da coxa esquerda;
- Frente da coxa direita;
- Barriga (abdômen) a pelo menos 5 cm ao redor do umbigo.
- Para a segunda seringa, injetar a pelo menos 3 cm da primeira injeção. Não injetar no mesmo local. Antes de cada aplicação, limpar o local da injeção fazendo movimentos circulares com um lenço umedecido em álcool.
- Não tocar nem assoprar o local da injeção após limpá-lo. Deixar a pele secar antes de realizar a injeção.
- Não injetar por cima da roupa;
- Não injetar na pele que esteja dolorida, machucada, avermelhada, dura, com cicatrizes ou com estrias;
- Não injetar em áreas afetadas pela psoríase.
Passo 3
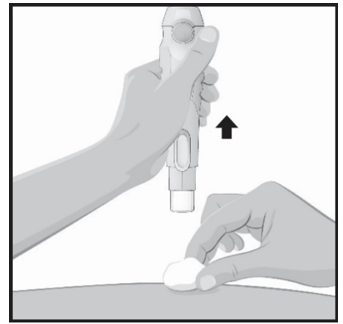
Segure a seringa com a agulha tampada apontando para baixo, como mostrado na figura.
- Verifique o líquido na seringa.
- É normal ver bolhas na janela;
- O líquido deve estar incolor a ligeiramente amarelo e pode conter pequenas partículas brancas ou translúcidas;
- Não use se o líquido estiver turvo ou apresentar flocos ou partículas grandes.
Passo 4
- Remova a tampa da agulha.
- Segurar a seringa com uma mão, entre o suporte do dedo e a tampa da agulha;
- Com a outra mão, puxar delicadamente a tampa da agulha;
- Não segurar ou puxar o êmbolo ao remover a tampa da agulha;
- É possível ver uma gota de líquido no final da agulha. Isto é normal;
- Descartar a tampa da agulha;
- Não tocar na agulha com os seus dedos ou deixar que ela encoste em qualquer superfície.
Passo 5
- Segure o corpo da seringa em uma mão entre o polegar e o indicador, como se fosse um lápis;
- Aperte delicadamente a área da pele limpa com a outra mão e segure-a com firmeza;
- Insira a agulha completamente na pele em um ângulo de aproximadamente 45 graus usando um movimento rápido e curto;
- Mantenha a seringa estável no mesmo ângulo.
Passo 6
- Lentamente empurre o êmbolo até que todo o líquido seja injetado;
- Puxe a agulha para fora da pele, mantendo a seringa no mesmo ângulo;
- Lentamente, retire o polegar do êmbolo. A agulha será então coberta pelo protetor de agulha;
- O protetor de agulha não será ativado a menos que todo o líquido seja injetado;
- Fale com o médico, farmacêutico ou enfermeiro se acreditar que não administrou uma dose completa.
- Pressione uma bola de algodão ou gaze no local da injeção e segure por 10 segundos;
- Não esfregue a pele onde você injetou. Você pode apresentar um leve sangramento no local da injeção. Isto é normal.
Passo 7
Para uma dose completa, são necessárias 2 injeções, uma após a outra.
- Repita os passos 2 a 6 com a segunda seringa;
- Injete a segunda seringa logo após a primeira injeção, mas a pelo menos 3 cm de distância do local da primeira injeção.
Passo 8
Descarte as seringas usadas no recipiente de descarte especial, imediatamente após o uso.
- Não descarte seringas usadas no lixo doméstico;
- O médico, farmacêutico ou enfermeiro lhe dirão como devolver o recipiente de descarte cheio.
Skyrizi® (risanquizumabe) 150 mg/mL – caneta preenchida

Informações importantes para saber como aplicar Skyrizi® (risanquizumabe) 150 mg/mL – caneta preenchida
- Leia atentamente as instruções sobre como aplicar Skyrizi® (risanquizumabe) antes de administrar uma injeção e siga-as passo a passo. Falar com o médico, farmacêutico ou enfermeiro se precisar de ajuda;
- Marque as datas no calendário para saber quando usar a próxima dose de Skyrizi® (risanquizumabe);
- Mantenha o Skyrizi® (risanquizumabe) na embalagem original para protegê-lo da luz até a hora de usá-lo;
- Retire a embalagem da geladeira e deixe-a em temperatura ambiente, longe da luz direta do sol, por 30 a 90 minutos antes da injeção;
- Não injetar se o líquido estiver turvo ou contiver flocos ou partículas grandes. O líquido deve estar incolor a ligeiramente amarelo e pode conter pequenas partículas brancas ou translúcidas;
- Não usar se a caneta estiver vencida;
- Não usar se o líquido tiver sido congelado (mesmo se descongelado);
- Não agitar a caneta;
- Não usar se a caneta tiver sido derrubada ou danificada;
- Não usar se a embalagem estiver corrompida. Devolver este medicamento à farmácia;
- Não remover a tampa cinza escuro até o momento antes da injeção.
Siga as etapas abaixo todas as vezes que utilizar Skyrizi® (risanquizumabe) 150 mg/mL – caneta preenchida:
Passo 1
- Retirar a embalagem da geladeira e deixe-a em temperatura ambiente, longe da luz direta do sol, por 30 a 90 minutos antes da injeção;
- Não retirar a caneta da embalagem enquanto Skyrizi® (risanquizumabe) 150mg/mL não atingir a temperatura ambiente;
- Não aquecer o Skyrizi® (risanquizumabe) de qualquer outra forma. Por exemplo, não aquecer em micro-ondas ou em água quente;
- Não usar se o líquido tiver sido congelado (mesmo se descongelado).
Passo 2
- Colocar os seguintes itens sobre uma superfície limpa e plana:
- 1 caneta preenchida;
- 1 lenço umedecido com álcool;
- 1 bola de algodão ou compressa de gaze;
- Recipiente de descarte especial;
- Lavar e secar as mãos.
Passo 3
- Escolher a partir destas 3 áreas, o local da injeção:
- Frente da coxa esquerda;
- Frente da coxa direita;
- Barriga (abdômen) a pelo menos 5 cm ao redor do umbigo.
- Antes de cada aplicação, limpar o local da injeção fazendo movimentos circulares com um lenço umedecido em álcool.
- Não tocar nem assoprar o local da injeção após limpá-lo. Deixar a pele secar antes de realizar a injeção;
- Não injetar por cima da roupa;
- Não injetar na pele que esteja dolorida, machucada, avermelhada, dura, com cicatrizes ou com estrias;
- Não injetar em áreas afetadas pela psoríase.
Passo 4
- Segurar a caneta com a tampa cinza escura apontando para cima, como mostrado na figura.
- Retirar a tampa cinza escuro;
- Descartar a tampa cinza escuro no lixo.
- Verificar o líquido através da janela de visualização.
- É normal ver bolhas no líquido;
- O líquido deve estar incolor a ligeiramente amarelo e pode conter pequenas partículas brancas ou translúcidas;
- Não usar se o líquido estiver turvo ou apresentar flocos ou partículas grandes.
Passo 5
- Segurar a caneta com os dedos no suporte para dedos cinza;
- Vire a caneta de forma que o protetor de agulha branco aponte para o local escolhido da injeção e seja possível ver o botão ativador verde;
- Apertar delicadamente a área da pele limpa com a outra mão, até fazer uma prega e segure-a com firmeza;
- Posicione o protetor de agulha branco reto (ângulo de 90º) e pressione contra o local de injeção escolhido.
Passo 6
- Segurar a caneta de forma que seja possível visualizar o botão ativador verde e a janela de inspeção;
- Apertar e manter pressionada a caneta contra o local da injeção;
- A caneta só será ativada se o protetor de agulha branco tiver sido pressionado contra o local da injeção antes de pressionar o botão ativador verde;
- Pressionar o botão ativador verde e segurar por 15 segundos;
- Um “clique” alto significa que a injeção iniciou.
- Um “clique” alto significa que a injeção iniciou.
Passo 7
- Manter a caneta pressionada no local da injeção;
- A injeção está completa quando:
- A caneta emitir o segundo “clique” ou;
- O indicador amarelo preencher a janela de visualização.
- Esse processo leva até 15 segundos.
Passo 8
- Quando a injeção estiver finalizada, retira a caneta lentamente da pele;
- O protetor de agulha branco irá cobri-la e um novo “clique” será emitido;
- Depois de finalizado o processo, pressionar a bola de algodão ou gaze no local da injeção.
- Não esfregar a pele onde ocorreu a injeção;
- Um leve sangramento no local da injeção é normal.
Passo 9
- Descartar a caneta usada no recipiente de descarte especial, imediatamente após o uso.
- Não descarte caneta usada no lixo doméstico;
- O médico, farmacêutico ou enfermeiro deve orientar o paciente como devolver o recipiente de descarte cheio.
Doença de Crohn e Colite ou retocolite ulcerativa
Skyrizi® (risanquizumabe) 60 mg/mL para uso intravenoso na indução do tratamento
- Skyrizi® (risanquizumabe) deve ser preparado com técnica asséptica por um profissional de saúde;
- Antes da administração intravenosa de Skyrizi® (risanquizumabe) seguir as instruções abaixo para diluição de Skyrizi® (risanquizumabe) para uma concentração final do fármaco de aproximadamente 1,2 mg/mL a 6 mg/mL:
Indicação | Dose de indução via IV | Número de frascos de Skyrizi® (risanquizumabe) 600 mg/ 10 mL | Volume de solução Skyrizi® (risanquizumabe) 600 mg/ 10 mL | Volume total de injeção de dextrose a 5% |
Doença de Crohn | 600 mg | 1 | 10 mL | 100 mL, ou 250 mL, ou 500 mL |
Colirw ou retocolite ulcerativa | 1200 mg | 2 | 20 mL | 250 mL, 500 mL |
- Antes do início da infusão intravenosa, o conteúdo da bolsa de infusão ou frasco de vidro deve estar à temperatura ambiente.
- Faça a infusão da solução diluída por um período de pelo menos uma hora para dose de 600 mg de Skyrizi® (risanquizumabe) e de pelo menos duas horas para Skyrizi® (risanquizumabe) 1200 mg. A infusão deve ser administrada completamente dentro de 8 horas após a diluição na bolsa de infusão.
- Skyrizi® (risanquizumabe) solução injetável não deve ser administrado concomitantemente na mesma linha intravenosa com outros medicamentos.
- Cada frasco destina-se a uma única utilização e qualquer medicamento não utilizado ou resíduos devem ser descartados de acordo com as exigências locais.
Manuseio e armazenamento do frasco para injetáveis e da solução diluída
- A solução no frasco para injetáveis e as diluições não devem ser agitadas.
- A infusão preparada deve ser utilizada imediatamente. Se não for usada imediatamente, a solução diluída de Skyrizi® (risanquizumabe) pode ser armazenada (protegida da luz) por até 20 horas entre 2 °C e 8 °C.
- Imediatamente após o preparo ou remoção do refrigerador, a solução diluída de Skyrizi® (risanquizumabe) pode ser armazenada (protegida da luz solar direta e indireta) por 8 horas (tempo cumulativo após a preparação incluindo o período de armazenamento e infusão).
- A exposição à luz de ambientes internos é aceitável durante o armazenamento e administração à temperatura ambiente.
- Cada frasco destina-se a uma única utilização e qualquer medicamento não utilizado ou resíduos devem ser descartados de acordo com as exigências locais.
- Não congelar.
Skyrizi® (risanquizumabe) 180 mg/1,2 mL e 360 mg/2,4 mL (150mg/mL) com dispositivo autoinjetor para uso subcutâneo na manutenção do tratamento
Informações importantes para antes da administração do Skyrizi® (risanquizumabe) com dispositivo autoinjetor
- Você deve receber treinamento sobre como administrar o Skyrizi® (risanquizumabe) antes de administrar uma injeção. Converse com o médico, farmacêutico ou enfermeiro se precisar de ajuda, ou com a Central de Relacionamento da AbbVie;
- Marque as datas de administração das doses na sua agenda para saber quando usar o Skyrizi® (risanquizumabe);
- O dispositivo autoinjetor de uso único foi desenvolvido para uso somente com o carpule preenchido contendo Skyrizi® (risanquizumabe);
- Mantenha o Skyrizi® (risanquizumabe) na caixa original para proteger o medicamento da luz, até a hora de usá-lo;
- Retire a embalagem da geladeira e deixe-a em temperatura ambiente, fora da luz solar direta, por pelo menos 45 minutos até 90 minutos antes de aplicar;
- Não deixe o dispositivo autoinjetor ser molhado com água ou qualquer outro líquido. Não toque no botão de início (botão redondo de cor cinza) até o dispositivo autoinjetor carregado com o carpule ser fixado na pele e estar pronto para administração, pois esse só pode ser acionado uma única vez;
- Atividade física deve ser limitada durante o processo de administração. Movimentação moderada pode ser realizada, como caminhar, pegar algo e curvar-se;
- Não demore para administrar o medicamento depois de carregar o carpule no dispositivo autoinjetor. A demora pode secar o medicamento e o dispositivo autoinjetor pode não funcionar depois;
- Não administre se o líquido na janela de inspeção estiver turvo ou contiver flocos ou partículas grandes. O líquido deve parecer transparente a amarelo e pode conter pequenas partículas brancas ou transparentes;
- Não agite a embalagem, o carpule ou o dispositivo autoinjetor;
- Mantenha dispositivos eletrônicos, incluindo telefones celulares, a pelo menos 30 cm do dispositivo autoinjetor até que a injeção esteja concluída. O impacto potencial da interferência eletrônica é desconhecido quando o dispositivo autoinjetor é operado dentro de 30 cm;
- Não exponha o dispositivo autoinjetor ao ambiente de ressonância magnética (RM) (por exemplo, exames de imagem por ressonância magnética).
Não utilize o medicamento:
- Se estiver vencido;
- Se o líquido tiver sido congelado (mesmo se descongelado);
- Se o carpule ou o dispositivo autoinjetor tiver caído ou estiver danificado;
- Se a embalagem estiver rompida ou danificada;
- Se a vedação branca da embalagem de plástico estiver rompida ou ausente.
Leia as instruções completas, antes de usar o Skyrizi® (risanquizumabe).
Dispositivo autoinjetor




Siga as etapas abaixo, sempre que usar o Skyrizi® (risanquizumabe):
Etapa 1 - Prepare-se
- Retire a embalagem da geladeira e deixe-a em temperatura ambiente, protegido da luz solar direta, por pelo menos 45 minutos até 90 minutos antes de administrar.
- Verifique a data de validade (Val.) na embalagem. Não use o Skyrizi® (risanquizumabe), se estiver vencido;
- Não remova o carpule, nem o dispositivo autoinjetor da embalagem, enquanto estiver esperando o Skyrizi® (risanquizumabe) atingir a temperatura ambiente;
- Não aqueça o Skyrizi® (risanquizumabe) de nenhuma forma. Por exemplo, não o aqueça em um microondas ou em água quente.
- Reúna todos os suprimentos e lave as mãos. Coloque os seguintes itens em uma superfície limpa e plana, contendo 1 dispositivo autoinjetor e 1 carpule preenchido:
- 2 lenços umedecidos com álcool (não incluídos na embalagem);
- 1 bola de algodão ou gaze (não incluída na embalagem);
- Recipiente de descarte especial (não incluído na embalagem).
- Lave e seque as mãos.
- Remova a vedação branca da embalagem de plástico.
- Localize a seta preta;
- Retire a vedação branca da embalagem de plástico.
- Puxe a película de plástico interna.
- Localize a abertura arredondada na película superior;
- Insira o dedo indicador na abertura e coloque o polegar no lado oposto;
- Puxe a película para removê-la e coloque-a de lado.
- Inspecione o dispositivo autoinjetor.
- Verifique se o dispositivo autoinjetor está intacto e sem danos;
- A porta cinza deve estar ligeiramente aberta;
- Se a porta cinza não abrir, pressione firmemente os sulcos da porta cinza (lado esquerdo da porta) e abra a porta;
- Não feche a porta cinza, antes que o carpule preenchido seja carregado;
- Não use o dispositivo autoinjetor se deixá-lo cair, perceber peças ausentes ou se ele estiver danificado;
- Não toque no botão cinza de início (redondo) até que seja o momento da administração, pois este só pode ser pressionado apenas uma única vez;
- Não toque na área da tampa da agulha ou na agulha.
- Se o botão cinza de início for pressionado antes de ser fixado no local da aplicação, o dispositivo autoinjetor não poderá mais ser usado. Se isso acontecer, fale com o médico, o farmacêutico, o enfermeiro, ou com a Central de Relacionamento da AbbVie, conforme aplicável.
Etapa 2 - Configurar o dispositivo autoinjetor
- Abra totalmente a porta cinza.
- Segure o dispositivo com a ponta dos dedos e pelas laterais, mantendo-o na posição vertical. Evite tocar na área da tampa da agulha, localizada atrás do dispositivo autoinjetor. A agulha está atrás da tampa da agulha;
- Gire a porta cinza totalmente para a direita para abri-la;
- Se a porta cinza não abrir, pressione firmemente os sulcos da porta cinza (lado esquerdo da porta) e abra a porta;
- Não feche a porta cinza, antes que o carpule preenchido seja carregado;
- Reserve ao lado o dispositivo autoinjetor.
- Inspecione o carpule preenchido. Remova cuidadosamente o carpule preenchido da embalagem de plástico.
- Não torça nem remova a parte superior do carpule.
- Verifique o carpule preenchido.
- O líquido deve ser transparente a amarelo e pode conter pequenas partículas brancas ou transparentes. É normal ver uma ou mais bolhas;
- Não utilize se o líquido estiver turvo, descolorido ou contiver flocos ou partículas grandes;
- O carpule e seus componentes não devem estar rachados ou quebrados;
- Não use se o líquido tiver sido congelado (mesmo se descongelado);
- Não use o carpule preenchido se deixá-lo cair, perceber peças ausentes ou se ele estiver danificado.
- Limpe a ponta inferior do carpule. Localize a ponta inferior do carpule;
- Limpe a ponta inferior do carpule com um lenço umedecido com álcool. Certifique-se de usar o lenço com álcool para limpar o centro da ponta inferior do carpule;
- Não toque na ponta inferior do carpule depois da limpeza.
- Carregue o carpule preenchido limpo no dispositivo autoinjetor.
- Não torça nem remova a parte superior do carpule preenchido “clique”;
- Insira a ponta inferior do carpule preenchido no dispositivo autoinjetor primeiro;
- Empurre firmemente o carpule preenchido para baixo, até ouvir um "clique";
- Depois de carregar o carpule preenchido, poderão aparecer algumas gotas de medicamento na parte de trás do dispositivo autoinjetor (na porta de saída da agulha). Isso é normal;
- Certifique-se que a administração do medicamento comece dentro de 5 minutos após a inclusão do carpule no dispositivo autoinjetor. A demora pode secar o medicamento.
- Feche a porta cinza. Gire a porta cinza para a esquerda e, em seguida, aperte firmemente e ouça a porta cinza fechar com um “clique”.
- A porta cinza deve permanecer travada, depois do carregamento do carpule preenchido;
- Não feche a porta cinza se o carpule preenchido não estiver totalmente inserido ou estiver ausente;
- Siga rapidamente para a próxima etapa.
Etapa 3 - Prepare para administração
- Escolha e limpe o local de injeção. Escolha entre essas 3 áreas o local da injeção:
- Parte frontal da coxa esquerda;
- Parte frontal da coxa direita;
- A barriga (abdômen) a pelo menos 5 cm do umbigo.
- Não injete em áreas da pele que se dobram ou incham naturalmente, pois o sistema autoinjetor pode descolar durante o uso;
- Antes da administração, limpe o local onde será a injeção, em um movimento circular com um lenço umedecido em álcool.
- Não toque nem sopre o local de injeção depois de limpá-lo. Deixe a pele secar antes de colocar o dispositivo autoinjetor na pele;
- Não injete através das roupas;
- Não injete na pele dolorida, com hematomas, vermelha, áspera, com cicatriz, estrias, verrugas ou muito pelo. Você pode aparar o excesso de pelos do local de injeção.
- Retire o papel de cobertura do adesivo das duas abas para expor o adesivo para aderência na pele. Vire o sistema autoinjetor para visualizar as duas abas verdes e puxar.
- Evite tocar na tampa da agulha (com a agulha dentro).
- Retire o papel de cobertura do adesivo maior, usando a aba verde, para expor o adesivo de aderência na pele;
- Retire o papel de cobertura do adesivo menor, usando a aba verde, para expor o adesivo de aderência na pele. Isso removerá a película plástica transparente, ativando o dispositivo autoinjetor.
- Verifique a luz de status, quando o dispositivo autoinjetor emitir um bipe;
- A luz de status piscará em azul, quando o dispositivo autoinjetor for ativado;
- Se a luz de status não piscar em azul, fale com o médico, farmacêutico, enfermeiro ou com a Central de Relacionamento da AbbVie, conforme aplicável;
- Não pressione o botão redondo cinza de início ainda;
- Não toque na tampa da agulha, nem na agulha;
- Não puxe o adesivo do dispositivo autoinjetor e nem permita que o adesivo dobre e cole nele mesmo.
- Se a luz de status piscar em vermelho, o dispositivo autoinjetor não está funcionando corretamente. Não continue a usá-lo. Fale com o médico, farmacêutico ou enfermeiro ou com a Central de Relacionamento da AbbVie, conforme aplicável, para obter ajuda. Se o dispositivo autoinjetor estiver conectado ao corpo, remova-o cuidadosamente da pele.
- Prepare o dispositivo autoinjetor para o posicionamento.
- Para a barriga (abdômen), mova e segure a pele para criar uma superfície firme e plana para a injeção, a pelo menos 5 cm do umbigo. Certifique-se de sentar-se reto para evitar dobras e saliências na pele;
- Não é necessário puxar a pele para aplicação na frente da coxa esquerda ou da coxa direita.
- Certifique-se de colocar o dispositivo autoinjetor de forma que a luz de status azul fique sempre visível.
- Fixe o dispositivo autoinjetor sobre a pele.
- Quando a luz azul piscar, o dispositivo autoinjetor está pronto. Coloque-o sobre a pele limpa com a luz de status visível;
- Não coloque o dispositivo autoinjetor sobre as roupas. Fixe-o diretamente sobre a pele;
- Passe o dedo ao redor do material adesivo para prendê-lo à pele;
- Não mova nem ajuste o dispositivo autoinjetor, depois que ele tiver sido fixado na pele.
- Siga rapidamente para a próxima etapa.
Etapa 4 - Administre o Skyrizi® (risanquizumabe)
- Inicie a injeção. Pressione firmemente e solte o botão cinza de início (redondo).
- Você ouvirá um "clique" e poderá sentir uma picada da agulha;
- Verifique a luz de status, quando o dispositivo autoinjetor emitir um bipe;
- Depois de iniciar a aplicação, a luz de status piscará continuamente em verde;
- Depois de iniciar a injeção, você também ouvirá sons de bombeamento, enquanto o dispositivo autoinjetor administra o medicamento.
- Não continue a usar o dispositivo autoinjetor se a luz de status piscar em vermelho. Remova cuidadosamente da pele se a luz de status piscar na cor vermelha. Se isso acontecer, fale com o médico, farmacêutico ou enfermeiro ou com a Central de Relacionamento da AbbVie, conforme aplicável.
- Aguarde o término da aplicação.
- Pode levar até 5 minutos para concluir a aplicação da dose completa do medicamento. O dispositivo autoinjetor irá parar automaticamente, quando a injeção for concluída;
- Durante a aplicação, a luz de status continuará a piscar na cor verde;
- Durante a aplicação, você ouvirá sons de bombeamento, enquanto o dispositivo autoinjetor contnuar a administrar o medicamento;
- Durante a aplicação, movimentos moderados podem ser realizados, como caminhar, pegar algo e curvar-se.
- Não continue a usar o dispositivo autoinjetor, se a luz de status piscar em vermelho. Remova-o cuidadosamente da pele, se a luz de status piscar em vermelho. Se isso acontecer, fale com o médico, farmacêutico ou enfermeiro ou com a Central de Relacionamento da AbbVie, conforme aplicável.
- A administração estará concluída quando:
- O dispositivo autoinjetor parar sozinho;
- Você escutar um bipe e a luz de status mudar para verde contínuo. Se a luz de status mudar para verde contínuo, isso significa que a aplicação está concluída.
- Remova o dispositivo autoinjetor.
- Não coloque os dedos na parte de trás do dispositivo autoinjetor, ao removê-lo da pele;
- Quando a injeção estiver concluída, segure na ponta do adesivo para retirar cuidadosamente o dispositivo autoinjetor da pele;
- Evite tocar na tampa da agulha ou na agulha na parte de trás do dispositivo autoinjetor;
- Depois de remover o dispositivo autoinjetor, você ouvirá alguns bipes e a luz de status se apagará;
- A tampa da agulha cobrirá a agulha quando o dispositivo autoinjetor for removido da pele;
- É normal ver algumas pequenas gotas de líquido na pele, depois de remover o dispositivo autoinjetor;
- Pressione uma bola de algodão ou gaze sobre o local da injeção na pele e segure por 10 segundos;
- Não esfregue o local da injeção;
- Um leve sangramento no local da injeção é normal;
- Siga para a próxima etapa.
Etapa 5 - Concluir
- Verifique o dispositivo autoinjetor. Inspecione a janela do medicamento e a luz de status;
- Verifique se o êmbolo branco preenche toda a janela do medicamento e a luz verde contínua se apaga, informando que todo o medicamento foi injetado.
- Se o êmbolo branco não preencher a janela, fale com o médico, farmacêutico ou enfermeiro ou com a Central de Relacionamento da AbbVie, conforme aplicável.
- Se o êmbolo branco não preencher a janela, fale com o médico, farmacêutico ou enfermeiro ou com a Central de Relacionamento da AbbVie, conforme aplicável.
- Descarte o dispositivo autoinjetor usado em um recipiente de descarte especial, logo depois do uso.
- O dispositivo autoinjetor contém baterias, componentes eletrônicos e uma agulha;
- Deixe o carpule dentro do dispositivo autoinjetor;
- Não jogue o dispositivo autoinjetor usado no lixo doméstico;
- O médico, farmacêutico ou enfermeiro ou a Central de Relacionamento da AbbVie, informará como devolver o recipiente de descarte de perfurocortantes. Pode haver diretrizes locais para descarte.
Posologia do Skyrizi
Dose recomendada
Psoríase em placas e Artrite psoriásica
A dose recomendada é de 150 mg, administradas por injeção subcutânea na semana 0, semana 4 e a cada 12 semanas, iniciando após a 2a dose.
Se utilizar Skyrizi® (risanquizumabe) 75 mg/0,83mL, cada dose equivale à duas injeções de 75 mg.
Se utilizar Skyrizi® (risanquizumabe) 150 mg/mL em caneta preenchida para uso, cada dose equivale a uma injeção de 150 mg/mL.
Deve-se considerar a descontinuação do tratamento em pacientes que não apresentaram resposta após 16 semanas de tratamento. Alguns pacientes com psoríase em placas com resposta parcial inicial podem melhorar subsequentemente com a continuação do tratamento além de 16 semanas.
Doença de Crohn
A dose recomendada é de 600 mg, administrada por infusão intravenosa (IV) na Semana 0, na Semana 4 e na Semana 8, seguida de 360 mg, administrada por injeção subcutânea (SC) na Semana 12, e a cada 8 semanas.
Alguns pacientes que não responderam ao tratamento na semana 12, podem beneficiar-se da terapia de manutenção continuada por mais 12 semanas. Deve-se considerar a descontinuação do tratamento em pacientes que não demonstraram evidência de benefício terapêutico até a semana 24.
Colite ou retocolite ulcerativa
A dose recomendada é de 1200 mg, administrada por infusão intravenosa (IV) na semana 0, na semana 4 e na semana 8, seguida de 180 mg, administrada por injeção subcutânea (SC) na semana 12 e, a partir de então, a cada 8 semanas.
Dose esquecida
Se uma dose for esquecida, administrar a dose o mais rápido possível. Posteriormente, retomar a administração no dia e horário regular.
Administração em populações especiais
Pacientes pediátricos
A segurança e a eficácia de Skyrizi® (risanquizumabe) em pacientes pediátricos com menos de 18 anos de idade ainda não foram estabelecidas.
Pacientes idosos
Não é necessário ajuste da dose.
Pacientes com insuficiência renal (dos rins) ou hepática (do fígado)
Não foram realizados estudos específicos para avaliar o efeito de insuficiência hepática ou renal na farmacocinética de Skyrizi® (risanquizumabe). Não se espera que estas condições tenham qualquer impacto significativo na farmacocinética dos anticorpos monoclonais e não se considera necessário ajustes na dose.
Peso corporal
O clearance de risanquizumabe e o volume de distribuição aumentam com o aumento do peso corporal, o que pode resultar em uma eficácia reduzida em pacientes com peso corporal elevado (> 130 kg). No entanto, esta observação é baseada em um número limitado de pacientes. Atualmente, não é recomendado ajuste da dose com base no peso corporal.
Siga a orientação do seu médico, respeitando sempre os horários, as doses e a duração do tratamento.
Não interrompa o tratamento sem o conhecimento do seu médico.
Superdose: o que acontece se tomar uma dose do Skyrizi maior do que a recomendada?
Em caso de superdosagem, recomenda-se que o paciente seja monitorado em relação a quaisquer sinais ou sintomas de reações adversas e que seja instituído tratamento sintomático apropriado imediatamente.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
O que devo fazer quando me esquecer de usar o Skyrizi?
Se você se esqueceu de utilizar Skyrizi® (risanquizumabe), injete uma dose logo que se lembrar. Converse com seu médico se você não tiver certeza do que fazer.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico ou cirurgião-dentista.
Quais cuidados devo ter ao usar o Skyrizi?
Rastreabilidade
Com o objetivo de melhorar a rastreabilidade de produtos biológicos, o nome comercial e o lote do medicamento utilizado devem ser registrados.
Hipersensibilidade
Reações de hipersensibilidade graves, incluindo anafilaxia, foram relatadas com o uso de Skyrizi® (risanquizumabe). Se ocorrer uma reação de hipersensibilidade (alergia) grave com você, seu médico interromperá a administração de Skyrizi® (risanquizumabe) e iniciará a terapia apropriada imediatamente.
Infecções
Skyrizi® (risanquizumabe) pode aumentar o risco de infecções.
Em pacientes com infecção crônica ou histórico de infecção recorrente, os riscos e benefícios devem ser considerados antes do médico prescrever Skyrizi® (risanquizumabe). Caso você desenvolva sinais ou sintomas de infecção clinicamente importantes, procure seu médico. Se você desenvolver infecção ou não estiver respondendo à terapia padrão para a infecção, deve ser monitorado cuidadosamente pelo médico e Skyrizi® (risanquizumabe) não deve ser administrado até que a infecção regrida.
Tuberculose
Nos estudos clínicos de Fase 3 em psoríase, dos 72 indivíduos com tuberculose (TB) latente que foram tratados concomitantemente com Skyrizi® (risanquizumabe) e receberam tratamento para a infecção latente de forma apropriada durante os estudos, nenhum desenvolveu TB ativa durante o acompanhamento médio de 61 semanas utilizando risanquizumabe. Em pacientes com tuberculose (TB) latente, o médico deve considerar terapia anti-TB (antituberculose) antes de iniciar o tratamento com Skyrizi® (risanquizumabe). O Skyrizi® (risanquizumabe) não deve ser administrado caso você apresente TB ativa.
Este medicamento pode aumentar o risco de infecções. Informe ao seu médico qualquer alteração no seu estado de saúde.
Imunizações
Antes de iniciar a terapia com Skyrizi® (risanquizumabe), a conclusão de todas as imunizações apropriadas deve ser considerada de acordo com as diretrizes atuais de imunização. Se um paciente tiver recebido vacinas vivas (viral ou bacteriana), é recomendado aguardar pelo menos 4 semanas antes de iniciar o tratamento com risanquizumabe. Os pacientes tratados com risanquizumabe não devem receber vacinas vivas durante o tratamento e por pelo menos 21 semanas após o tratamento.
Algumas vacinas são contraindicadas para quem está tomando imunossupressor. Antes de tomar qualquer vacina, informe ao profissional de saúde que você está tomando medicamento imunossupressor.
Excipientes com efeito conhecido
Skyrizi® (risanquizumabe) 75 mg/0,83 mL contém 68,0 mg de sorbitol por dose de 150 mg. O efeito aditivo de produtos administrados concomitantemente contendo sorbitol (ou frutose) e o consumo alimentar de sorbitol (ou frutose) deve ser levado em consideração. Atenção:contém sorbitol.
Skyrizi® (risanquizumabe) 75 mg/0,83 mL, 150 mg/mL, 180 mg/1,2 mL, 360 mg/2,4 mL e 600mg/10 mL contém menos de 1 mmol de sódio (23 mg) por dose, ou seja, são essencialmente “livre de sódio”.
Capacidade de dirigir veículos e operar máquinas
O Skyrizi® (risanquizumabe) não tem ou apresenta influência pouco significante na capacidade de dirigir e utilizar máquinas.
Este medicamento pode aumentar o risco de sangramento em caso de dengue ou quando associado a outros medicamentos que aumentem o efeito hemorrágico.
Quais as reações adversas e os efeitos colaterais do Skyrizi?
Experiência de estudos clínicos
Psoríase em placas
Um grupo de 2.234 pacientes foi tratado com Skyrizi® (risanquizumabe) nos estudos de desenvolvimento clínico em psoríase em placas, representando 2.167 pacientes-ano de exposição ao medicamento. Destes, 1.208 pacientes com psoríase receberam Skyrizi® (risanquizumabe) por pelo menos um ano.
Os dados dos estudos controlados por placebo e medicamento ativo foram agrupados para avaliar a segurança de Skyrizi® (risanquizumabe) por até 16 semanas. No total, 1.306 pacientes foram avaliados no grupo Skyrizi® (risanquizumabe) 150 mg. Eventos adversos graves ocorreram em 2,4% no grupo Skyrizi® (risanquizumabe) (9,9 eventos por 100 pacientes-ano) comparado a 4,0% no grupo placebo (17,4 eventos por 100 pacientes-ano), 5,0% no grupo ustequinumabe (18,4 eventos por 100 pacientes-ano) e 3,0% no grupo adalimumabe (14,7 eventos por 100 pacientes-ano).
As reações adversas ao Skyrizi® (risanquizumabe) provenientes de estudos clínicos estão listadas por classe de sistemas e órgãos do MedDRA e baseiam-se na seguinte convenção:
- Muito comum (≥1/10);
- Comum (≥1/100 a <1/10);
- Incomum (≥1 / 1.000 a <1/100);
- Rara (≥1/10.000 a <1/1.000);
- Muito rara (<1/10.000).
Infecções e infestações
- Reação muito comum (ocorre em mais de 10% dos pacientes que utilizam este medicamento): infecções do trato respiratório superiora.
- Reação comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento): micoses superficiaisb.
- Reação incomum (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento): foliculite (inflamação do folículo piloso (de um pelo)).
Distúrbios do sistema nervoso
- Reação comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento): dor de cabeçac.
Distúrbios gerais e condições do local de administração
- Reação comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento): fadigad e reações no local da injeçãoe.
a Inclui: infecção do trato respiratório (viral, bacteriana ou não especificada), sinusite [inflamação do revestimento de mucosa dos seios da face (incluindo sinusite aguda)], rinite (irritação e inflamação da mucosa nasal), nasofaringite (inflamação infecciosa da nasofaringe), faringite [inflamação da faringe (incluindo viral)], tonsilite (inflamação das amígdalas).
b Inclui: tinea pedis, tinea cruris, tinea corporis, pitiríase versicolor, tinea manuum, onicomicose.
c Inclui: dor de cabeça, dor de cabeça tensional (dor de cabeça associada à tensão muscular), dor de cabeça sinusal (associada à infecção dos seios da face).
d Inclui: fadiga, astenia (fraqueza), mal-estar.
e Inclui: hematoma no local da injeção, eritema (vermelhidão), hematoma, hemorragia, irritação, dor, prurido (coceira e/ou ardência), reação, edema (inchaço), manchas avermelhadas no local de infusão, derramamento no local de infusão, reação no local de infusão, inchaço no local de infusão.
Reações Adversas Específicas
Infecções
- Nas primeiras 16 semanas, as infecções ocorreram em 22,1% do grupo tratado com Skyrizi® (risanquizumabe) (90,8 eventos por 100 pacientes-ano) em comparação com 14,7% do grupo placebo (56,5 eventos por 100 pacientes-ano), 20,9% do grupo ustequinumabe (87,0 eventos por 100 pacientes-ano) e 24,3% do grupo adalimumabe (104,2 eventos por 100 pacientes-ano). A maioria dos casos foi não grave e de gravidade leve a moderada e não levou à descontinuação do Skyrizi® (risanquizumabe).
- Ao longo de todo o programa de psoríase, incluindo a exposição a longo prazo ao Skyrizi® (risanquizumabe), a taxa de infecções (75,5 eventos por 100 pacientes-ano) foi semelhante à observada durante as primeiras 16 semanas de tratamento.
Segurança a longo prazo
Até a Semana 52, a frequência das reações adversas foi semelhante ao perfil de segurança observado durante as primeiras 16 semanas de tratamento. Até a Semana 52, as taxas de eventos adversos graves ajustadas pela exposição por 100 pacientes-ano foram 9,4 para pacientes tratados com Skyrizi® (risanquizumabe) e 10,9 para aqueles tratados com ustequinumabe.
Os pacientes que concluíram alguns estudos clínicos de Fase 3 para psoríase em placas tiveram uma oportunidade de se inscrever no estudo de extensão aberto. Um total de 2.170 pacientes no estudo LIMMITLESS foram tratados com Skyrizi® (risanquizumabe), representando 9.953 pacientes anos de exposição. Desde a primeira exposição ao Skyrizi® (risanquizumabe), 2.139 pacientes com psoríase foram expostos ao Skyrizi® (risanquizumabe), por pelo menos um ano e 892 pacientes por mais de 05 anos.
Para os pacientes expostos há mais de 5 anos com Skyrizi® (risanquizumabe), não foram identificadas novas reações adversas em comparação com as primeiras 16 semanas de tratamento.
Artrite psoriásica
No geral, o perfil de segurança observado em pacientes com artrite psoriásica tratados com Skyrizi® (risanquizumabe) foi consistente com o perfil de segurança observado em pacientes com psoríase em placas. O perfil de segurança de Skyrizi® (risanquizumabe) com até 52 semanas de exposição foi consistente com o perfil observado até 24 semanas.
Doença de Crohn
O perfil de reação adversa medicamentosa observado em pacientes com doença de Crohn tratados com Skyrizi® (risanquizumabe) foi consistente com o perfil de reação adversa medicamentosa observado em pacientes com psoríase em placa. Não foram identificadas novas reações adversas nos estudos de doença de Crohn com Skyrizi® (risanquizumabe).
A maioria das infecções não foram graves, tiveram gravidade de leve a moderada e não levaram à descontinuação do Skyrizi® (risanquizumabe).
A taxa de infecções nos dados agrupados dos estudos de indução de 12 semanas foi de 83,3 eventos por 100 participantes-anos em pacientes tratados com Skyrizi® (risanquizumabe) 600 mg IV, em comparação com 117,7 eventos por 100 participantes-anos em placebo. A taxa de infecções graves foi de 3,4 eventos por 100 participantes-anos em pacientes tratados com Skyrizi® (risanquizumabe) 600 mg IV, em comparação com 16,7 eventos por 100 participantes-anos no placebo.
A taxa de infecções no estudo de manutenção de 52 semanas foi de 57,7 eventos por 100 participantes-anos em participantes tratados com Skyrizi® (risanquizumabe) 360 mg SC depois da indução de Skyrizi® (risanquizumabe), em comparação com 76,0 eventos por 100 participantes-anos em participantes que receberam placebo depois da indução de Skyrizi® (risanquizumabe). A taxa de infecções graves foi de 6,0 eventos por 100 participantes-anos em participantes tratados com Skyrizi® (risanquizumabe) 360 mg SC, depois da indução de Skyrizi® (risanquizumabe), em comparação com 5,0 eventos por 100 participantes-anos em pacientes que receberam placebo depois da indução de Skyrizi® (risanquizumabe).
Colite ou retocolite ulcerativa
O perfil de reações adversas ao medicamento observado em pacientes com colite ou retocolite ulcerativa tratados com Skyrizi® (risanquizumabe) foi consistente com o perfil de reações adversas ao medicamento observado em pacientes tratados para as demais indicações. Não foram identificadas novas reações adversas medicamentosas nos estudos de Skyrizi® (risanquizumabe) para o tratamento da colite ou retocolite ulcerativa.
A maioria das infecções não foram graves, tiveram gravidade de leve a moderada e não levaram à descontinuação do Skyrizi® (risanquizumabe).
A taxa de infecções nos dados agrupados do estudo de indução de 12 semanas foi de 77,5 eventos por 100 pacientes-ano em pacientes tratados com Skyrizi® (risanquizumabe) 1200 mg IV em comparação com 75,4 eventos por 100 pacientes-ano no placebo. A taxa de infecções graves foi de 2,9 eventos por 100 pacientes-ano em pacientes tratados com Skyrizi® (risanquizumabe) 1200 mg IV, em comparação com 5,1 eventos por 100 pacientes-ano no grupo placebo.
A taxa de infecções no estudo de manutenção de 52 semanas foi de 67,4 eventos por 100 pacientes-ano em pacientes tratados com Skyrizi® (risanquizumabe) 180 mg SC após indução de Skyrizi® (risanquizumabe) em comparação com 64,6 eventos por 100 pacientes-ano em pacientes que receberam placebo após a indução de Skyrizi® (risanquizumabe). A taxa de infecções graves foi de 1,1 eventos por 100 pacientes-ano em pacientes tratados com Skyrizi® (risanquizumabe) 180 mg SC após a indução de Skyrizi® (risanquizumabe) em comparação com 2,3 eventos por 100 pacientes-ano em pacientes que receberam placebo após a indução de Skyrizi® (risanquizumabe).
Experiência após comercialização
As seguintes reações adversas foram identificadas durante o uso após aprovação de Skyrizi® (risanquizumabe). Como essas reações foram relatadas voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento.
Converse com seu médico ou cirurgião-dentista imediatamente se apresentar algum dos seguintes sintomas.
- Distúrbios da pele e do tecido subcutâneo: eczema, erupção cutânea e urticária (vermelhidão, erupção e placas avermelhadas associadas a coceira).
- Distúrbios do sistema imunológico: reação anafilática (como: dificuldade em respirar ou engolir, inchaço da face, lábios, língua ou garganta, pressão arterial baixa, podendo causar tontura ou vertigem).
Imunogenicidade
Como com todas as proteínas terapêuticas, existe o potencial para imunogenicidade com Skyrizi® (risanquizumabe). A detecção da formação de anticorpos é altamente dependente da sensibilidade e especificidade do ensaio. Além disso, a incidência observada de anticorpos positivos (incluindo anticorpos neutralizantes) em um ensaio, pode ser influenciada por vários fatores, incluindo metodologia do ensaio, manipulação da amostra, momento de coleta da amostra, medicações concomitantes e doença de base. Por esses motivos, a comparação da incidência de anticorpos ao risanquizumabe com a incidência de anticorpos para outros produtos pode ser equivocada.
Psoríase em Placas
Para pacientes tratados com Skyrizi® (risanquizumabe) na dose clínica recomendada por até 52 semanas nos estudos clínicos de psoríase, foram detectados anticorpos antimedicamento e anticorpos neutralizantes em 24% (263/1079) e 14% (150/1079) dos pacientes avaliados, respectivamente. Para pacientes expostos ao tratamento de longo prazo com Skyrizi® (risanquizumabe) no estudo de extensão, o perfil de imunogenicidade observado até 204 semanas de tratamento foi consistente em comparação com as primeiras 52 semanas de tratamento.
Para a maioria dos pacientes, os anticorpos para o risanquizumabe, incluindo os anticorpos neutralizantes, não foram associados a alterações na resposta clínica ou segurança. Entre os poucos pacientes (aproximadamente 1%; 7 / 1.000 na semana 16 e 6/598 na semana 52) com altos títulos de anticorpos (> 128), a resposta clínica pareceu estar reduzida. A incidência de reações no local da injeção é numericamente mais alta nos pacientes com anticorpos antifármacos positivos comparados com os pacientes negativos para estes anticorpos no curto prazo (16 semanas: 2,7% versus 1,3%) e no tratamento a longo prazo (> 52 semanas: 5,0% vs 3,3%). As reações no local da injeção foram, em sua maioria, leves e moderadas em gravidade, e nenhuma levou à interrupção do Skyrizi® (risanquizumabe).
Artrite psoriásica
Para pacientes tratados com Skyrizi® (risanquizumabe) na dose clínica recomendada por até 28 semanas em ensaios clínicos para artrite psoriásica, anticorpos antifármacos e anticorpos neutralizantes emergentes do tratamento foram detectados em 12,1% (79/652) e 0% (0/652) dos pacientes avaliados, respectivamente. Os anticorpos para-risanquizumabe, incluindo anticorpos neutralizantes, não foram associados a alterações na resposta clínica ou segurança.
Doença de Crohn
Para pacientes tratados com Skyrizi® (risanquizumabe) nas doses recomendadas de indução IV e de manutenção SC por até 64 semanas em estudos clínicos com DC, anticorpos antifármacos que surgem do tratamento e anticorpos neutralizantes foram detectados em 3,4% (2/58) e 0% (0/58) dos pacientes avaliados, respectivamente.
Colite ou retocolite ulcerativa
Para pacientes tratados com Skyrizi® (risanquizumabe) nas doses recomendadas para indução intravenosa e manutenção via subcutânea (180 mg) por até 64 semanas em ensaios clínicos de colite ou retocolite ulcerativa, anticorpos antidrogas emergentes do tratamento e anticorpos neutralizantes foram detectados em 8,9% (8/ 90) e 6,7% (6/90) para a dose SC de 180 mg dos pacientes avaliados.
Dentre todas as indicações, anticorpos contra risanquizumabe, incluindo anticorpos neutralizantes, não foram associados a alterações na resposta clínica ou na segurança.
Atenção: este produto é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, informe seu médico ou cirurgião dentista.
População Especial do Skyrizi
Uso na gestação
Se você está grávida, pensa em ficar grávida ou está planejando ter um bebê, consulte o seu médico antes de utilizar este medicamento, uma vez que não se sabe como o medicamento afetará o bebê.
Os dados disponíveis com o uso de Skyrizi® (risanquizumabe) em gestantes são insuficientes para informar quaisquer riscos associados ao medicamento.
Um estudo avançado de toxicidade no desenvolvimento pré e pós-natal foi realizado em macacos cynomolgus. Macacas cynomolgus grávidas receberam semanalmente doses subcutâneas de risanquizumabe de 5 e 50 mg/kg a partir do dia 20 de gestação até ao parto e os macacos cynomolgus (mãe e filhotes) foram acompanhados durante 6 meses (180 dias) após o parto. Estas doses produziram exposições até aproximadamente 70 vezes a exposição clínica na dose máxima recomendada em seres humanos (MRHD) para psoríase e artrite psoriásica (150 mg SC). Para a doença de Crohn, essas doses produziram exposições 10 vezes as exposições clínicas durante a indução com uma dose de 600 mg IV a cada 4 semanas e 39 vezes as exposições clínicas para manutenção, quando administradas 360 mg SC a cada 8 semanas. Para a colite ou retocolite ulcerativa, estas doses produziram exposições 5 vezes superiores às exposições clínicas durante a indução com uma dose de 1200 mg via IV a cada 4 semanas e 65 às exposições clínicas na manutenção, quando administradas doses de 180 mg via SC, a cada 8 semanas. Não foram observadas mortes nos fetos/filhotes e/ou malformações relacionadas ao medicamento. Não houve efeitos sobre o crescimento e desenvolvimento dos filhotes, incluindo avaliação de parâmetros externos, viscerais, esqueléticos e neurocomportamentais e parâmetros de imunotoxicologia do desenvolvimento. Nos filhotes, as concentrações médias no sangue aumentaram de acordo com a dose e foram aproximadamente 2090% das respectivas concentrações no sangue da mãe. Após o parto, a maioria das macacas cynomolgus adultas e todos os filhotes dos grupos tratados com risanquizumabe apresentaram concentrações no sangue mensuráveis de risanquizumabe até 91 dias após o parto. As concentrações no sangue estavam abaixo dos níveis passíveis de serem dosados em 180 dias após o parto.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Mulheres em idade fértil
As mulheres com potencial para engravidar devem utilizar um método contraceptivo eficaz durante o tratamento e pelo menos 21 semanas após a última dose do tratamento.
Uso na lactação
Se você está amamentando ou planeja amamentar, converse com o seu médico antes de usar este medicamento. Não existem dados disponíveis sobre a presença de risanquizumabe no leite humano, sobre os efeitos no bebê amamentado ou sobre os efeitos na produção de leite. Embora a Imunoglobulina G humana seja secretada no leite humano, os dados publicados sugerem que os anticorpos no leite materno não entram na circulação do recém-nascido e crianças em quantidades substanciais.
Uso em idosos
Dos 2234 pacientes com psoríase em placas, expostos ao Skyrizi® (risanquizumabe) em estudos clínicos, 243 tinham 65 anos ou mais e 24 pacientes tinham 75 anos ou mais. Dos 1574 pacientes com doença de Crohn expostos ao Skyrizi® (risanquizumabe), 72 tinham 65 anos ou mais. Dos 1512 pacientes com colite ou retocolite ulcerativa expostos ao Skyrizi® (risanquizumabe) nos estudos clínicos, 103 tinham 65 anos ou mais. Portanto, há informações limitadas em pacientes ≥ 65 anos de idade. No geral não foram observadas diferenças na exposição de risanquizumabe entre pacientes idosos e mais jovens que receberam Skyrizi® (risanquizumabe).
Interação medicamentosa: quais os efeitos de tomar Skyrizi com outros remédios?
Não se espera que Skyrizi® (risanquizumabe) seja metabolizado por enzimas do fígado ou sofra eliminação pelos rins. Não são esperadas interações medicamentosas entre Skyrizi® (risanquizumabe) e inibidores, indutores ou substratos de enzimas que metabolizam medicamentos e ajustes de dose não são necessários.
Com base nos resultados de estudos de interações medicamentosas em pacientes com psoríase em placas, doença de Crohn e colite ou retocolite ulcerativa e na análise farmacocinética populacional em psoríase em placas, artrite psoriásica, doença de Crohn e colite ou retocolite ulcerativa, Skyrizi® (risanquizumabe) não causaria ou seria impactado por interações medicamentosas. Não é necessário ajuste de dose quando se administra concomitantemente risanquizumabe e substratos do citocromo P450.
Terapia imunossupressora concomitante
A segurança e eficácia de Skyrizi® (risanquizumabe) em combinação com medicamentos imunossupressores, incluindo produtos biológicos, ou com fototerapia, não foram avaliadas.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
Apresentações do Skyrizi
Apresentações para via subcutânea
Skyrizi® (risanquizumabe) solução injetável de 75 mg/0,83mL
- 75 mg em seringa com 0,83 mL de dose única pronta para uso: embalagem com 2 seringas prontas para uso com 0,83 mL de solução injetável e 2 envelopes com lenço umedecido em álcool.
Via subcutânea.
Uso adulto.
Skyrizi® (risanquizumabe) solução injetável de 150 mg/mL
- 150 mg em caneta preenchida pronta para uso com 1 mL de dose única: embalagem com 1 caneta pronta para uso com 1 mL de solução injetável.
- 180 mg em carpule com 1,2 mL: embalagem com 1 carpule e 1 dispositivo autoinjetor.
- 360 mg em carpule com 2,4 mL: embalagem com 1 carpule e 1 dispositivo autoinjetor.
Via subcutânea.
Uso adulto.
Apresentações para via intravenosa
Skyrizi® (risanquizumabe) solução injetável de 60 mg/mL
- 600 mg em frasco com 10,0 mL: embalagem com 1 frasco de dose única.
Via intravenosa.
Uso adulto.
Qual a ação da substância do Skyrizi?
Resultados de Eficácia
A eficácia e segurança de Risanquizumabe foram avaliadas em 2.109 indivíduos com psoríase em placas moderada a grave em quatro estudos multicêntricos, randomizados, duplo-cegos (ULTIMMA-1, ULTIMMA-2, IMMHANCE e IMMVENT).
Os indivíduos admitidos tinham 18 anos de idade ou mais e apresentavam psoríase em placas com envolvimento da área de superfície corpórea (BSA) ≥ 10%, versão estática da Avaliação Global pelo Médico (sPGA) ≥3 na avaliação geral (espessura/endurecimento da placa, eritema e escamação) da psoríase em uma escala de gravidade de 0 a 4, e Indice de gravidade da psoríase por área (PASI) ≥ 12.
Em geral, os indivíduos apresentaram uma pontuação PASI basal mediana de 17,8 e BSA mediana de 20%. A pontuação sPGA basal foi grave em 19,3% dos indivíduos. Um total de 9,8% dos indivíduos do estudo apresentaram histórico de artrite psoriásica diagnosticada.
Em todos os estudos, 30,9% dos indivíduos não haviam sido expostos previamente a terapias biológicas e terapias sistêmicas não biológicas, 38,1% dos indivíduos haviam recebido fototerapia prévia, 48,3% haviam recebido terapia sistêmica não biológica prévia, 42,1% haviam recebido terapia biológica, e 23,7% haviam recebido pelo menos um agente anti-TNF alfa para o tratamento da psoríase.
ULTIMMA-1 e ULTIMMA-2
Os estudos ULTIMMA-1 e ULTIMMA-21 admitiram 997 indivíduos (598 randomizados para Risanquizumabe 150 mg, 199 para ustequinumabe 45 mg ou 90 mg e 200 para placebo). Os indivíduos receberam tratamento na semana 0, semana 4 e, posteriormente a cada 12 semanas, após as doses iniciais na semana 0 e semana 4. Os resultados são apresentados na Tabela 1 e Figura 1.
Tabela 1. Resultados de Eficácia em Adultos com Psoríase em Placas nos estudos ULTIMMA-1 e ULTIMMA-2
| - |
ULTIMMA-1 |
ULTIMMA-2 |
||||
| - | Risanquizumabe (N=304) n (%) | Ustequinumabe (N=100) n (%) | Placebo (N=102) n (%) | Risanquizumabe (N=294) n (%) | Ustequinumabe (N=99) n (%) |
Placebo (N=98) n (%) |
|
sPGA pele sem lesões ou quase sem lesões (0 ou 1) |
||||||
|
Semana 12 |
250 (82,2) | 65 (65,0) | 9 (8,8) | 242 (82,3) | 64 (64,6) |
9 (9,2) |
|
Semana 16 |
267 (87,8)a | 63 (63,0) | 8 (7,8) | 246 (83,7)a | 61 (61,6) |
5 (5,1) |
|
Semana 52 |
262 (86,2) | 54 (54,0) | - | 245 (83,3) | 54 (54,5) | - |
|
sPGA pele sem lesões (0) |
||||||
|
Semana 16 |
112 (36,8) | 14 (14,0) | 2 (2,0) | 150 (51,0) | 25 (25,3) |
3 (3,1) |
|
Semana 52 |
175 (57,6) | 21 (21,0) | - | 175 (59,5) | 30 (30,3) | - |
|
PASI 75 |
||||||
|
Semana 12 |
264 (86,8) | 70 (70,0) | 10 (9,8) | 261 (88,8) | 69 (69,7) |
8 (8,2) |
|
Semana 52 |
279 (91,8) | 70 (70,0) | - | 269 (91,5) | 76 (76,8) | - |
|
PASI 90 |
||||||
|
Semana 16 |
229 (75,3)a | 42 (42,0) | 5 (4,9) | 220 (74,8)a | 47 (47,5) |
2 (2,0) |
|
Semana 52 |
249 (81,9) | 44 (44,0) | - | 237 (80,6) | 50 (50,5) | - |
|
PASI 100 |
||||||
|
Semana 16 |
109 (35,9) | 12 (12,0) | 0 (0,0) | 149 (50,7) | 24 (24,2) |
2 (2,0) |
|
Semana 52 |
171 (56,3) | 21 (21,0) | - | 175 (59,5) | 30 (30,3) | - |
Todas as comparações de Risanquizumabe versus Ustequinumabe e placebo atingiram p <0,001, exceto para PASI 75 na Semana 52 no estudo ULTIMMA-2, onde p = 0,001.
a Desfechos coprimários versus placebo.
Figura 1. Evolução da alteração percentual média a partir do período basal do PASI nos estudos ULTIMMA-1 e ULTIMMA-2
RZB = risanquizumabe.
UST = ustequinumabe.
p < 0,001 em cada timepoint.
O exame de idade, sexo, raça, peso corporal (≤130 kg), pontuação PASI basal, artrite psoriásica concomitante, tratamento sistêmico não biológico prévio, tratamento biológico prévio e falha no tratamento com biológico prévio não identificou diferenças na resposta ao Risanquizumabe entre esses subgrupos.
Foram observadas melhoras na psoríase envolvendo o couro cabeludo, as unhas e as palmas e plantas na Semana 16 e na Semana 52 em indivíduos tratados com Risanquizumabe.
IMMHANCE
O estudo IMMHANCE2 admitiu 507 indivíduos (407 randomizados para Risanquizumabe 150 mg e 100 para placebo). Os indivíduos receberam tratamento na Semana 0, Semana 4 e a cada 12 semanas. Os indivíduos que estavam originalmente em tratamento com Risanquizumabe e tiveram uma resposta sPGA de pele sem lesões ou quase sem lesões na Semana 28 foram randomizados novamente para continuar com Risanquizumabe a cada 12 semanas ou ter o tratamento descontinuado.
Na Semana 16, Risanquizumabe foi superior ao placebo nos desfechos coprimários de sPGA de pele sem lesões ou quase sem lesões (83,5% Risanquizumabe vs 7,0% placebo) e PASI 90 (73,2% Risanquizumabe vs 2,0% placebo). Mais indivíduos que utilizaram Risanquizumabe apresentaram pele sem lesões [sPGA 0 (46,4% Risanquizumabe vs 1,0% placebo) ou PASI 100 [47,2% Risanquizumabe vs 1,0% placebo] na Semana 16. Os indivíduos que receberam Risanquizumabe também apresentaram maior probabilidade de ter uma resposta PASI 75 quando comparada com placebo (88,7% Risanquizumabe vs 8,0% placebo).
Dos 31 indivíduos do estudo IMMHANCE com tuberculose (TB) latente, que não receberam tratamento da infecção latente durante o estudo, nenhum desenvolveu TB ativa durante o acompanhamento médio de 55 semanas utilizando risanquizumabe.
IMMVENT
O estudo IMMVENT3 admitiu 605 indivíduos (301 randomizados para Risanquizumabe e 304 para adalimumabe). Os indivíduos randomizados para Risanquizumabe receberam 150 mg de tratamento na Semana 0, Semana 4 e a cada 12 semanas após a 2ª dose. Os indivíduos randomizados para adalimumabe receberam 80 mg na Semana 0, 40 mg na Semana 1 e 40 mg a cada duas semanas até a Semana 15.
A partir da Semana 16, os indivíduos que receberam adalimumabe continuaram ou trocaram de tratamento com base na resposta:
- < PASI 50 foram trocados para Risanquizumabe;
- PASI 50 a < PASI 90 foram randomizados novamente para continuar com adalimumabe ou trocar para Risanquizumabe;
- PASI 90 continuaram a receber adalimumabe.
Resultados semelhantes para Risanquizumabe na Semana 16 foram vistos tanto no estudo IMMVENT quando comparados aos demais estudos clínicos (Tabela 2 e Figura 2).
Tabela 2. Resultados de eficácia na Semana 16 em adultos com psoríase em placas no estudo IMMVENT
| - | Risanquizumabe (N=301) n (%) |
Adalimumabe (N=304) n (%) |
|
sPGA de pele sem lesões ou quase sem lesõesa |
252 (83,7) |
183 (60,2) |
|
PASI 75 |
273 (90,7) |
218 (71,7) |
|
PASI 90a |
218 (72,4) |
144 (47,4) |
|
PASI 100 |
120 (39,9) |
70 (23,0) |
Todas as comparações atingiram.
a < 0,001 a Desfechos coprimários.
Para indivíduos que tiveram PASI 50 a < PASI 90 com adalimumabe na Semana 16 e foram randomizados novamente, as diferenças nas taxas de resposta PASI 90 entre a troca para Risanquizumabe e a continuação de adalimumabe foram observadas logo após 4 semanas da rerandomização (49,1% vs 26,8 %, respectivamente). Sessenta e seis porcento (35/53) dos indivíduos atingiram PASI 90 após 28 semanas de Risanquizumabe, em comparação com 21,4% (12/56) que continuaram a receber adalimumabe. Outros níveis de resposta também foram maiores após nova randomização para Risanquizumabe: 39,6% PASI 100, 39,6% sPGA sem lesões e 73,6% sPGA sem lesões ou quase sem lesões tiveram resposta após a troca para Risanquizumabe, em comparação com 7,1% PASI 100, 7,1% sPGA sem lesões e 33,9% sPGA sem lesões ou quase sem lesões que continuaram recebendo adalimumabe.
Figura 2. Evolução da PASI 90 após nova randomização no estudo IMMVENT
ADA/ADA: Indivíduos randomizados para adalimumabe e que continuaram com adalimumabe.
ADA/RZB: Indivíduos randomizados para adalimumabe e que trocaram para Risanquizumabe.
p<0,05 na Semana 4 e p < 0,001 em cada time point, a partir da Semana 8.
Nos 270 pacientes que mudaram de adalimumabe para Risanquizumabe sem um período de washout, o perfil de segurança foi semelhante àquele dos pacientes que iniciaram Risanquizumabe após o washout de quaisquer terapias sistêmicas anteriores.
Manutenção e Duração da Resposta
Em uma análise integrada de indivíduos respondedores PASI 100 que receberam Risanquizumabe nos estudos ULTIMMA-1 e ULTIMMA-2 na Semana 16, destes, 79,8% (206/258) dos indivíduos que continuaram com Risanquizumabe mantiveram a resposta na Semana 52. Dentre os respondedores PASI 90 na Semana 16, 88,4% (398/450) dos indivíduos mantiveram a resposta na Semana 52.
Entre os indivíduos com resposta sPGA de pele sem lesões ou quase sem lesões na Semana 28 no estudo IMMHANCE, 87,4% (97/111) dos indivíduos rerandomizados para continuar o tratamento com Risanquizumabe mantiveram essa resposta na Semana 52 em comparação com 61,3% (138/225) dos que foram re-randomizados para retirada de Risanquizumabe.
Qualidade de Vida / Resultados Relatados pelo Paciente
Significativamente mais indivíduos tratados com Risanquizumabe obtiveram pontuação 0 ou 1 [sem impacto na qualidade de vida relacionada à saúde] no Índice de Qualidade de Vida em Dermatologia (DLQI) na Semana 16 em comparação ao placebo, ao adalimumabe ou ustequinumabe (Tabela 3). A melhora na qualidade de vida relacionada à saúde se manteve até a Semana 52 (estudos ULTIMMA-1 e ULTIMMA-2).
Tabela 3. Qualidade de vida relacionada à saúde nos estudos ULTIMMA-1, ULTIMMA-2 e IMMVENT
| - |
ULTIMMA-1 |
ULTIMMA-2 |
IMMVENT |
|||||
| - |
Risanquizumabe |
Ustequinumabe | Placebo | Risanquizumabe | Ustequinumabe | Placebo | SKYRIZI ® (risanquiz umabe) |
Adalimumabe |
| - | (N=304) n (%) | (N=100) n (%) | (N=102) n (%) | (N=294) n (%) | (N=99) n (%) | (N=98) n (%) | (N=301) n (%) |
(N=304) n (%) |
|
DLQI 0 ou 1 |
||||||||
|
Semana 16 |
200 (65,8) | 43 (43,0) | 8 (7,8) | 196 (66,7) | 46 (46,5) | 4 (4,1) | 198 (65,8) |
148 (48,7) |
|
Semana 52 |
229 (75,3) | 47 (47,0) | - | 208 (70,7) | 44 (44,4) | - | - | - |
Todas as comparações de Risanquizumabe versus ustequinumabe, adalimumabe e placebo atingiram p < 0,001.
Nos estudos ULTIMMA-1 e ULTIMMA-2 foram demonstradas melhoras significativamente maiores nos sintomas de psoríase (coceira, dor, vermelhidão e queimação, conforme medido pela Pontuação de Sintomas de Psoríase [PSS]) com Risanquizumabe comparado ao placebo na Semana 16. Uma proporção significativamente maior de indivíduos utilizando Risanquizumabe atingiram índice PSS 0 (sem sintomas) na Semana 16 em comparação com ustequinumabe e com placebo. Na Semana 52, 55,7% (333/598) dos indivíduos utilizando Risanquizumabe relataram ausência de coceira, dor, vermelhidão ou queimação.
Ansiedade e depressão, medidas pela Escala Hospitalar de Ansiedade e Depressão (HADS), melhoraram no grupo com Risanquizumabe na Semana 16 em comparação com aqueles que receberam placebo nos estudos ULTIMMA-1 e ULTIMMA-2.
Uma melhora maior no Questionário de Limitações no Trabalho (WLQ) na Semana 16 foi alcançada em indivíduos que receberam Risanquizumabe em comparação com aqueles que receberam adalimumabe no estudo IMMVENT.
Dados de Segurança Pré-Clínica
Os dados não clínicos não revelaram riscos especiais para seres humanos, com base em estudos de toxicidade de doses repetidas, incluindo avaliações farmacológicas da segurança, em estudo de toxicidade reprodutora e no desenvolvimento em macacos cynomolgus com doses de até 50 mg/kg/semana (produzindo exposições de cerca de 70 vezes a exposição clínica na dose humana máxima recomendada [MRHD]).
Carcinogenicidade
Estudos de carcinogenicidade não foram realizados com Risanquizumabe. Em um estudo de toxicologia crônica de 26 semanas em macacos cynomolgus com doses de até 50 mg/kg/semana (cerca de 70 vezes a exposição clínica na MRHD), não foram observadas lesões préneoplásicas ou neoplásicas.
Mutagenicidade
Não foram realizados estudos de mutagenicidade com Risanquizumabe.
Comprometimento da fertilidade
Estudos em macacos cynomolgus com doses de até 50 mg/kg/semana (cerca de 70 vezes a exposição clínica na MRHD) com Risanquizumabe não indicaram efeitos nocivos diretos ou indiretos na fertilidade masculina ou feminina. No estudo de toxicologia de doses repetidas de 26 semanas, a histopatologia dos órgãos reprodutores de macacos cynomolgus machos e fêmeas não revelou qualquer resultado adverso relevante. Em um estudo de doses repetidas de 26 semanas em macacos cynomolgus machos sexualmente maduros, não foram observados efeitos nos parâmetros de fertilidade masculina.
Farmacologia e/ou toxicologia animal
Em um estudo de toxicologia de 26 semanas com doses subcutâneas semanais de até 50 mg/kg, não foram observados efeitos adversos em macacos cynomolgus machos e fêmeas com exposições cerca de 70 vezes superiores à exposição clínica na MRHD.
Referências Bibliográficas
1. Gordon KB, Strober B, Lebwohl M et al. Efficacy and safety of risankizumab in moderate-to-severe plaque psoriasis (UltIMMa-1 and UltIMMa-2): results from two double-blind, randomised, placebo-controlled and ustekinumab-controlled phase 3 trials. Lancet. 2018 Aug 7. pii: S0140-6736(18)31713-6. doi: 10.1016/S0140-6736(18)31713-6.
2. Blauvelt A, Papp KA, Gooderham M et al. RISANKIZUMAB EFFICACY/SAFETY IN MODERATETO-SEVERE PLAQUE PSORIASIS: 16-WEEK RESULTS FROM IMMHANCE.Acta Dermato-Venereaologica. Volume 98 2018 Supplement N0 216 (P066). Presented at 5th World Psoriasis & Psoriatic Arthritis Conference 2018 June 27– 30, 2018 Stockholm, Sweden.
3. Reich K, Gooderham M, Thaci D et al. Efficacy and Safety of Risankizumab Compared with Adalimumab in Patients with Moderate-to-Severe Plaque Psoriasis: Results from the Phase 3 IMMvent Trial. Poster presented at 27th European Academy of Dermatology and Venerology Congress; September 12-16, 2018; Paris, France. Poster P1813.
Características Farmacológicas
O risanquizumabe é um anticorpo monoclonal humanizado (imunoglobulina G1 [IgG1]) bloqueador da interleucina-23. Este ativo é produzido em células de ovário de hamster chinês (CHO), utilizando a tecnologia de DNA recombinante.
Grupo farmacoterapêutico: Imunossupressores, inibidores da interleucina, código ATC L04AC16.
Mecanismo de ação
O risanquizumabe é um anticorpo monoclonal humanizado IgG1 que se liga seletivamente com alta afinidade à subunidade p19 da citocina humana interleucina 23 (IL-23) e inibe sua interação com o complexo do receptor da IL-23. A IL-23 é uma citocina habitualmente presente no corpo humano que está envolvida em respostas inflamatórias e imunes. A IL-23 dá suporte ao desenvolvimento, manutenção e ativação de células Th17, que produzem IL-17A, IL-17F e IL-22, bem como outras citocinas pró-inflamatórias, e desempenha um papel fundamental na condução de doenças autoimunes inflamatórias, como a psoríase. A IL-23 é regulada positivamente na pele lesionada em comparação com a pele não lesionada de pacientes com psoríase em placas. Ao bloquear a ligação da IL-23 ao seu receptor, o risanquizumabe inibe a sinalização celular dependente de IL-23 e a liberação de citocinas pró-inflamatórias.
O risanquizumabe não se liga à IL-12 humana, que compartilha a subunidade p40 com a IL-23.
Farmacodinâmica
Em um estudo de indivíduos com psoríase, a expressão de genes associados ao eixo IL-23/IL-17 foi diminuída na pele após doses únicas de risanquizumabe. Reduções na espessura da epiderme, infiltração de células inflamatórias e expressão de marcadores da doença psoriásica também foram observadas nas lesões psoriásicas.
Farmacocinética
Absorção
O risanquizumabe apresentou farmacocinética linear com aumento proporcional à dose na exposição em intervalos de dose de 18 a 300 mg e 0,25 a 1 mg/kg, administrados por via subcutânea e 200 a 1200 mg e 0,01 a 5 mg/kg administrados por via intravenosa.
Após administrações subcutâneas de risanquizumabe, as concentrações plasmáticas máximas foram atingidas entre 3-14 dias após a administração com biodisponibilidade absoluta estimada de 89%.
Com o regime de administração em indivíduos com psoríase (150 mg na Semana 0, Semana 4 e após as duas doses iniciais, a cada 12 semanas), a concentração plasmática no estado de equilíbrio e a concentração plasmática máxima estimada são de 12 e 2 µg/mL, respectivamente.
Distribuição
A média (± desvio padrão) do volume de distribuição no estado de equilíbrio (Vss) foi de 11,4 (±2.7) L, nos estudos de Fase 3 em pacientes com psoríase, indicando que a distribuição de risanquizumabe é limitada, principalmente aos espaços vascular e intersticial.
Metabolismo
Em terapias com anticorpos monoclonais, as IgG são tipicamente degradadas em pequenos peptídeos e aminoácidos por meio de vias catabólicas, do mesmo modo que as IgG endógenas. Não se espera que risanquizumabe seja metabolizado pelas enzimas do citocromo P450.
Excreção
A depuração sistêmica média (± desvio padrão) do risanquizumabe foi de 0,3 (± 0,1) L/dia nos estudos de Fase 3 em pacientes com psoríase. A meia-vida média de eliminação terminal de risanquizumabe variou de 28 a 29 dias nos estudos de Fase 3 em pacientes com psoríase.
Sendo um anticorpo monoclonal IgG1, não se espera que risanquizumabe passe por filtração glomerular nos rins ou seja excretado como uma molécula intacta na urina.
Linearidade / não-linearidade
O risanquizumabe exibiu uma farmacocinética linear com aumentos aproximadamente proporcionais à dose na exposição sistêmica (Cmax e AUC) nos intervalos de dose avaliados de 18 a 300 mg ou 0,25 a 1mg / Kg na administração subcutânea em indivíduos saudáveis e indivíduos com psoríase.
Farmacocinética em populações especiais
Pacientes pediátricos
A farmacocinética de risanquizumabe em pacientes pediátricos não foi estabelecida.
Idosos
Dos 2.234 indivíduos com psoríase em placas expostos ao Risanquizumabe, 243 tinham 65 anos ou mais e 24 indivíduos tinham 75 anos ou mais. No geral, não foram observadas diferenças na exposição, segurança e eficácia de risanquizumabe entre indivíduos idosos e mais jovens que receberam Risanquizumabe.
Insuficiência renal ou hepática
Não foram realizados estudos específicos para determinar o efeito da insuficiência renal ou hepática na farmacocinética de risanquizumabe. Com base na análise de farmacocinética populacional, os níveis séricos de creatinina, clearance de creatinina ou dosagem de enzimas hepáticas (ALT/AST/bilirrubina), não apresentaram impacto significativo no clearance de risanquizumabe em indivíduos com psoríase.
Sendo um anticorpo monoclonal IgG1, o risanquizumabe é eliminado principalmente por meio de catabolismo intracelular e não se espera que sofra metabolismo via enzimas hepáticas do citocromo P450 ou eliminação renal.
Peso corporal
O clearance de risanquizumabe e o volume de distribuição aumentam com o aumento do peso corporal, o que pode resultar em uma eficácia reduzida em indivíduos com peso corporal elevado (> 130 kg). No entanto, esta observação é baseada em um número limitado de indivíduos. Atualmente, não é recomendado ajuste da dose com base no peso corporal.
Sexo ou raça
O clearance de risanquizumabe não foi significativamente influenciado pelo sexo ou raça em indivíduos adultos com psoríase em placas. Não foram observadas diferenças clinicamente significativas na exposição ao risanquizumabe em indivíduos chineses ou japoneses em comparação com indivíduos caucasianos em um estudo clínico de farmacocinética.
Qual a composição do Skyrizi?
Cada seringa de 75 mg/0,83mL contém:
Risanquizumabe | 75 mg |
Excipientes q.s.p. | 0,83 mL |
Excipientes: succinato dissódico hexaidratado, ácido succínico, sorbitol, polissorbato 20 e água para injetáveis.
Cada caneta de 150 mg/mL contém:
Risanquizumabe | 150 mg |
Excipientes q.s.p. | 1 mL |
Excipientes: acetato de sódio tri-hidratado, ácido acético, trealose di-hidratada, polissorbato 20 e água para injetáveis.
Cada carpule de 180 mg/1,2 mL contém:
Risanquizumabe | 180 mg |
Excipientes q.s.p. | 1,2 mL |
Excipientes: trealose di-hidratada, acetato de sódio tri-hidratado, polisorbato 20, ácido acético e água para injetáveis.
Cada carpule de 360 mg/2,4 mL contém:
Risanquizumabe | 360 mg |
Excipientes q.s.p. | 2,4 mL |
Excipientes: trealose di-hidratada, acetato de sódio tri-hidratado, polisorbato 20, ácido acético e água para injetáveis.
Cada frasco de 600 mg/10 mL contém:
Risanquizumabe | 600 mg |
Excipientes q.s.p. | 10 mL |
Excipientes: trealose di-hidratada, acetato de sódio tri-hidratado, polisorbato 20, ácido acético e água para injetáveis.
Como devo armazenar o Skyrizi?
Skyrizi® (risanquizumabe) deve ser mantido em sua embalagem original. Armazenar em geladeira (de 2°C a 8°C). Proteger da luz. Não congelar.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use o medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características físicas e organolépticas
- A solução de Skyrizi® (risanquizumabe) 75 mg/0,83 mL em seringa pronta para uso é incolor a ligeiramente amarela, límpida a ligeiramente opalescente.
- Skyrizi® (risanquizumabe) 150 mg/mL, em caneta preenchida, apresenta solução incolor a amarela, límpida a ligeiramente opalescente.
- A solução de Skyrizi® (risanquizumabe) 150 mg/mL em carpule com 180 mg/1,2 mL ou 360 mg/2,4 mL é incolor a amarela, límpida a ligeiramente opalescente.
- A solução de Skyrizi® (risanquizumabe) 60 mg/mL em frasco de dose única é incolor a ligeiramente amarela, límpida a ligeiramente opalescente.
A solução pode conter pequenas partículas brancas ou translúcidas. Skyrizi® (risanquizumabe) não deve ser usado se a solução estiver turva ou com coloração alterada, ou se contiver flocos ou partículas grandes.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Dizeres Legais do Skyrizi
Registro: 1.9860.0016
Registrado e Importado por:
AbbVie Farmacêutica Ltda.
Av. Guido Caloi, 1935, 1º andar, Bloco C - São Paulo - SP
CNPJ: 15.800.545/0001-50
Skyrizi® (risanquizumabe) 75 mg/0,83 mL (seringa preenchida):
Produzido por:
Boehringer Ingelheim Pharma GmbH & Co. KG
Biberach – Alemanha
Ou
Abbvie Biotechnology Ltd.
Barceloneta – Porto Rico
Skyrizi® (risanquizumabe) 150 mg/mL (caneta preenchida)
Produzido por:
Abbvie Biotechnology Ltd.
Barceloneta - Porto Rico
SKYRIZI® (risanquizumabe) 180 mg/1,2 mL, 360 mg/2,4 mL e 600 mg/10 mL
Produzido por:
Patheon Italia S.P.A.
Monza - Itália
Venda sob prescrição.
Doenças relacionadas
Quer saber mais?
Consulta também aBula do Risanquizumabe
O conteúdo desta bula foi extraído manualmente da bula original, sob supervisão técnica do(a) farmacêutica responsável: Karime Halmenschlager Sleiman (CRF- PR 39421). Última atualização: 18 de Março de 2025.