Winrevair 45mg, caixa com 2 frascos-ampola com pó para solução de uso subcutâneo
- DoseQuantidade de princípio ativo por unidade, como 50mg por comprimido.
- Quantidade na embalagemNúmero de unidades do produto por embalagem.
- Sotatercepte
Branca Comum (Venda Sob Prescrição Médica)
De 2 a 8°C
Não pode ser partido
Bula do Winrevair
Winrevair, para o que é indicado e para o que serve?
WinrevairTM é um medicamento sob prescrição para tratar adultos com hipertensão arterial pulmonar (HAP). A HAP é um tipo de pressão arterial elevada nas artérias dos pulmões.
WinrevairTM pode melhorar a sua capacidade de ser fisicamente ativo, reduzindo a pressão arterial em seus pulmões. Também pode aliviar os sintomas da HAP e retardar a progressão da sua doença.
Como o Winrevair funciona?
WinrevairTM é uma proteína de fusão do receptor de activina tipo IIA-Fc (ActRIIA-Fc) que atua reduzindo a pressão arterial nos pulmões.
Quais as contraindicações do Winrevair?
Não tome WinrevairTM se você é alérgico ao sotatercepte ou a qualquer outro componente deste medicamento.
Como usar o Winrevair?
- Se o seu médico decidir que você ou um cuidador pode aplicar as injeções de WinrevairTM em casa, você ou seu cuidador deve receber treinamento de um profissional de saúde apropriado sobre a maneira correta de preparar e injetar WinrevairTM. Não tente injetar WinrevairTM até que um profissional de saúde lhe mostre a maneira correta.
- O seu médico fará um exame de sangue antes das primeiras 5 doses de WinrevairTM, por mais tempo se necessário, e depois, de tempos em tempos, para verificar seus níveis de hemoglobina (uma proteína nos glóbulos vermelhos que transporta oxigênio) e plaquetas (células sanguíneas que ajudam o sangue a coagular). Após cada um desses exames de sangue, seu médico pode adiar o tratamento ou alterar sua dose, se necessário.
- Leia o item "Instruções de Uso".
- Use WinrevairTM exatamente como indicado pelo seu médico.
- Você deverá usar WinrevairTM a cada 3 semanas como uma injeção logo abaixo da pele (subcutânea) apenas nestes locais de injeção:
- Abdômen, com pelo menos 5 centímetros de distância do umbigo;
- Parte superior da coxa;
- Você deve aplicar a injeção de WinrevairTM imediatamente após misturar o medicamento em pó com a água para injetáveis, mas no máximo até 4 horas após a mistura.
Instruções de uso - kit com 1 frasco-ampola
Conhecendo os itens do seu kit

Informações importantes para saber antes da injeção
- Você deve misturar este medicamento antes de utilizá-lo. Certifique-se de que o pó do medicamento no frasco esteja completamente dissolvido quando você injetar.
- Verifique a dose prescrita (quantidade em “mL”) a cada vez que você usar o medicamento. A sua dose prescrita pode mudar.
- Use somente os itens que acompanham o kit para preparar a dose prescrita.
- Não abra a embalagem, nem misture o medicamento até estar pronto para utilizá-lo.
- Não reutilize nenhum dos itens. Após aplicar a injeção, descarte o frasco usado com qualquer medicamento restante de WinrevairTM, agulha e seringas em um recipiente para objetos perfurocortantes.
Armazenando seu kit
- Guarde todo o kit de injeção na geladeira (2°C a 8°C), mas não congele.
- Mantenha o medicamento e os itens no kit de injeção e proteja-o da luz.
- Mantenha o kit de injeção fora do alcance de crianças e animais de estimação.
Início
Qualquer paciente ou cuidador que preparar e injetar WinrevairTM deve primeiro ser treinado e considerado capaz por um profissional de saúde para administrar sozinho WinrevairTM.
1. Verificando o produto WinrevairTM e o prazo de validade
- Retire o kit de injeção WinrevairTM da geladeira.
- Verifique o prazo de validade e se a caixa ou os itens do kit apresentam algum dano.
- Se vencido ou danificado, não use. Fale imediatamente com o seu médico ou farmacêutico.
- Verifique se este é o medicamento prescrito pelo seu médico.
2. Aguardando seu kit atingir a temperatura ambiente, reunindo os itens e lavando suas mãos
- Aguarde 15 minutos para permitir que o kit atinja a temperatura ambiente. Medicamento frio é mais dolorido ao injetar.
- Junto com o seu kit, reúna esses itens e procure uma superfície limpa e plana para preparar e injetar a sua dose.
- Lave suas mãos com água e sabão.
Misturando o medicamento em pó na forma líquida
- Comece com a Bandeja Superior.
3. Removendo o frasco, a seringa preenchida e o adaptador do frasco do kit

4a. Verificando o frasco do medicamento
- Não está danificado?
- Sem partículas visíveis?
- Está dentro da validade?
- Verifique o rótulo do frasco para confirmar que o medicamento não está vencido.
- Inspecione o pó do medicamento. Deve ser branco a esbranquiçado e pode parecer um pó compactado inteiro ou fragmentado.
- Não use se estiver vencido, danificado ou se você puder ver partículas nele.
4b. Removendo a tampa plástica e limpando o frasco
- Retire a tampa de plástico e limpe a tampa de borracha na parte superior do frasco com um lenço umedecido com álcool.
- Não use se a tampa do frasco estiver faltando.
- Não toque na tampa de borracha limpa.
- Coloque o frasco em uma superfície limpa e plana.
5a. Encaixando o adaptador ao frasco
- Abra a embalagem do adaptador do frasco e remova-o da embalagem.
- Segure a parte azul do adaptador e encaixe o adaptador do frasco com a parte superior do frasco.
- Não toque no interior do adaptador do frasco.
- Para conectar o adaptador do frasco:
- Não toque no interior do adaptador do frasco.
5b. Conectando o adaptador ao frasco
- Segure o frasco com uma mão. Empurre para baixo com firmeza para que se encaixe no lugar (você pode sentir um pouco de resistência).
5c. Limpando o adaptador do frasco
- Limpe a parte superior do adaptador do frasco com um lenço umedecido com álcool.
6. Verificando a seringa preenchida
- Confirme se a água para injetáveis dentro da seringa preenchida está límpida e se o produto não está vencido.
- Não danificada?
- Límpida?
- Sem partículas?
- Está dentro da validade?
- Não use se você observar grumos, partículas, alteração da coloração ou se o produto estiver vencido.
7. Retirando a tampa branca da seringa preenchida
- Retire a tampa da seringa preenchida ao longo da perfuração.
- Não toque na ponta da seringa preenchida.
- Não empurre o êmbolo; pode derramar a água.
8. Conectando a seringa preenchida ao adaptador do frasco
- Agora, pegue o frasco do medicamento com o adaptador do frasco acoplado.
- Alinhe a ponta da seringa preenchida com o círculo azul do adaptador do frasco.
- Empurre e gire a seringa preenchida no adaptador do frasco até não conseguir girar mais. Ao rosquear, certifique-se de segurar o adaptador do frasco.
- Empurre e gire até conectar.
- Não empurre o êmbolo; pode derramar a água.
9. Transferindo a água para injetáveis da seringa preenchida para o frasco
- Empurre lentamente o êmbolo totalmente para baixo para transferir toda a água para injetáveis dentro do frasco (o êmbolo se moverá para cima; isso é normal).
10. Mexendo para misturar o medicamento
- Não agite o frasco.
- Segure a seringa preenchida e mexa suavemente o frasco em movimentos circulares até que o pó esteja completamente dissolvido. Isso pode levar até 2 minutos.
- Quando o medicamento estiver bem misturado, deve ficar límpido. Caso contrário, repita esta etapa até que fique límpido.
- Pressione o êmbolo para baixo para garantir que todo o líquido esteja no frasco (o êmbolo se moverá para cima; isso é normal).
11. Aguardando as bolhas desaparecerem
- Deixe o frasco repousar para que as bolhas desapareçam. Isso pode levar até 3 minutos.
- Antes de continuar, certifique-se de que o medicamento no frasco:
- Está límpido a ligeiramente perolado e transparente a ligeiramente amarelo acastanhado.
- Não tenha grumos ou pó.
- Não tenha bolhas grandes.
- Não há problema em ter uma leve espuma nas bordas do frasco.
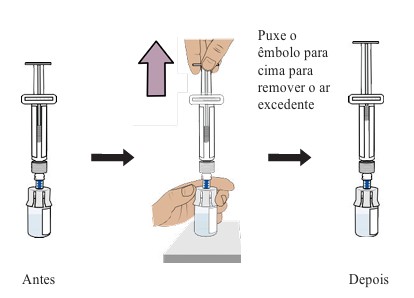
12. Preparando o frasco removendo o ar excedente
- Enquanto o frasco estiver na posição vertical, puxe suavemente o êmbolo para cima até o topo do corpo, mas tenha cuidado para não puxar o êmbolo para fora da seringa.
- Dica: Esta etapa apenas retira o ar excedente do frasco para garantir que você tenha a dose certa.
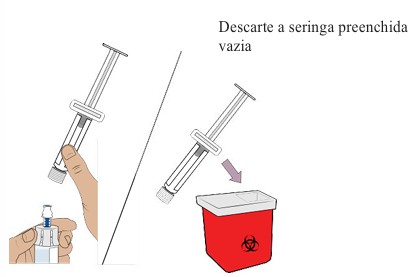
13. Removendo a seringa preenchida do frasco
- Segure o adaptador do frasco e desrosqueie a seringa do frasco.
- Descarte a seringa no recipiente para objetos perfurocortantes.
- Você deve ter um frasco de medicamento preparado e pronto para ser usado nas próximas etapas.
Retirando a dose prescrita
- Para as próximas etapas, você precisará de:
- Frasco misturado de medicamento.
- Itens da Bandeja Inferior.
14. Limpando a parte superior do adaptador do frasco
- Com um novo lenço umedecido com álcool da bandeja inferior, limpe a parte superior do adaptador do frasco.
15. Removendo a seringa dosadora vazia da embalagem
- Localize a seringa dosadora vazia na bandeja inferior e retire-a da embalagem.
- Você usará esta seringa dosadora para medir o medicamento de que precisa (com base na dose prescrita).
16. Puxando o ar para a seringa dosadora
- Você deve fazer isso para garantir que a pressão no frasco seja uniforme e obter uma dose precisa.
- Segure a seringa dosadora na vertical e puxe o êmbolo para baixo para retirar o ar para dentro da seringa dosadora. Pare quando chegar à quantidade em “mL” descrita na sua prescrição.
17. Conectando a seringa dosadora ao frasco
- Enquanto segura o adaptador do frasco, rosqueie a seringa dosadora até parar.
18. Empurrando o ar para dentro do frasco e virando de cabeça para baixo
- Empurre o êmbolo totalmente para baixo para transferir todo o ar para o frasco.
- Em seguida, segure o êmbolo no lugar com o dedo polegar e vire o frasco de cabeça para baixo.
19. Puxando o êmbolo de volta para retirar a sua dose
- Com o frasco e a seringa dosadora virados para baixo, puxe lentamente o êmbolo de volta.
- Pare quando chegar à quantidade em “mL” definida na sua prescrição.
20. Verificando se há bolhas de ar e bolsas de ar
- Verifique se existem grandes bolhas de ar ou bolsas de ar na seringa. Você removerá o ar excedente nas próximas etapas.
21. Removendo bolhas de ar e bolsas de ar
- Se você observar bolhas de ar ou uma bolsa de ar, bata na lateral da seringa dosadora para mover o ar para o topo.
- Empurre lentamente o êmbolo para cima para remover o ar excedente.
22. Comparando a quantidade com a dose prescrita
- Depois de remover todo o ar excedente, compare a quantidade com a dose prescrita.
- Se não tiver a quantidade prescrita na seringa, puxe lentamente o êmbolo de volta para retirar mais medicamento.
- Repita as etapas 19 a 21 até atingir a sua dose prescrita e não ter nenhuma bolha grande visível.
23. Confirmando a dose prescrita
- Antes de continuar, verifique se você tem a dose prescrita na seringa dosadora.
- Se a quantidade não corresponder à dose prescrita, repita as etapas 19 a 22.
24. Removendo a seringa dosadora do frasco e colocando-a ao lado
- Segure o êmbolo no lugar com uma mão. Com a outra mão, segure o adaptador do frasco e desrosqueie a seringa dosadora preenchida do frasco.
- Descarte o frasco no recipiente para objetos perfurocortantes.
- Coloque a seringa dosadora preenchida sobre uma superfície plana e limpa.
- Não toque na ponta da seringa dosadora, nem a deixe tocar em nenhuma superfície.
- Não toque na ponta da seringa dosadora, nem a deixe tocar em nenhuma superfície.
25. Conectando a agulha da injeção
- Não toque no eixo de conexão da agulha.
- Localize a agulha na bandeja inferior e abra a embalagem.
- Com a agulha ainda na embalagem, segure a base da agulha e gire a seringa dosadora até parar. Retire a agulha da embalagem.
- Afaste a proteção de segurança da agulha na direção da seringa no ângulo mostrado. Coloque a seringa dosadora sobre uma superfície plana e limpa.
- Não destampe a agulha.
26. Escolhendo e limpando o local de aplicação da injeção
- Selecione um local de aplicação da injeção na barriga (abdômen) ou na parte superior da coxa. Se injetar na área do abdômen, aplique a injeção com uma distância de 5 cm ao redor do seu umbigo.
- Escolha um local diferente cada vez que injetar.
- Não realize a injeção na pele ferida, dolorida, machucada ou com manchas vermelhas;
- Não injete através da roupa.
- Limpe o local da injeção com um novo lenço umedecido com álcool.
- Não toque novamente no local limpo onde será aplicada a injeção.
- Não toque novamente no local limpo onde será aplicada a injeção.
- Agora você está pronto para injetar o medicamento.
27. Injetando o medicamento
- Puxe a tampa diretamente para fora da agulha.
- Descarte a tampa.
- Não toque no êmbolo até estar pronto para injetar, para não perder nenhum medicamento.
- Não toque no êmbolo até estar pronto para injetar, para não perder nenhum medicamento.
- Aperte suavemente e segure uma dobra da pele onde você irá injetar. Insira a agulha com um movimento semelhante a um dardo em um ângulo de 45° a 90°. Isto ajuda a injetar diretamente sob a pele (injeção subcutânea).
- Empurre o êmbolo com pressão lenta e constante até que a seringa dosadora esteja vazia.
- Confirme que todo o medicamento foi injetado.
- Agora você pode soltar a dobra da pele.
- Sempre mantenha os dedos afastados da agulha.
- Sempre mantenha os dedos afastados da agulha.
- Mantendo o êmbolo pressionado, remova a agulha da pele no mesmo ângulo em que a inseriu.
- Para reaplicar a proteção de segurança da agulha, empurre-a contra uma superfície plana até ouvir um “clique” e ver que a agulha está coberta.
- Descarte a seringa dosadora e os itens usados em um recipiente para descarte de objetos perfurocortantes.
- Não remova a agulha da seringa dosadora.
- Não remova a agulha da seringa dosadora.
Como descartar WinrevairTM
- Descarte qualquer frasco usado (incluindo qualquer líquido restante de WinrevairTM), agulha, tampas de frasco e de agulha e seringas usadas em um recipiente para descarte de objetos perfurocortantes.
- Não descarte os frascos, seringas ou agulhas de WinrevairTM no lixo doméstico.
- Não reutilize nenhum dos itens. Este produto é descartável e deve ser usado apenas uma vez.
- Importante: Mantenha sempre o recipiente para descarte de objetos perfurocortantes fora do alcance de crianças e animais de estimação.
- Se você não tiver um recipiente para descarte de objetos perfurocortantes, poderá usar um recipiente doméstico que seja:
- Feito de um plástico resistente;
- Que pode ser fechado com uma tampa hermética e resistente a perfurações, sem que objetos pontiagudos possam sair;
- Firme e estável durante o uso;
- Resistente a vazamentos; e;
- Devidamente rotulado para alertar sobre resíduos perigosos dentro do recipiente.
Quando o recipiente para descarte de objetos perfurocortantes estiver quase cheio, você precisará seguir as diretrizes locais sobre a maneira correta de descartar o recipiente de objetos perfurocortantes. Não jogue fora medicamentos, frascos, agulhas soltas ou seringas no lixo doméstico. Pergunte ao seu farmacêutico como jogar fora os medicamentos que já não utiliza. Estas medidas ajudarão a proteger o ambiente.
Não recicle o seu recipiente usado de objetos perfurocortantes.
Instruções de uso - kit com 2 frascos-ampola
Conhecendo os itens de seu kit

Informações importantes para saber antes da injeção
- Você deve misturar este medicamento antes de utilizá-lo. Certifique-se de que o pó do medicamento no frasco esteja completamente dissolvido quando você injetar.
- Verifique a dose prescrita (quantidade em “mL”) a cada vez que você usar o medicamento. A sua dose prescrita pode mudar.
- Use somente os itens que acompanham o kit para preparar a dose prescrita.
- Não abra a embalagem, nem misture o medicamento até estar pronto para utilizá-lo.
- Não reutilize nenhum dos itens. Após aplicar a injeção, descarte o frasco usado com qualquer medicamento restante de WinrevairTM, agulha e seringas em um recipiente para objetos perfurocortantes.
Armazenando seu kit
- Guarde todo o kit de injeção na geladeira (2°C a 8°C), mas não congele.
- Mantenha o medicamento e os itens no kit de injeção e proteja-o da luz.
- Mantenha o kit de injeção fora do alcance de crianças e animais de estimação.
Início
Qualquer paciente ou cuidador que preparar e injetar WinrevairTM deve primeiro ser treinado e considerado capaz por um profissional de saúde para administrar sozinho WinrevairTM.
1. Verificando o produto WinrevairTM e o prazo de validade
- Retire o kit de injeção WinrevairTM da geladeira.
- Verifique o prazo de validade e se a caixa ou os itens do kit apresentam algum dano.
- Se vencido ou danificado, não use. Fale imediatamente com o seu médico ou farmacêutico.
- Verifique se este é o medicamento prescrito pelo seu médico.
2. Aguardando seu kit atingir a temperatura ambiente, reunindo os itens e lavando suas mãos
- Aguarde 15 minutos para permitir que o kit atinja a temperatura ambiente. Medicamento frio é mais dolorido ao injetar.
- Junto com o seu kit, reúna esses itens e procure uma superfície limpa e plana para preparar e injetar a sua dose.
- Lave suas mãos com água e sabão.
Misturando o medicamento em pó na forma líquida
- Comece com a Bandeja Superior.
3. Removendo o frasco 1, a seringa preenchida 1 e o adaptador do frasco 1 do kit

4a. Verificando o frasco do medicamento
- Não está danificado?
- Sem partículas visíveis?
- Está dentro da validade?
- Verifique o rótulo do frasco para confirmar que o medicamento não está vencido.
- Inspecione o pó do medicamento. Deve ser branco a esbranquiçado e pode parecer um pó compactado inteiro ou fragmentado.
- Não use se estiver vencido, danificado ou se você puder ver partículas nele.
4b. Removendo a tampa plástica e limpando o frasco
- Retire a tampa de plástico e limpe a tampa de borracha na parte superior do frasco com um lenço umedecido com álcool.
- Não use se a tampa do frasco estiver faltando.
- Não toque na tampa de borracha limpa.
- Coloque o frasco em uma superfície limpa e plana.
5a. Encaixando o adaptador ao frasco
- Abra a embalagem do adaptador do frasco e remova-o da embalagem.
- Segure a parte azul do adaptador e encaixe o adaptador do frasco com a parte superior do frasco.
- Não toque no interior do adaptador do frasco.
- Para conectar o adaptador do frasco:
- Não toque no interior do adaptador do frasco.
5b. Conectando o adaptador ao frasco
- Segure o frasco com uma mão. Empurre para baixo com firmeza para que se encaixe no lugar (você pode sentir um pouco de resistência).
5c. Limpando o adaptador do frasco
- Limpe a parte superior do adaptador do frasco com um lenço umedecido com álcool.
6. Verificando a seringa preenchida
- Confirme se a água para injetáveis dentro da seringa preenchida está límpida e se o produto não está vencido.
- Não danificada?
- Límpida?
- Sem partículas?
- Está dentro da validade?
- Não use se você observar grumos, partículas, alteração da coloração ou se o produto estiver vencido.
7. Retirando a tampa branca da seringa preenchida
- Retire a tampa da seringa preenchida ao longo da perfuração.
- Não toque na ponta da seringa preenchida.
- Não empurre o êmbolo; pode derramar a água.
8. Conectando a seringa preenchida ao adaptador do frasco
- Agora, pegue o frasco do medicamento com o adaptador do frasco acoplado.
- Alinhe a ponta da seringa preenchida com o círculo azul do adaptador do frasco.
- Empurre e gire a seringa preenchida no adaptador do frasco até não conseguir girar mais. Ao rosquear, certifique-se de segurar o adaptador do frasco.
- Empurre e gire até conectar.
- Não empurre o êmbolo; pode derramar a água.
9. Transferindo a água para injetáveis da seringa preenchida para o frasco
- Empurre lentamente o êmbolo totalmente para baixo para transferir toda a água para injetáveis dentro do frasco (o êmbolo se moverá para cima; isso é normal).
- Deixe a seringa preenchida acoplada ao frasco e coloque sobre uma superfície plana.
10. Preparando o frasco 2, a seringa preenchida 2 e o adaptador do frasco 2
- Remova o frasco 2, a seringa preenchida 2 e o adaptador do frasco 2 do kit.
- Importante: Repita as etapas 4 a 9 para preparar o frasco 2.
- Pare e verifique se você tem o frasco 1 e o frasco 2 preparados.
- Você precisa de dos dois frascos preparados antes de poder continuar para a Etapa 11.
11. Mexendo para misturar o medicamento
- Não agite os frascos
- Segure as seringas preenchidas em cada mão e mexa suavemente os frascos em movimentos circulares até que o pó esteja completamente dissolvido. Isso pode levar até 2 minutos.
- Quando o medicamento estiver bem misturado, deve ficar límpido. Caso contrário, repita esta etapa até que fique límpido.
- Para cada frasco, pressione o êmbolo para baixo para garantir que todo o líquido esteja no frasco (o êmbolo se moverá para cima; isso é normal).
12. Aguardando as bolhas desaparecerem
- Deixe o frasco repousar para que as bolhas desapareçam.
- Isso pode levar até 3 minutos.
- Antes de continuar, certifique-se de que o medicamento no frasco:
- Está límpido a ligeiramente perolado e transparente a ligeiramente amarelo acastanhado;
- Não tenha grumos ou pó;
- Não tenha bolhas grandes.
- Não há problema em ter uma leve espuma nas bordas do frasco.
13. Preparando os frascos removendo o ar excedente
- Comece com qualquer frasco. Enquanto o frasco estiver na posição vertical, puxe suavemente o êmbolo para cima até o topo do corpo, mas tenha cuidado para não puxar o êmbolo para fora da seringa.
- Importante: Execute esta etapa para ambos os frascos. Pare e verifique se ambos os frascos estão preparados antes de continuar
14. Removendo as seringas preenchidas dos frascos
- Segure os adaptadores dos frascos e desrosqueie ambas as seringas dos frascos.
- Descarte ambas as seringas no recipiente para objetos perfurocortantes.
- Você deve ter 2 frascos de medicamentos preparados e prontos para serem combinados nas próximas etapas.
Combinando o medicamento dos dois frascos
- Para as próximas etapas, você precisará de:
- Frascos 1 e 2 misturados;
- Itens da Bandeja Inferior.
15. Limpando a parte superior de ambos os adaptadores do frasco
- Com 2 lenços umedecidos com álcool da bandeja inferior, limpe a parte superior dos adaptadores dos frascos.
16. Removendo a seringa dosadora vazia da embalagem
- Localize a seringa dosadora vazia na bandeja inferior e retire-a da embalagem.
- Você usará esta seringa dosadora para medir o medicamento de que você precisa (com base na dose prescrita).
17. Puxando o ar para a seringa dosadora
- Você deve fazer isso para garantir que a pressão no frasco seja uniforme e obter uma dose precisa.
- Segure a seringa dosadora na vertical e puxe o êmbolo para baixo para aspirar 1,5 mL de ar.
18. Conectando a seringa dosadora em um dos frascos
- Enquanto segura o adaptador do frasco, rosqueie a seringa dosadora até parar.
19. Empurrando o ar para dentro do frasco e virando de cabeça para baixo
- Empurre o êmbolo totalmente para baixo para transferir todo o ar para o frasco.
- Em seguida, segure o êmbolo no lugar com o dedo polegar e vire o frasco de cabeça para baixo.
20. Retirando todo o medicamento do 1° frasco
- Puxe lentamente o êmbolo para trás. Pare em 1,5 mL.
- Isto garantirá que todo o medicamento do frasco estará na seringa dosadora.
- Não puxe ar excedente para dentro da seringa. Pare em 1,5 mL.
- Tenha cuidado para não puxar o êmbolo da seringa dosadora para fora.
21. Removendo o 1° frasco da seringa dosadora
- Segure o adaptador do frasco e desrosqueie a seringa dosadora cheia do frasco.
- Descarte o frasco vazio no recipiente para objetos perfurocortantes.
22. Conectando a seringa dosadora ao 2° frasco
- Enquanto você segura o adaptador do frasco para injetáveis do 2º frasco, rosqueie a seringa dosadora parcialmente cheia no adaptador do frasco para injetáveis até parar.
23. Colocando todo o medicamento no 2° frasco e virando de cabeça para baixo
- Empurre lentamente e totalmente o êmbolo para baixo, para transferir todo o medicamento para o frasco. Isto combina o medicamento de ambos os frascos.
- Segure o êmbolo no lugar com o dedo polegar e vire o frasco de cabeça para baixo.
24. Puxando o êmbolo de volta para retirar a sua dose
- Com o frasco e a seringa dosadora virados de cabeça para baixo, puxe lentamente o êmbolo de volta.
- Pare quando chegar à quantidade em “mL” definida na sua prescrição.
25. Verificando se há bolhas de ar e bolsas de ar
- Verifique se existem grandes bolhas de ar ou bolsas de ar na seringa. Você removerá o ar excedente nas próximas etapas.
26. Removendo bolhas de ar e bolsas de ar
- Se você observar bolhas de ar ou uma bolsa de ar, bata na lateral da seringa dosadora para mover o ar para o topo.
- Empurre lentamente o êmbolo para cima para remover o ar excedente.
27. Comparando a quantidade com a dose prescrita
- Depois de remover todo o ar excedente, compare a quantidade com a dose prescrita.
- Se não tiver a quantidade prescrita na seringa, puxe lentamente o êmbolo de volta para retirar mais medicamento.
- Repita as etapas 24 a 26 até atingir a sua dose prescrita e não ter nenhuma bolha grande visível.
28. Confirmando a dose prescrita
- Antes de continuar, verifique se você tem a dose prescrita na seringa dosadora.
- Se a quantidade não corresponder à dose prescrita, repita as etapas 24 a 27.
29. Removendo a seringa dosadora do frasco e colocando-a ao lado
- Segure o êmbolo no lugar com uma mão. Com a outra mão, segure o adaptador do frasco e desrosqueie a seringa dosadora preenchida do frasco.
- Descarte o frasco no recipiente para objetos perfurocortantes.
- Coloque a seringa dosadora preenchida sobre uma superfície plana e limpa.
- Não toque na ponta da seringa dosadora, nem a deixe tocar em nenhuma superfície.
- Não toque na ponta da seringa dosadora, nem a deixe tocar em nenhuma superfície.
30. Conectando a agulha da injeção
- Não toque no eixo de conexão da agulha.
- Localize a agulha na bandeja inferior e abra a embalagem.
- Com a agulha ainda na embalagem, segure a base da agulha e gire a seringa dosadora até parar. Retire a agulha da embalagem.
- Afaste a proteção de segurança da agulha na direção da seringa no ângulo mostrado. Coloque a seringa dosadora sobre uma superfície plana e limpa.
- Não destampe a agulha.
31. Escolhendo e limpando o local de aplicação da injeção
- Selecione um local de aplicação da injeção na barriga (abdômen) ou na parte superior da coxa. Se injetar na área do abdômen, aplique a injeção com uma distância de 5 cm ao redor do seu umbigo.
- Escolha um local diferente cada vez que injetar.
- Não realize a injeção na pele ferida, dolorida, machucada ou com manchas vermelhas;
- Não injete através da roupa.
- Limpe o local da injeção com um novo lenço umedecido com álcool.
- Não toque novamente no local limpo onde será aplicada a injeção.
- Não toque novamente no local limpo onde será aplicada a injeção.
- Agora você está pronto para injetar o medicamento.
32. Injetando o medicamento
- Puxe a tampa diretamente para fora da agulha.
- Descarte a tampa.
- Não toque no êmbolo até estar pronto para injetar, para não perder nenhum medicamento.
- Não toque no êmbolo até estar pronto para injetar, para não perder nenhum medicamento.
- Aperte suavemente e segure uma dobra da pele onde você irá injetar. Insira a agulha com um movimento semelhante a um dardo em um ângulo de 45° a 90°. Isto ajuda a injetar diretamente sob a pele (injeção subcutânea).
- Empurre o êmbolo com pressão lenta e constante até que a seringa dosadora esteja vazia.
- Confirme que todo o medicamento foi injetado.
- Agora você pode soltar a dobra da pele.
- Sempre mantenha os dedos afastados da agulha.
- Sempre mantenha os dedos afastados da agulha.
- Mantendo o êmbolo pressionado, remova a agulha da pele no mesmo ângulo em que a inseriu.
- Para reaplicar a proteção de segurança da agulha, empurre-a contra uma superfície plana até ouvir um “clique” e ver que a agulha está coberta.
- Descarte a seringa dosadora e os itens usados em um recipiente para descarte de objetos perfurocortantes.
- Não remova a agulha da seringa dosadora.
- Não remova a agulha da seringa dosadora.
Como descartar WinrevairTM
- Descarte qualquer frasco usado (incluindo qualquer líquido restante de WinrevairTM), agulha, tampas de frasco e de agulha e seringas usadas em um recipiente para descarte de objetos perfurocortantes.
- Não descarte os frascos, seringas ou agulhas de WinrevairTM no lixo doméstico.
- Não reutilize nenhum dos itens. Este produto é descartável e deve ser usado apenas uma vez.
- Importante: Mantenha sempre o recipiente para descarte de objetos perfurocortantes fora do alcance de crianças e animais de estimação.
- Se você não tiver um recipiente para descarte de objetos perfurocortantes, poderá usar um recipiente doméstico que seja:
- Feito de um plástico resistente;
- Que pode ser fechado com uma tampa hermética e resistente a perfurações, sem que objetos pontiagudos possam sair;
- Firme e estável durante o uso;
- Resistente a vazamentos; e;
- Devidamente rotulado para alertar sobre resíduos perigosos dentro do recipiente.
Quando o recipiente para descarte de objetos perfurocortantes estiver quase cheio, você precisará seguir as diretrizes locais sobre a maneira correta de descartar o recipiente de objetos perfurocortantes. Não jogue fora medicamentos, frascos, agulhas soltas ou seringas no lixo doméstico. Pergunte ao seu farmacêutico como jogar fora os medicamentos que já não utiliza. Estas medidas ajudarão a proteger o ambiente.
Não recicle o seu recipiente usado de objetos perfurocortantes.
Perguntas frequentes
O que devo fazer se estiver sangrando no local da injeção?
Coloque um algodão ou curativo na pele imediatamente e aplique uma pequena pressão. Se o sangramento não parar, ligue para o seu médico ou farmacêutico imediatamente.
Onde posso encontrar a quantidade prescrita a ser injetada?
A quantidade de prescrição em “mL” está na sua prescrição. Contate seu médico ou farmacêutico se você não conseguir encontrar a quantidade a ser injetada.
O que devo fazer se acidentalmente algum medicamento entrar em contato com a minha pele ou superfície do corpo?
Lave bem a área com água e sabão imediatamente.
O que devo fazer se não tiver certeza de que administrei corretamente a dose prescrita?
Ligue para o seu médico ou farmacêutico.
O que devo fazer se o êmbolo da minha seringa dosadora se mover automaticamente quando tento retirar o medicamento do frasco?
Não se preocupe se o êmbolo se mover ligeiramente sozinho quando você estiver enchendo a seringa dosadora com o medicamento.
Com uma mão, segure o êmbolo no lugar para impedir que ele se mova.
Com a outra mão, desrosqueie o frasco -ampola da seringa dosadora. Depois de desrosqueado, é seguro soltar o êmbolo.
Você pode evitar esse movimento automático do êmbolo empurrando ar para dentro do frasco antes de encher a seringa dosadora com o medicamento. Consulte as etapas 16 a 23 (kit com 1 frasco-ampola) ou 17 a 28 (kit com dois frascos-ampola) para obter instruções detalhadas.
O que devo fazer se os itens do meu kit estiverem danificados ou comprometidos (por exemplo, descoloridos, turvos ou com partículas)?
Se os itens do seu kit estiverem danificados ou comprometidos, não o use. Ligue para o seu médico ou farmacêutico.
O que devo fazer se o meu medicamento não ficar límpido depois de misturar e fazer movimentos circulares?
Não use o medicamento se você fez movimentos circulares no frasco do medicamento por cerca de 2 minutos e deixou-o repousar por mais 3 minutos, mas o frasco do medicamento permanece turvo ou apresenta grumos, pó ou partículas estranhas. Ligue para o seu médico ou farmacêutico.
O que devo fazer se a água para injetáveis não sair da seringa preenchida?
Verifique se o adaptador do frasco está firmemente conectado ao frasco. Caso contrário, segure o frasco e pressione firmemente o adaptador do frasco para garantir que o adaptador do frasco perfure a tampa de borracha do frasco.
O que devo fazer se eu deixar cair os componentes do meu kit?
Não use se algum item estiver danificado. Se não tiver certeza, ligue para seu médico ou farmacêutico.
Posso usar meu kit que ficou fora da geladeira?
Se o kit de injeção não utilizado estiver fora da geladeira por um longo período de tempo, entre em contato com seu médico ou farmacêutico antes de continuar.
Preciso usar o medicamento misturado imediatamente?
Recomendamos que você injete o medicamento logo após a mistura, mas não mais de 4 horas depois de misturado. Se passarem mais de 4 horas, descarte o medicamento. Se você tiver dúvidas ou não tiver certeza sobre o processo, entre em contato com seu médico ou farmacêutico.
Como posso obter ajuda para preparar e administrar minha injeção?
Se você tiver dúvidas sobre como administrar WinrevairTM da maneira correta ou precisar de mais informações, ligue para seu médico ou farmacêutico.
Para qualquer outra informação sobre este medicamento, contate o seu médico ou farmacêutico ou o serviço de atendimento do consumidor da empresa através do número 0800-0122232.
A sua dose:
- A sua dose de WinrevairTM depende do seu peso corporal e exames de sangue.
- O seu médico lhe dirá quanto de WINREVAIRTM deve aplicar e quando aplicá-lo.
- Não altere a sua dose ou pare de aplicar WINREVAIRTM sem falar com o seu médico.
- Não aplique WINREVAIRTM com mais frequência do que o indicado pelo seu médico. Se você não tiver certeza de quando aplicar WINREVAIRTM, consulte seu médico.
O seu médico monitorará a sua dose:
- Antes da sua primeira dose e regularmente enquanto estiver usando WINREVAIRTM, o seu médico solicitará exames de sangue. Estes são feitos para que o seu médico possa te monitorar e encontrar a melhor dose para você.
- O seu médico pode ajustar a sua dose, atrasar o tratamento ou interromper o tratamento, dependendo da sua resposta à WINREVAIRTM.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento.
Não interrompa o tratamento sem o conhecimento do seu médico.
Quais cuidados devo ter ao usar o Winrevair?
O que devo dizer ao meu médico antes e durante a utilização de WinrevairTM?
Informe ao seu médico (ou farmacêutico) sobre quaisquer condições médicas que você tem ou teve, e sobre quaisquer alergias.
Gravidez
- WinrevairTM pode prejudicar o feto. Informe ao seu médico se estiver gestante ou se planeja engravidar.
- Informe ao seu médico imediatamente se engravidar ou se pensar que pode estar gestante enquanto estiver utilizando WinrevairTM.
- O seu médico deve solicitar um teste de gravidez antes de começar a utilizar WinrevairTM.
- Você deve usar método contraceptivo eficaz ao utilizar WinrevairTM.
- Você deve continuar a utilizar métodos contraceptivos eficazes durante, pelo menos, 4 meses após a sua última dose se você parar de tomar WinrevairTM. Pergunte ao seu médico sobre métodos contraceptivos que funcionariam bem para você.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Amamentação
- Informe ao seu médico se estiver amamentando ou se planeja amamentar. Não se sabe se WinrevairTM passa para o leite materno.
- Não amamentar enquanto estiver tomando WinrevairTM.
- Não amamente durante pelo menos 4 meses após a sua última dose se você parar de tomar WinrevairTM. Converse com seu médico sobre a melhor maneira de alimentar o seu bebê.
Uso criterioso no aleitamento ou na doação de leite humano: O uso deste medicamento no período da lactação depende da avaliação e acompanhamento do seu médico ou cirurgião-dentista.
Crianças
Não se sabe se WinrevairTM é seguro e eficaz em crianças menores de 18 anos de idade.
Este medicamento pode causar doping.
Superdose: o que acontece se tomar uma dose do Winrevair maior do que a recomendada?
Se usar WinrevairTM em excesso, contate o seu médico ou farmacêutico.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Quais as reações adversas e os efeitos colaterais do Winrevair?
Qualquer medicamento pode ter efeitos não intencionais ou indesejáveis, os chamados efeitos colaterais.
WinrevairTM pode causar efeitos colaterais graves, incluindo:
- Alto nível de hemoglobina (uma proteína nos glóbulos vermelhos que transporta oxigênio). Isso pode aumentar a chance de formação de um coágulo sanguíneo que pode bloquear um vaso sanguíneo. O seu médico solicitará exames de sangue para verificar os níveis de hemoglobina antes de começar e regularmente durante o tratamento com WinrevairTM.
- Baixo número de plaquetas (células sanguíneas que ajudam a coagular o sangue). Isso pode causar sintomas como aparecimento fácil de manchas roxas, sangramento contínuo por cortes e sangramentos nasais. O seu médico solicitará exames de sangue para verificar o nível de plaquetas antes de começar e regularmente durante o tratamento com WinrevairTM. Informe o seu profissional de saúde se você desenvolver hematomas ou sangramentos facilmente, sangramento contínuo ou sangramento nasal.
- Sangramento grave. Informe o seu profissional de saúde se desenvolver quaisquer sinais ou sintomas de sangramento, incluindo: vômito com sangue ou se seu vômito parecer borra de café; náusea; tontura ou sensação de fraqueza; urina rosa ou marrom; cólicas abdominais persistentes; fezes vermelhas ou pretas que parecem alcatrão; forte dor nas costas; tossir sangue ou coágulos sanguíneos; sangramento menstrual anormalmente intenso; dores de cabeça persistentes.
- Diminuição da fertilidade. WinrevairTM pode diminuir a fertilidade feminina e masculina.
Os efeitos colaterais mais comuns de WinrevairTM são:
- Dor de cabeça;
- Sangramentos nasais (epistaxe);
- Telangiectasia (também chamados de vasinhos ou pequenos vasos sanguíneos que se parecem com linhas rosas ou vermelhas na pele);
- Diarreia;
- Tontura;
- Irritação na pele;
- Aumento da pressão arterial;
- Vermelhidão.
Outros efeitos colaterais também podem ocorrer raramente, e como com qualquer medicamento sob prescrição, alguns efeitos colaterais podem ser graves.
Pergunte ao seu médico ou farmacêutico para obter mais informações. Ambos têm uma lista mais completa de efeitos colaterais. Informe imediatamente ao seu médico ou farmacêutico sobre estes ou quaisquer outros sintomas incomuns.
Atenção: este produto é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, informe seu médico ou cirurgião-dentista.
Interação medicamentosa: quais os efeitos de tomar Winrevair com outros remédios?
Informe ao seu médico sobre todos os medicamentos que você toma, incluindo medicamentos sob prescrição e os isentos de prescrição, vitaminas e fitoterápicos.
Conheça os medicamentos que você toma. Mantenha uma lista deles e mostre a lista ao seu médico e farmacêutico quando receber um novo medicamento.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
Qual a composição do Winrevair?
Frasco-ampola de dose única de 45 mg
Cada frasco contém 45 mg de sotatercepte. Após reconstituição com 1,0 mL de Água para Injetáveis, a concentração resultante é de 50 mg/1,0 mL de sotatercepte e o volume nominal de entrega é de 0,9 mL.
Excipientes: ácido cítrico monoidratado, polissorbato 80, sacarose e citrato trissódico di-hidratado.
Diluente: água para injetáveis.
Frasco-ampola de dose única de 60 mg
Cada frasco contém 60 mg de sotatercepte. Após reconstituição com 1,3 mL de Água para Injetáveis, a concentração resultante é de 50 mg/1,0 mL de sotatercepte e o volume nominal de entrega é de 1,2 mL.
Excipientes: ácido cítrico monoidratado, polissorbato 80, sacarose e citrato trissódico di-hidratado.
Diluente: água para injetáveis.
Como devo armazenar o Winrevair?
Armazenar em geladeira (2°C e 8°C). Não congelar. Manter nesta embalagem até o final do uso. Manter na embalagem original para proteger da luz.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Contate o seu médico ou farmacêutico se o kit de injeção não utilizado esteve fora da geladeira durante um longo período de tempo.
Após você misturar o pó do medicamento com a água para injetáveis (fornecida no kit), é recomendável que você o injete imediatamente, mas em até 4 horas após a reconstituição.
Após preparo, utilize a solução reconstituída o mais rápido possível, mas em até 4 horas após a reconstituição, em temperatura de até 30°C.
A estabilidade por até 4 horas foi comprovada para os aspectos físico-químicos do medicamento. Do ponto de vista microbiológico, recomenda-se que o medicamento seja utilizado imediatamente após a reconstituição.
Características do medicamento
WinrevairTM é um pó liofilizado estéril, sem conservantes, branco a esbranquiçado, para administração subcutânea após reconstituição. Após a reconstituição, WinrevairTM é límpido a opalescente, incolor a ligeiramente amarelado acastanhado e livre de grumos ou pó.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Dizeres Legais do Winrevair
Registro 1.0171.0238
Importado e Registrado por:
Merck Sharp & Dohme Farmacêutica Ltda.
Av. Dr. Chucri Zaidan, 296 – São Paulo/SP
CNPJ 03.560.974/0001-18 - Brasil
Produzido por:
Patheon Italia S.p.A
Monza, Itália
SAC
0800-0122232
online@merck.com
Venda sob prescrição.
Apresentações do Winrevair
Pó liofilizado para solução injetável 45mg e 60mg
- 45 mg de sotatercepte em frasco-ampola de dose única em embalagem com 1 frasco-ampola, 1 seringa preenchida de diluente, 1 adaptador, 1 seringa, 1 agulha e 4 envelopes com lenços umedecidos com álcool.
- 45 mg de sotatercepte em frasco-ampola de dose única em embalagem com 2 frascos-ampolas, 2 seringas preenchidas de diluente, 2 adaptadores, 1 seringa, 1 agulha e 8 envelopes com lenços umedecidos com álcool.
- 60 mg de sotatercepte em frasco-ampola de dose única em embalagem com 1 frasco-ampola, 1 seringa preenchida de diluente, 1 adaptador, 1 seringa, 1 agulha e 4 envelopes com lenços umedecidos com álcool.
- 60 mg de sotatercepte em frasco-ampola de dose única em embalagem com 2 frascos-ampolas, 2 seringas preenchidas de diluente, 2 adaptadores, 1 seringa, 1 agulha e 8 envelopes com lenços umedecidos com álcool.
Uso subcutâneo.
Uso adulto.
O que devo fazer quando me esquecer de usar o Winrevair?
Se você perder a dose prescrita de WinrevairTM, aplique-a dentro de 3 dias e siga o cronograma original para a próxima dose. Se não for aplicada dentro de 3 dias, converse com seu médico para orientação.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Mensagens de Alerta do Winrevair
Por favor, leia esta informação cuidadosamente antes de começar a usar o seu medicamento, mesmo que você já esteja utilizando o medicamento. Algumas das informações podem ter sido alteradas.
Especificações sobre o Winrevair
Caracteristicas Principais
| Fabricante | MSD | |
| Necessita de Receita | Branca Comum (Venda Sob Prescrição Médica) | |
| Princípio Ativo | Sotatercepte | |
| Categoria do Medicamento | Aparelho Respiratório | |
| Registro no Ministério da Saúde | 1017102380066 | |
| Código de Barras | 7897572020917 | |
| Temperatura de Armazenamento | De 2 a 8°C | |
| Produto Refrigerado | Este produto precisa ser refrigerado | |
| Bula do Paciente | Bula do Winrevair | |
| Bula do Profissional | Bula do Profissional do Winrevair | |
| Modo de Uso | Uso injetável (subcutâneo) | |
| Pode partir | Esta apresentação não pode ser partida | |
Que tal conferir outros itens? Temos outras opções que podem te interessar!