Duaklir Genuair 400mcg + 12mcg, caixa com 1 dispositivo com pó para uso inalatório (60 acionamentos)
- Brometo de Aclidínio + Fumarato de Formoterol Di-Hidratado
Branca Comum (Venda Sob Prescrição Médica)
Temperatura ambiente
Não pode ser partido
Bula do Duaklir Genuair
Duaklir Genuair, para o que é indicado e para o que serve?
Duaklir Genuair® é indicado como tratamento broncodilatador de manutenção para o alívio de sintomas em pacientes adultos com doença pulmonar obstrutiva crônica (DPOC).
Como o Duaklir Genuair funciona?
Duaklir Genuair® contém brometo de aclidínio e fumarato de formoterol di-hidratado, substâncias pertencentes a um grupo chamado de broncodilatadores. Substâncias broncodilatadoras relaxam os músculos das vias aéreas, permitindo que estas fiquem mais abertas e ajudando a respirar mais facilmente.
Ao inalar pelo bocal, o medicamento segue diretamente para o seu pulmão. Este efeito dura até 12 horas após a inalação do medicamento.
Quais as contraindicações do Duaklir Genuair?
Você não deve usar Duaklir Genuair® se apresentar alergia ao brometo de aclidínio, ao fumarato de formoterol di-hidratado ou a qualquer um dos componentes do medicamento.
Como usar o Duaklir Genuair?
Para uso por via inalatória oral.
Os pacientes devem ser instruídos sobre o uso correto do produto. Para instruções detalhadas, consulte as instruções de uso. Deve-se orientar os pacientes a ler as instruções cuidadosamente.
Instruções de uso
Antes de usar Duaklir Genuair®, leia as instruções completas.
Retire o Duaklir Genuair® do envoltório e familiarize-se com seus componentes.

Resumo
- Para usar Duaklir Genuair® há 2 etapas que você deve seguir após remover a tampa:
- Etapa 1: Pressione e solte o botão laranja e expire (solte o ar) completamente, longe do inalador.
- Etapa 2: Coloque os seus lábios firmemente em volta do bocal e inale (puxe o ar) forte e profundamente pelo inalador.
Após a inalação, lembre-se de recolocar a tampa protetora.
Início
- Antes do primeiro uso, rasgue o envoltório no recorte e retire o inalador. O envoltório e o dessecante devem ser descartados.
- Quando for tomar a dose de seu medicamento, retire a tampa protetora apertando levemente as setas marcadas em ambos os lados, e puxe para fora (vide figura 1).
- Verifique se nada está bloqueando o bocal.
- Segure o inalador na posição horizontal com o bocal voltado em sua direção e o botão laranja voltado para cima (vide figura 2).
Etapa 1
- Pressione o botão laranja completamente e então solte-o (vide figuras 3 e 4).
- Não continue a pressionar o botão laranja.
- Pare e verifique: certifique-se que a dose está pronta para ser inalada.
- Certifique-se que a janela de controle colorida mudou da cor vermelha para a cor verde (vide figura 5).
- A janela de controle verde confirma que seu medicamento está pronto para a inalação.
- Se a janela de controle colorida estiver vermelha, volte às ações de pressionar e soltar (vide etapa 1).
- Antes de colocar o inalador na boca, expire (solte o ar) completamente. Não expire para dentro do inalador.
Etapa 2
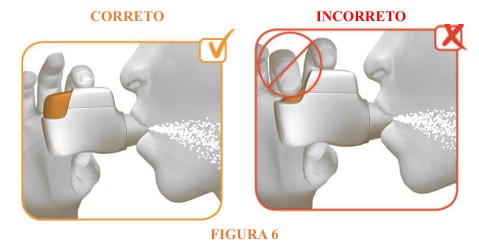
- Aperte os lábios em volta do bocal do inalador e inspire (puxe o ar) forte e profundamente pelo bocal (vide figura 6).
- Esta inspiração intensa e profunda leva o medicamento através do inalador para os seus pulmões.
- Atenção: não pressione o botão laranja para baixo enquanto estiver inalando.
- Ao inspirar, você ouvirá um “clique”. Isto indica que você está usando o inalador corretamente.
- Continue inspirando mesmo depois de ter ouvido o “clique” do inalador, para certificar-se que recebeu a dose completa.
- Retire o inalador de sua boca e prenda sua respiração pelo tempo que for confortável, então expire lentamente pelo nariz.
- Nota: Alguns pacientes podem sentir um sabor adocicado ou ligeiramente amargo, dependendo do paciente, durante a inalação do medicamento. Não tome uma dose extra se não sentir qualquer sabor após a inalação.
- Pare e verifique: certifique-se que inalou de forma correta.
- Certifique-se que a janela de controle voltou para o vermelho (vide figura 7). Isto confirma que você inalou corretamente a dose completa.
- Se a cor da janela de controle ainda estiver verde, repita a inspiração forte e profunda através do bocal (vide etapa 2).
- Se a janela ainda não tiver mudado para vermelho, pode ser que você se esqueceu de soltar o botão laranja antes de inspirar ou pode não ter inalado corretamente. Se isso acontecer, tente novamente.
- Certifique-se que você soltou o botão laranja e inspire fortemente pelo bocal.
- Nota: Se você não for capaz de inalar corretamente depois de diversas tentativas, consulte seu médico.
- Certifique-se que a janela de controle voltou para o vermelho (vide figura 7). Isto confirma que você inalou corretamente a dose completa.
- Quando a janela voltar a ficar vermelha, coloque novamente a tampa de proteção pressionando de volta no bocal (vide figura 8).
Quando devo obter um novo inalador?
- O inalador está equipado com um indicador de dose para mostrar quantas doses aproximadamente ainda existem no inalador. O indicador de dose se move lentamente para baixo, exibindo intervalos de 10 (60, 50, 40, 30, 20, 10, 0) (vide figura A). Cada inalador entregará pelo menos 60 doses.
- Quando aparecer uma faixa com listras vermelhas no indicador de dose (vide figura A), isto significa que você está próximo de sua última dose e deve obter um novo inalador.
Nota: Se o seu inalador parecer que está danificado ou se você perder a tampa, ele deverá ser substituído. Não é necessário limpar o seu inalador. No entanto, se quiser limpá-lo, deverá limpar o exterior do bocal com um pano seco ou papel-toalha.
Nunca utilize água para limpar o inalador, pois poderá danificar o medicamento.
Como você sabe que o inalador está vazio?
- Quando aparecer 0 (zero) no centro do indicador de dose, você deverá continuar a utilizar as doses restantes no inalador.
Quando a última dose tiver sido preparada para inalação, o botão laranja não voltará totalmente à sua posição inicial, mas ficará bloqueado numa posição intermediária (vide figura B). Apesar do botão laranja ficar bloqueado, ainda assim você poderá inalar sua última dose. Depois disso o inalador não pode ser utilizado novamente e você deve começar a usar um inalador novo.
Posologia do Duaklir Genuair
A dose recomendada é 1 inalação de 400/12 mcg duas vezes ao dia, uma vez pela manhã e uma vez à noite.
Idosos
Nenhum ajuste de dose é necessário em pacientes idosos.
Disfunção renal
Nenhum ajuste de dose é necessário em pacientes com disfunção renal.
Disfunção hepática
Nenhum ajuste de dose é necessário em pacientes com disfunção hepática.
População pediátrica
Não há uso relevante de Duaklir Genuair® em crianças e adolescentes.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento.
Não interrompa o tratamento sem o conhecimento do seu médico.
O que devo fazer quando me esquecer de usar o Duaklir Genuair?
Se você se esquecer de usar uma dose de Duaklir Genuair®, administre-a assim que possível. A dose seguinte deve ser tomada no horário habitual. Não se deve dobrar a dose para compensar a dose esquecida.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Quais cuidados devo ter ao usar o Duaklir Genuair?
Duaklir Genuair® não deve ser usado para tratar asma.
Se imediatamente após o uso do medicamento você apresentar aperto no peito, chiado ou falta de ar repentinamente, isso pode significar uma condição clínica chamada de broncoespasmo paradoxal. Neste caso, interrompa o tratamento imediatamente e consulte seu médico.
Duaklir Genuair® não é indicado para o tratamento de episódios agudos de broncoespasmo (falta de ar e chiado no peito).
Se você sentir o aumento na frequência cardíaca (aumento dos batimentos do coração) ou pressão alta, consulte seu médico.
Duaklir Genuair® deve ser usado com cautela em pacientes com distúrbios cardiovasculares graves (problemas no coração) e tireotoxicose (problemas na glândula tireoide). Informe seu médico se você apresentar alguma destas condições. Duaklir Genuair® deve ser usado com cautela em pacientes com hiperplasia prostática sintomática (aumento da próstata), retenção urinária (dificuldade de urinar) ou glaucoma de ângulo estreito (visão com halos ao redor de luzes ou imagens coloridas).
Efeitos metabólicos de hiperglicemia (aumento do açúcar no sangue) e hipocalemia (diminuição dos íons potássio no sangue) podem ocorrer com este tipo de medicamento.
Nenhum estudo sobre os efeitos na capacidade para dirigir e usar máquinas foi realizado.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Informe seu médico sobre a ocorrência de gravidez na vigência do tratamento ou após o término, ou se estiver amamentando.
Duaklir Genuair® deve ser usado durante a gravidez somente se os benefícios esperados superarem os riscos potenciais, a critério de seu médico.
O uso de Duaklir Genuair® por mulheres que estão amamentando somente deve ser considerado se o benefício esperado para a lactante for maior do que qualquer possível risco ao lactente, a critério de seu médico.
Atenção : Este medicamento contém lactose (tipo de açúcar) e não deve ser usado por pessoas com síndrome de má-absorção de glicose-galactose.
Quais as reações adversas e os efeitos colaterais do Duaklir Genuair?
As reações adversas mais frequentes relacionadas com Duaklir Genuair® foram nasofaringite - resfriado comum (7,9%) e cefaléia - dor de cabeça (6,8%).
As reações adversas atribuídas à associação de aclidínio/formoterol ou aos componentes individuais são apresentadas a seguir:
- Reação comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento): nasofaringite3 (refriado comum), infecção do trato urinário1, sinusite2, abscesso dentário1 (infecção na base dos dentes), insônia2 (dificuldade para dormir), ansiedade2, cefaleia (dor de cabeça)3, tontura3, tremor2, tosse3, diarreia3, náusea3 (enjoo) , boca seca2, mialgia2 (dores musculares), espasmos musculares2, edema periférico3 (inchaço de mãos, tornozelos ou pés), creatinina fosfoquinase aumentada no sangue1 (níveis aumentados no sangue de uma proteína encontrada nos músculos).
- Reação incomum (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento): hipocalemia3 (diminuição dos íons potássio no sangue), hiperglicemia3 (aumento do açúcar no sangue), agitação3, disgeusia3 (distúrbios no paladar), visão turva2, taquicardia2 (aumento dos batimentos do coração), prolongamento de QTc no eletrocardiograma2 (traço cardíaco anormal levando potencialmente a uma alteração anormal do ritmo cardíaco), palpitações3 (percepção dos batimentos do coração), disfonia2 (rouquidão), irritação na garganta3, estomatite3 (inflamação da boca), erupção cutânea3 (irritação na pele), prurido3 (coceira), retenção urinária3 (dificuldade de urinar), aumento da pressão arterial3 (pressão alta).
- Reação rara (ocorre entre 0,01% e 0,1% dos pacientes que utilizam este medicamento): hipersensibilidade4 (alergia), broncoespasmo, incluindo paroxístico4 (sensação repentina de aperto no peito, tosse, chiado ou falta de ar).
- Desconhecida (não pode ser estimada a partir dos dados disponíveis): angioedema4 (inchaço da pele e mucosas, afetando a face, lábios, língua ou garganta), reação anafilática4 (reação alérgica grave), angina pectoris4 (dor no peito).
1 Reações adversas observadas com a associação de aclidínio/formoterol, mas não relatadas para os componentes individuais.
2 Reações adversas observadas com a associação de aclidínio/formoterol e relatadas para pelo menos um dos componentes individuais.
3 Reações adversas relatadas para pelo menos um dos componentes individuais, mas relatadas a associação de aclidínio/formoterol 400/12 microgramas em uma incidência menor do que, ou comparável ao placebo.
4 Reações adversas relatadas para pelo menos um dos componentes individuais, mas não observadas com a associação de aclidínio/formoterol 400/12 microgramas; categoria de frequência de acordo com os componentes individuais.
Atenção: este produto é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, informe seu médico ou cirurgião-dentista.
Apresentações do Duaklir Genuair
Pó para inalação 400mcg + 12 mcg/inalação
Embalagem com 1 inalador contendo 60 inalações.
Uso inalatório por via oral.
Uso adulto.
Qual a composição do Duaklir Genuair?
Cada dose contém:
Brometo de aclidínio | 400 mcg (equivalente a 343 mcg de aclidínio) |
Fumarato de formoterol di-hidratado | 12 mcg |
Excipientes: alfalactose monoidratada.
A dose liberada é 396 mcg de brometo de aclidínio (equivalente a 340 mcg de aclidínio) e 11,8 mcg de fumarato de formoterol di-hidratado.
Superdose: o que acontece se tomar uma dose do Duaklir Genuair maior do que a recomendada?
Se você usar mais inalações do que deveria, contate seu médico para orientações.
Existem evidências limitadas sobre o tratamento da superdosagem de Duaklir Genuair®. Altas doses de Duaklir Genuair® podem levar a sinais e sintomas anticolinérgicos/ β2-adrenérgicos exagerados; sendo que os mais frequentes incluem visão turva, boca seca, náusea (enjoo), espasmo muscular, tremor, dor de cabeça, palpitações (percepção dos batimentos do coração)) e hipertensão sistólica (pressão alta).
Duaklir Genuair® deve ser descontinuado em caso de superdosagem. Indica-se o tratamento de suporte e sintomático.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Interação medicamentosa: quais os efeitos de tomar Duaklir Genuair com outros remédios?
Informe seu médico se estiver tomando ou precisar tomar medicamentos da classe dos anticolinérgicos e/ou agonista β2-adrenérgicos (como brometo de ipratrópio, brometo de tiotrópio, sulfato de salbutamol e outros medicamentos para tratamento problemas respiratórios); metilxantinas (como a teofilina e outros medicamentos para tratamento de problemas respiratórios); esteroides (como a prednisolona); diuréticos não poupadores de potássio (como furosemida ou hidroclorotiazida); bloqueadores β-adrenérgicos (como timolona, atenolol ou propanolol); inibidores da monoamina oxidase e antidepressivos tricíclicos (medicamentos para depressão); anti-histamínicos (medicamentos para alergia); ou macrolídeos (antibióticos como eritromicina, claritromicina e telitromicina).
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
Qual a ação da substância do Duaklir Genuair?
Resultados de Eficácia
Eficácia clínica
Os estudos clínicos de fase III incluíram aproximadamente 4.000 pacientes com DPOC e compreenderam dois estudos de seis meses, randomizados, controlados com placebo e comparador ativo (ACLIFORM-COPD e AUGMENT), um estudo de extensão de seis meses do estudo AUGMENT e um estudo adicional, randomizado, controlado de 12 meses. Durante esses estudos, permitiu-se que os pacientes continuassem com seus tratamentos estáveis com corticosteroides inalatórios, doses baixas de corticosteroide oral, terapia com oxigênio (se menos de 15h/dia) ou metilxantinas e usassem salbutamol como medicação de resgate.
A eficácia foi avaliada por medições da função pulmonar, resultados sintomáticos, estado de saúde doença- específico, uso de medicação de resgate e exacerbações da DPOC. Nos estudos de segurança de longo prazo, Brometo de Aclidínio + Fumarato de Formoterol Di-Hidratado foi associado à eficácia sustentada quando administrado ao longo de um período de um ano sem evidência de taquifilaxia.
Efeitos sobre a função pulmonar
Brometo de Aclidínio + Fumarato de Formoterol Di-Hidratado 400/12 microgramas, duas vezes ao dia, proporcionou de forma consistente melhora clinicamente significativas na função pulmonar (VEF1, capacidade vital forçada e capacidade inspiratória) comparado com o placebo. Nos estudos de fase III, efeitos clinicamente significativos de broncodilatação foram observados dentro de 5 minutos da primeira dose e se mantiveram ao longo do intervalo de administração. Houve um efeito sustentado ao longo do tempo nos estudos de fase III de seis meses e um ano.
O VEF1 uma hora após a dose e o VEF1 no vale - pré-dose (comparado com aclidínio 400 microgramas e formoterol 12 microgramas, respectivamente) foram definidos como desfechos co-primários em ambos os estudos pivotais de fase III de seis meses para demonstrar as contribuições broncodilatadoras do formoterol e do aclidínio em Brometo de Aclidínio + Fumarato de Formoterol Di-Hidratado, respectivamente.
No estudo ACLIFORM-COPD, Brometo de Aclidínio + Fumarato de Formoterol Di-Hidratado demonstrou melhora no VEF1 em 1 hora após a dose em relação ao placebo e aclidínio de 299 mL e 125 mL, respectivamente (ambos p<0,0001) e melhora no VEF1 vale (pré dose) em relação ao placebo e formoterol 143 mL e 85 mL, respectivamente (ambos p<0,0001). No estudo AUGMENT, Brometo de Aclidínio + Fumarato de Formoterol Di-Hidratado demonstrou melhora no VEF1 em 1 hora após a dose em relação ao placebo e aclidínio de 284 mL e 108 mL (ambos p<0,0001), respectivamente, e melhora no VEF1 no vale (pré-dose) em relação ao placebo e formoterol 130 mL (p<0,0001) e 45 mL (p=0,01), respectivamente.
Alívio de sintoma e benefícios à saúde doença-específicos
Falta de ar e outros desfechos sintomáticos
Brometo de Aclidínio + Fumarato de Formoterol Di-Hidratado proporcionou uma melhora clinicamente significativa na falta de ar (avaliada pelo Índice de Transição da Dispneia [TDI]) com uma melhora no escore focal do TDI] aos 6 meses em comparação com o placebo de 1,29 unidades no estudo ACLIFORM-COPD (p<0,0001) e de 1,44 unidades no estudo AUGMENT (p<0,0001). As porcentagens de pacientes com melhora clinicamente significativa no escore focal TDI] (definido como o aumento de pelo menos 1 unidade) foram maiores com Brometo de Aclidínio + Fumarato de Formoterol Di-Hidratado do que com o placebo no ACLIFORM-COPD (64,8% comparado com 45,5%; p<0,001) e AUGMENT (58,1% comparado com 36,6%; p<0,0001).
A análise conjunta desses dois estudos mostrou que Brometo de Aclidínio + Fumarato de Formoterol Di-Hidratado está associado com uma melhora estatisticamente significativa maior no escore focal TDI] comparado com aclidínio (0,4 unidades, p=0,016) ou formoterol (0,5 unidades, p=0,009). Uma porcentagem maior de pacientes que recebeu Brometo de Aclidínio + Fumarato de Formoterol Di-Hidratado respondeu com uma melhora clinicamente significativa no escore focal TDI] comparado com aclidínio ou formoterol (61,9% comparado com 55,7% e 57,0%, respectivamente; p=0,056 e p=0,100, respectivamente).
Brometo de Aclidínio + Fumarato de Formoterol Di-Hidratado melhorou os sintomas diários da DPOC como ‘falta de ar’, ‘sintomas torácicos’, ‘tosse e catarro’ (avaliado pelo escore total E-RS) bem como os sintomas gerais durante a noite, sintomas gerais no início da manhã e sintomas limitantes das atividades matutinas comparado com o placebo, aclidínio e formoterol, mas as melhoras nem sempre foram estatisticamente significativas. Aclidínio/formoterol não reduziu de maneira estatisticamente significativa o número médio de despertares noturnos devido à DPOC comparado com o placebo ou formoterol.
Qualidade de vida relacionada à saúde
Brometo de Aclidínio + Fumarato de Formoterol Di-Hidratado proporciona uma melhora clinicamente significativa no estado de saúde doença- específico (avaliado pelo Questionário Respiratório St. George [SGRQ]) no estudo AUGMENT, com uma melhora no escore total do SGRQ comparado ao placebo de – 4,35 unidades (p<0,0001). A porcentagem de pacientes no AUGMENT que alcançou uma melhora clinicamente significativa em relação ao basal no escore total SGRQ (definido como uma diminuição de pelo menos 4 unidades) foi maior com Brometo de Aclidínio + Fumarato de Formoterol Di-Hidratado do que com o placebo (58,2% comparado com 38,7%, respectivamente, p<0,001). No estudo ACLIFORM- COPD, foi observada apenas uma pequena redução no escore total SGRQ comparado com o placebo devido a uma resposta inesperadamente grande ao placebo (p=0,598) e as porcentagens de pacientes que atingiram melhoras clinicamente significativas em relação ao basal foram de 55,3% com Brometo de Aclidínio + Fumarato de Formoterol Di-Hidratado e 53,2% com o placebo (p=0,669).
Na análise agrupada desses dois estudos, Brometo de Aclidínio + Fumarato de Formoterol Di-Hidratado mostrou melhora superior no escore total SGRQ comparado com formoterol (-1,7 unidades; p=0,018) ou aclidínio (-0,79 unidades, p=0,273). Além disso, uma porcentagem maior de pacientes que recebeu Brometo de Aclidínio + Fumarato de Formoterol Di-Hidratado respondeu com uma melhora clinicamente significativa no escore total SGRQ comparado com o aclidínio e formoterol (56,6% comparado com 53,9% e 52,2%, respectivamente; p=0,603 e p=0,270, respectivamente).
Reduções na exacerbação da DPOC
A análise agrupada de eficácia dos dois estudos de fase III de seis meses demonstrou uma redução estatisticamente significativa de 29% na taxa de exacerbações moderadas ou graves (que precisaram de tratamento com antibióticos ou corticosteroides ou resultaram em hospitalizações) com Brometo de Aclidínio + Fumarato de Formoterol Di-Hidratado comparado com o placebo (taxas por paciente por ano: 0,29 vs. 0,42, respectivamente, p=0,036).
Além disso, Brometo de Aclidínio + Fumarato de Formoterol Di-Hidratado retardou de forma estatisticamente significativa o tempo até a primeira exacerbação moderada ou grave comparado com o placebo (razão de risco =0.70; p=0,027).
Uso de medicação de resgate
Brometo de Aclidínio + Fumarato de Formoterol Di-Hidratado reduziu o uso da medicação de resgate ao longo de 6 meses comparado com o placebo (em 0,9 puffs por dia [p<0,0001]), aclidínio (em 0,4 puffs/dia [p<0,001]) e formoterol (em 0,2 puffs/dia [p=0,062]).
Referências Bibliográficas
1 - D’Urzo 2014 (AUGMENT): D’Urzo A, Rennard S, Kerwin E et al. Efficacy and safety of fixed-dose combinations of aclidinium bromide/formoterol fumarate: the 24-week, randomized, placebo-controlled AUGMENT COPD study. Respiratory Research 2014;15:123.
2 - Singh 2014 (ACLIFORM): Singh D, Jones, PW, Bateman E. D. Efficacy and safety of aclidinium bromide/formoterol fumarate fixed-dose combinations compared with individual components and placebo in patients with COPD (ACLIFORM-COPD): a multicentre, randomised study. BMC Pulmonary Medicine 2014;14:178.
3 - Bateman 2015 (Pooled data symptoms and exacerbations): Bateman ED, et al. Aclidinium bromide and formoterol fumarate as a fixed-dose combination in COPD: pooled analysis of symptoms and exacerbations from two six-month, multicentre, randomised studies (ACLIFORM and AUGMENT). Respiratory Research 2015;16:92.
Características Farmacológicas
Propriedades Farmacodinâmicas
Grupo farmacoterapêutico: agentes contra doenças obstrutivas das vias aéreas, adrenérgicos em combinação com anticolinérgicos.
Código ATC: R03AL05.
Brometo de Aclidínio + Fumarato de Formoterol Di-Hidratado contém dois broncodilatadores: aclidínio é um antagonista muscarínico de longa ação (anticolinérgico) e o formoterol é um agonista β2-adrenérgico de longa ação. A combinação dessas duas substâncias com mecanismos de ação diferentes resulta em eficácia aditiva, comparada com o uso de cada um dos componentes isoladamente. Como consequência da densidade diferencial dos receptores muscarínicos e dos β2-adrenoceptores nas vias aéreas central e periférica do pulmão, os antagonistas muscarínicos são mais eficazes no relaxamento central das vias aéreas e os agonistas β2-adrenérgicos são mais eficazes no relaxamento das vias áreas periféricas; o relaxamento das vias aéreas central e periférica com o tratamento combinado pode contribuir para seus efeitos benéficos sobre a função pulmonar.
Efeitos farmacodinâmicos
Nos estudos clínicos, Brometo de Aclidínio + Fumarato de Formoterol Di-Hidratado demonstrou melhora clinicamente significativa na função pulmonar, VEF1, ao longo de 12 horas após a administração.
Brometo de Aclidínio + Fumarato de Formoterol Di-Hidratado demonstrou (pela VEF1) um início de ação rápido em 5 minutos a partir da primeira inalação em relação ao placebo (p<0,0001). O início da ação de Brometo de Aclidínio + Fumarato de Formoterol Di-Hidratado foi comparável ao efeito do agonista β2 de ação rápida formoterol 12 microgramas. Os efeitos broncodilatadores máximos (pico da VEF1) a partir da linha de base foram evidentes desde o primeiro dia (304 mL) e foram mantidos ao longo do período de tratamento de 6 meses (326 mL).
Eletrofisiologia cardíaca
Nenhum efeito clinicamente relevante de Brometo de Aclidínio + Fumarato de Formoterol Di-Hidratado nos parâmetros do ECG (incluindo o intervalo QT) comparado com aclidínio, formoterol e placebo foi observado nos estudos de fase III de 6 a 12 meses de duração realizados em aproximadamente 4.000 pacientes com DPOC. Nenhum efeito clinicamente significativa do Brometo de Aclidínio + Fumarato de Formoterol Di-Hidratado sobre o ritmo cardíaco foi observado na monitorização por Holter de 24 horas em um subgrupo de 551 pacientes, dos quais 114 receberam Brometo de Aclidínio + Fumarato de Formoterol Di-Hidratado duas vezes ao dia.
Propriedades Farmacocinéticas
Quando aclidínio e formoterol foram administrados em combinação por via inalatória, a farmacocinética de cada componente não mostrou diferenças relevantes em relação àquelas observadas quando os medicamentos foram administrados separadamente.
Absorção
Após inalação de uma dose única de Brometo de Aclidínio + Fumarato de Formoterol Di-Hidratado 400/12 microgramas, o aclidínio e o formoterol foram rapidamente absorvidos no plasma, atingindo picos de concentração no plasma dentro de 5 minutos da inalação em voluntários sadios e dentro de 24 minutos da inalação em pacientes com DPOC. O pico das concentrações plasmáticas de aclidínio e formoterol observadas no estado de equilíbrio em pacientes com DPOC tratados com Brometo de Aclidínio + Fumarato de Formoterol Di-Hidratado duas vezes ao dia por 5 dias foi atingido em 5 minutos pós- inalação e foi de 128 pg/mL e 17 pg/mL, respectivamente.
Distribuição
A deposição pulmonar total do aclidínio inalado via Brometo de Aclidínio + Fumarato de Formoterol Di-Hidratado foi, em média, aproximadamente 30% da dose medida. A ligação do aclidínio às proteínas plasmáticas determinada in vitro correspondeu, mais provavelmente, à ligação dos metabolitos às proteínas devido à rápida hidrólise do aclidínio no plasma. A ligação às proteínas plasmáticas foi de 87% para o metabólito ácido carboxílico e de 15% para o metabólito alcoólico. A principal proteína plasmática que se liga ao brometo de aclidínio é a albumina.
A ligação de formoterol às proteínas plasmáticas é de 61% a 64% (34% principalmente à albumina). Não há saturação dos sítios de ligação na faixa de concentração atingida com as doses terapêuticas.
Biotransformação
O aclidínio é rápida e extensivamente hidrolisado em seus respectivos derivados alcoólico e ácido carboxílico farmacologicamente inativos. Os níveis do metabolito ácido no plasma são aproximadamente 100 vezes superiores aos do metabolito alcoólico e da substância ativa inalterada após a inalação. A hidrólise ocorre tanto quimicamente (não enzimática) quanto por via enzimática pelas esterases, sendo a butirilcolinesterase a principal esterase humana envolvida na hidrólise.
A baixa biodisponibilidade absoluta do aclidínio inalado (<5%) deve-se ao fato do aclidínio sofrer extensiva hidrólise sistêmica e pré-sistêmica se depositado no pulmão ou depois de ingerido. A biotransformação através das enzimas CYP450 desempenha um papel pouco significativo na depuração metabólica total do aclidínio. Estudos in vitro revelaram que o aclidínio na dose terapêutica ou seus metabolitos não inibem ou induzem qualquer uma das enzimas do citocromo P450 (CYP450) nem inibem as esterases (carboxilesterase, acetilcolinesterase e butirilcolinesterase). Estudos in vitro mostraram que o aclidínio ou seus metabólitos não são substratos ou inibidores da glicoproteína P.
O formoterol é eliminado principalmente pelo metabolismo. A principal via envolve a glicuronidação direta, com O demetilação seguida por conjugação glicuronídea como outra via metabólica. As isoenzimas do citocromo P450 CYP2D6, CYP2C19, CYP2C9 e CYP2A6 estão envolvidas na O-demetilação do formoterol. O formoterol não inibe as enzimas da CYP450 em concentrações terapeuticamente relevantes.
Excreção
Após a inalação de Brometo de Aclidínio + Fumarato de Formoterol Di-Hidratado 400/12 microgramas, o aclidínio e o formoterol mostraram meias- vidas terminais de eliminação de aproximadamente 5 h e 8 h, respectivamente.
Após administração intravenosa de aclidínio 400 microgramas radiomarcado em voluntários sadios, aproximadamente 1% da dose foi excretada como aclidínio inalterado na urina. Até 65% da dose foi eliminada como metabólitos na urina e até 33% como metabólitos nas fezes.
Após inalação de aclidínio 200 microgramas e 400 microgramas por voluntários sadios ou pacientes com DPOC, a excreção urinária de aclidínio inalterado foi muito baixa em cerca de 0,1% da dose administrada, indicando que a depuração renal desempenha um papel secundário na depuração total de aclidínio do plasma.
A maior parte da dose de formoterol é transformada por metabolismo hepático seguida por eliminação renal. Após a inalação, 6% a 9% da dose administrada de formoterol é excretada na urina na forma a inalterada ou como conjugados diretos do formoterol.
Populações especiais
Pacientes idosos
Nenhum estudo de farmacocinética foi realizado com aclidínio/formoterol em pacientes idosos. Nenhum ajuste de dose é necessário tanto para aclidínio ou formoterol em pacientes idosos, portanto, nenhum ajuste de dose é justificado para aclidínio/formoterol em pacientes geriátricos.
Pacientes com disfunção renal e hepática
Não existem dados referentes ao uso específico de aclidínio/formoterol em pacientes com disfunção renal ou hepática. Nenhum ajuste de dose é necessário para aclidínio ou formoterol em pacientes com disfunção renal ou hepática, portanto, nenhum ajuste de dose é justificado para aclidínio/formoterol.
Dados de segurança pré-clínicos
Os dados pré-clínicos com aclidínio e formoterol não revelam riscos especiais para humanos com base nos estudos convencionais de segurança farmacológica, toxicidade de dose repetida, genotoxicidade, e potencial carcinogênico e toxicidade na reprodução e desenvolvimento.
Os efeitos do aclidínio nos estudos pré-clínicos com relação à toxicidade reprodutiva (efeitos fetotóxicos) e fertilidade (reduções discretas na taxa de concepção, números de corpos lúteos, e perdas pré e pós-implantação) foram observados somente em exposições consideradas suficientemente superiores a indicação máxima para a exposição humana e de pouca relevância para o uso clínico.
Formoterol mostrou redução da fertilidade (perdas da implantação) em ratos, assim como diminuição da sobrevida precoce pós-natal e peso ao nascimento com exposição sistêmica elevada ao formoterol. Um ligeiro aumento na incidência de leiomiomas uterinos foi observado em ratos e camundongos; um efeito que é considerado como efeito de classe em roedores após exposição prolongada a alta doses dos agonistas β2- adrenoreceptores.
Estudos pré-clínicos que investigaram os efeitos de aclidínio/formoterol nos parâmetros cardiovasculares mostraram aumento nas frequências cardíacas e arritmias em exposições consideradas suficientemente superiores a indicação máxima para a exposição humana e de pouca relevância para o uso clínico. Esses efeitos são conhecidos como resposta farmacológicas exageradas observadas com os agonistas β2.
Como devo armazenar o Duaklir Genuair?
Você deve conservar Duaklir Genuair® em temperatura ambiente (15º C a 30° C).
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Mantenha o inalador no envoltório intermediário até que o período de administração se inicie. Após aberto o envoltório, o produto é válido por 60 dias.
Aspecto Físico
Duaklir Genuair® é um inalador que contém um pó branco ou quase branco. O inalador é branco com uma tampa protetora e um botão laranja, contendo 60 doses.
Atenção: no interior do envoltório há um sachê com dessecante (sílica gel) para absorver a umidade. Perigo, não comer.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Dizeres Legais do Duaklir Genuair
Registro: 1.1013.0302.001-6
Fabricado por:
Industrias Farmacéuticas Almirall S.A.
Barcelona - Espanha
Registrado por:
Glenmark Farmacêutica Ltda.
São Paulo, SP
CNPJ n° 44.363.661/0001-57
Importado:
Glenmark Farmacêutica Ltda.
Rua Edgar Marchiori, 255
Distrito Industrial - Vinhedo, SP
CNPJ nº 44.363.661/0005-80
Venda sob prescrição.
Duaklir é uma marca registrada pela Almirall, S.A, e Genuair é uma marca registrada pelo Grupo AstraZeneca, e estão sob licença de utilização da Glenmark.
Especificações sobre o Duaklir Genuair
Caracteristicas Principais
| Fabricante: | Glenmark |
| Necessita de Receita: | Branca Comum (Venda Sob Prescrição Médica) |
| Princípio Ativo: | Brometo de Aclidínio + Fumarato de Formoterol Di-Hidratado |
| Categoria do Medicamento: | DPOC |
| Doenças Relacionadas: | Doença Pulmonar Obstrutiva Crônica (DPOC) |
| Bula do Paciente: | Bula do Duaklir Genuair |
| Bula do Profissional: | Bula do Profissional do Duaklir Genuair |
| Registro no Ministério da Saúde: | 1161802740018 |
| Código de Barras: | 7897473204447 |
| Temperatura de Armazenamento: | Temperatura ambiente |
| Produto Refrigerado: | Este produto não precisa ser refrigerado |
| Modo de Uso: | Uso inalatório |
| Pode partir: | Esta apresentação pode ser partida |
Que tal conferir outros itens? Temos outras opções que podem te interessar!