Relvar Ellipta 200mcg + 25mcg, caixa com 1 frasco com 30 doses de pó para inalação + bandeja
Selecione a variação do produto
Relvar Ellipta 200mcg + 25mcg, caixa com 1 frasco com 30 doses de pó para inalação + bandeja
- Furoato de Fluticasona + Trifenatato de Vilanterol
Branca Comum (Venda Sob Prescrição Médica)
Temperatura ambiente
Não pode ser partido
Bula do Relvar Ellipta
Relvar Ellipta, para o que é indicado e para o que serve?
Relvar® Ellipta® 100/25 mcg é utilizado para o tratamento regular da doença pulmonar obstrutiva crônica (DPOC) em adultos e da asma em adultos e adolescentes a partir de 12 anos de idade.
Relvar® Ellipta® 200/25 mcg é utilizado para o tratamento da asma em adultos e adolescentes a partir de 12 anos de idade.
A asma acontece quando os músculos ao redor das vias aéreas menores se tornam contraídos (broncoconstrição), inchados e irritados (inflamação). Os sintomas vêm e vão e incluem dificuldade de respirar, chiado, aperto no peito e tosse.
A doença pulmonar obstrutiva crônica (DPOC) acontece quando as vias aéreas se tornam inflamadas e espessas, geralmente devido tabagismo. É uma condição de longo prazo que piora lentamente. Os sintomas incluem dificuldade de respirar, tosse, desconforto no peito e tosse com muco. Foi demonstrado que Relvar® Ellipta® reduz a recidiva dos sintomas da DPOC.
Como o Relvar Ellipta funciona?
O furoato de fluticasona pertence a um grupo de medicamentos chamado corticosteroides, com frequência chamado simplesmente de esteroides. Os corticosteroides reduzem a inflamação. Eles reduzem o inchaço e irritação nas passagens de ar mais estreitas dos pulmões e assim melhoram problemas respiratórios. Os corticosteroides também ajudam a prevenir ataques de asma.
O furoato de fluticasona não deve ser confundido com outros esteroides, como os esteroides anabolizantes usados erroneamente por alguns atletas.
O vilanterol pertence a um grupo de medicamentos chamado broncodilatadores. Ele relaxa os músculos das passagens de ar nos pulmões. Isto ajuda a abrir as vias aéreas e facilita a entrada e saída de ar nos pulmões.
Quando usado regularmente, ajuda as vias aéreas a permanecerem abertas.
Quando você usar regularmente estes dois medicamentos, eles ajudarão a controlar suas dificuldades respiratórias.
Quais as contraindicações do Relvar Ellipta?
O uso de Relvar® Ellipta® é contraindicado para pacientes com alergia grave à proteína do leite e para os pacientes que tenham demonstrado hipersensibilidade ao furoato de fluticasona, ao trifenatato de vilanterol ou a qualquer componente da formulação.
Como usar o Relvar Ellipta?
Relvar® Ellipta® é indicado apenas para inalação por via oral.
Relvar® Ellipta® deve ser administrado uma vez por dia, de manhã ou à noite, no mesmo horário todos os dias.
Relvar® Ellipta® deve ser utilizado regularmente, mesmo quando assintomático.
É muito importante que você use Relvar® Ellipta® todos os dias, como instruído pelo seu médico. Isto ajudará a mantê-lo livre dos sintomas ao longo do dia e da noite.
Relvar® Ellipta® não deve ser usado para alívio de ataque súbito de falta de ar ou chiado. Se você tiver este tipo de ataque você deve usar o medicamento de resgate prescrito pelo seu médico.
Se você sentir que está ficando sem ar ou com chiado mais frequentemente do que o normal, ou se você estiver usando o seu inalador de ação rápida mais que o usual, procure seu médico.
Quando utilizar o inalador Ellipta® pela primeira vez, não é necessário verificar se esse dispositivo está funcionando corretamente e não é preciso prepará-lo especialmente para uso. Deve-se apenas seguir as instruções, passo a passo, a seguir.
O cartucho de Relvar® Ellipta® contém:
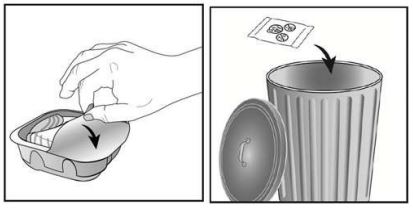
O inalador Ellipta® é fornecido em uma bandeja selada. Não abra a bandeja até que esteja pronto para inalar uma dose do medicamento. Quando estiver pronto para usar o inalador, remova a tampa da bandeja. A bandeja contém um sachê dessecante, cuja função é reduzir a umidade. Deve-se descartar esse dessecante. Não se deve ingerir nem inalar esse material.
Quando o inalador é retirado da bandeja selada, estará na posição “fechado”. Não abra o inalador até que esteja pronto para inalar uma dose do medicamento. Anote a “data de descarte” no rótulo do inalador. A data de descarte é 1 mês após a data de abertura da bandeja. Após essa data o inalador não deverá ser utilizado.
O seu inalador Ellipta® pode conter 30 ou 14 doses. As instruções para o inalador Ellipta® com 30 doses, a seguir, também se aplicam ao dispositivo com 14 doses.
Leia as instruções a seguir antes de iniciar a inalação:
Se abrir e fechar a tampa sem inalar o medicamento, você perderá a dose.
A dose perdida será mantida com segurança dentro do inalador, porém não estará mais disponível para uso.
Não é possível em uma mesma inalação ocorrer o uso de dose dupla ou dose extra.
Como preparar a dose
- A tampa só deve ser aberta quando você estiver pronto para inalar a dose. Não agite o inalador.
- Deslize a tampa completamente para baixo até você ouvir um clique.
- O medicamento está pronto para ser inalado. Para confirmar isso, o contador de doses mostrará que há uma dose a menos.
- Se o contador de doses não realizar a contagem regressiva quando você ouvir o clique, o inalador não fornecerá o medicamento. Leve o inalador para o farmacêutico para aconselhamento.
- Não agite o inalador em momento nenhum.
Como inalar o medicamento
- Sente-se ou fique de pé em posição confortável.
- Segurando o inalador longe da boca, expire (solte o ar) confortavelmente o máximo que puder. Não expire (solte o ar) sobre o inalador.
- Coloque o bocal entre seus lábios e feche-os firmemente ao redor dele.
- Não bloqueie a entrada de ar com os dedos.
- Faça uma inspiração longa, constante e profunda pela boca. Segure esta inspiração por pelo menos 3-4 segundos.
- Remova o inalador Ellipta® da boca.
- Expire lenta e suavemente.
Mesmo quando usar o inalador Ellipta® corretamente, poderá não sentir o gosto ou perceber o uso do medicamento.
Se quiser limpar o bocal, utilize um pano seco antes de fechar a tampa.
Feche o inalador
- Deslize a tampa para cima até fechar o bocal.
- Lave a boca com água sem engolir, depois de usar o inalador.
Posologia do Relvar Ellipta
Tratamento da Asma
Adultos e adolescentes com 12 anos de idade ou mais
A dosagem recomendada é de uma inalação de Relvar® Ellipta® 100/25 mcg uma vez ao dia no mesmo horário todos os dias.
Se você tem asma grave, o seu médico pode recomendar que você utilize uma inalação de Relvar® Ellipta® 200/25 mcg uma vez por dia, no mesmo horário todos os dias.
Tratamento da DPOC
Adultos maiores de 18 anos
A dosagem recomendada é de uma inalação de Relvar® Ellipta® 100/25 mcg uma vez ao dia. O Relvar® Ellipta® 200/25 mcg não é indicado para pacientes com DPOC.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Não interrompa o tratamento sem o conhecimento do seu médico.
Quais cuidados devo ter ao usar o Relvar Ellipta?
Não use Relvar® Ellipta®:
- Se você for alérgico a lactose ou à proteína do leite;
- Se você for alérgico ao furoato de fluticasona, ao trifenatato de vilanterol ou a qualquer outro ingrediente da formulação;
- Se você pensa que qualquer uma destas condições se aplica a você, não use Relvar® Ellipta® até que tenha verificado com seu médico;
- Se você foi diagnosticado com intolerância a alguns açúcares, ou a proteína do leite, fale com seu médico antes de usar Relvar® Ellipta®.
Este medicamento contém lactose.
Converse com o seu médico antes de usar Relvar® Ellipta®:
- Se você tiver doença no fígado, pois você pode ter mais chance de apresentar efeitos colaterais;
- Se você tiver problemas cardíacos ou pressão arterial alta;
- Se você tiver tuberculose pulmonar ou infecções crônicas ou não tratadas;
- Se você tiver histórico de diabetes ou tiver níveis aumentados de açúcar (glicose) no sangue.
Procure seu médico se você apresentar alguns dos sintomas a seguir, enquanto estiver utilizando Relvar® Ellipta®:
- Visão turva ou outro problema visual;
- Sensação de sede excessiva, vontade frequente de urinar ou cansaço inexplicável (sinais de altos níveis de glicose (açúcar) no sangue).
Reações alérgicas respiratórias imediatas - procure assistência médica.
Se sua respiração ou chiado piorar logo após o uso de Relvar® Ellipta®, suspenda o uso imediatamente e informe seu médico o mais rápido possível.
Infecções nos pulmões
Se você estiver utilizando Relvar® Ellipta® para tratamento da DPOC pode haver um maior risco de você desenvolver uma infecção dos pulmões conhecida como pneumonia. Veja a seção "Quais as reações adversas e os efeitos colaterais do Relvar Ellipta?" para informações sobre os sintomas a serem observados enquanto utilizar Relvar® Ellipta®. Informe o seu médico o mais rapidamente possível caso você apresente qualquer um dos sintomas.
Crianças e adolescentes
Este medicamento não deve ser utilizado por crianças menores de 12 anos no tratamento da ASMA, ou para crianças e adolescentes de qualquer idade para o tratamento da DPOC.
Gravidez e lactação
Seu médico irá considerar o benefício para você e o risco para seu bebê ao usar Relvar® Ellipta® enquanto você estiver grávida.
Se você está grávida ou pensa que pode estar grávida, não use Relvar® Ellipta® sem perguntar ao seu médico.
Não se sabe se os ingredientes de Relvar® Ellipta® podem passar para o leite materno. Se você estiver amamentando, confirme com seu médico antes de usar Relvar® Ellipta®.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Efeitos sobre a Capacidade de Dirigir e Usar Máquinas
É improvável que este medicamento afete a sua capacidade de conduzir ou utilizar máquinas.
Superdose: o que acontece se tomar uma dose do Relvar Ellipta maior do que a recomendada?
Se você acidentalmente inalar uma dose maior de Relvar® Ellipta® do que aquela que seu médico lhe instruiu, informe o seu médico o mais rapidamente possível. Você pode notar que seu coração está batendo mais rapidamente que o habitual, que você está tremendo ou que tem dor de cabeça.
Se você tem usado doses maiores do que o indicado por um longo período de tempo, é particularmente importante que você peça orientação para seu médico. Isto porque grandes doses de Relvar® Ellipta® podem reduzir a quantidade de hormônios esteroides produzidos naturalmente por seu corpo.
Não há tratamento específico para overdose com o Relvar® Ellipta®. No caso de superdose, o paciente deve receber tratamento auxiliar com monitoração adequada, se necessário. Um tratamento adicional deve ser clinicamente indicado ou conforme recomendado pelo centro nacional de intoxicação, onde disponível.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Quais as reações adversas e os efeitos colaterais do Relvar Ellipta?
Reações alérgicas
São raras as reações alérgicas após o uso de Relvar® Ellipta® (ocorrem em menos de uma a cada mil pessoas).
Se você apresentar algum dos sintomas a seguir, interrompa o uso deste medicamento e avise ao seu médico imediatamente:
- Erupções na pele (urticária) ou vermelhidão;
- Inchaço, às vezes no rosto ou boca (angioedema);
- Tornar-se muito sibilante ou respirando com chiado, com tosse ou apresentar dificuldade para respirar;
- Sentir-se fraco repentinamente ou com sensação de desmaio (pode levar a um colapso ou perda de consciência).
Dificuldade Respiratórias imediatas
Se sua respiração ou chiado ficarem piores logo após o uso de Relvar® Ellipta®, pare de usá-lo imediatamente, e avise a seu médico o mais rápido possível.
Infecção dos pulmões (pneumonia)
Avise seu médico se você tiver qualquer um dos seguintes sintomas enquanto usa Relvar® Ellipta®, pois estes podem ser sintomas de uma infecção pulmonar.
- Febre ou calafrios;
- Aumento na produção do escarro, alteração na cor do escarro;
- Aumento da tosse ou aumento da dificuldade em respirar.
Reações muito comuns (ocorre em mais de 10% dos pacientes que utilizam esse medicamento)
- Resfriado comum;
- Dor de cabeça.
Reações comuns (ocorre entre 1% e 10% dos pacientes que utilizam esse medicamento)
- Infecção dos pulmões (pneumonia);
- Placas doloridas na boca ou garganta causadas por infecção fúngica (candidíase). Enxaguar sua boca com água imediatamente após o uso de Relvar® Ellipta® pode ajudar a parar o desenvolvimento deste efeito colateral;
- Inflamação dos pulmões (bronquite);
- Infecção dos seios nasais ou garganta;
- Gripe (influenza);
- Dor e irritação na garganta;
- Inflamação dos seios da face (sinusite);
- Nariz entupido, escorrendo ou coçando;
- Tosse;
- Distúrbios da voz;
- Dor de estômago (dor abdominal);
- Dor nas costas;
- Enfraquecimento dos ossos, levando a fraturas;
- Temperatura alta (febre);
- Dor nas articulações;
- Espasmos musculares (contrações involuntárias do músculo).
Reações incomuns (ocorre entre 0,1% e 1% dos pacientes que utilizam esse medicamento)
- Batimento cardíaco irregular;
- Aumento nos níveis de açúcar no sangue (hiperglicemia).
Reações raras (ocorrem entre 0,01% e 0,1% dos pacientes que utilizam este medicamento)
- Reações alérgicas (também descritas no tópico acima);
- Batimentos cardíacos acelerados (taquicardia);
- Percepção dos batimentos cardíacos (palpitações);
- Ansiedade;
- Tremor;
- Falta de ar acompanhada de tosse incessante, chiado e dor no peito (broncoespasmo paradoxal).
Informe ao seu médico, cirurgião-dentista ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento. Informe também à empresa através do seu serviço de atendimento.
Interação medicamentosa: quais os efeitos de tomar Relvar Ellipta com outros remédios?
Informe seu médico se você está tomando, tomou recentemente ou pode vir a tomar qualquer outro medicamento. Isto inclui medicamentos obtidos sem prescrição.
Alguns medicamentos podem afetar a maneira como Relvar® Ellipta® age, ou aumentar a possibilidade de que você apresente efeitos colaterais. Entre eles o cetoconazol (para tratar infecções fúngicas), os betabloqueadores que são utilizados para tratar pressão arterial alta (ex. metoprolol), ritonavir (para tratar infecções virais) e agonista seletivo do receptor beta2 adrenérgico de longa ação (salmeterol).
Informe seu médico se você estiver tomando algum destes medicamentos.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
Qual a composição do Relvar Ellipta?
Cada dose de Relvar® Ellipta® 100 mcg/25 mcg contém:
|
Furoato de fluticasona |
100 mcg |
|
Trifenatato de vilanterol (equivalente a 25 mcg de vilanterol) |
40 mcg |
|
Excipiente q.s.p |
1 dose |
Excipiente: lactose monoidratada e estearato de magnésio.
Cada dose de Relvar® Ellipta® 200 mcg/25 mcg contém:
|
Furoato de fluticasona |
200 mcg |
|
Trifenatato de vilanterol (equivalente a 25 mcg de vilanterol) |
40 mcg |
|
Excipiente q.s.p |
1 dose |
Excipiente: lactose monoidratada e estearato de magnésio.
Como devo armazenar o Relvar Ellipta?
O produto deve ser mantido em sua embalagem original, em temperatura ambiente (entre 15ºC e 30ºC).
Após aberto, válido por 1 mês.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Aspectos físicos / Características organolépticas
O inalador plástico Ellipta® consiste de um dispositivo cinza claro, com tampa azul e contador de dose embalados em uma bandeja contendo dessecante. A bandeja é vedada com uma tampa laminada destacável.
O inalador contém duas tiras de strip com 14 ou 30 doses regularmente distribuídas, cada uma contendo pó branco.
Todo medicamento deve ser mantido fora do alcance das crianças.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Dizeres Legais do Relvar Ellipta
MS: 1.0107.0299
Farm. Resp.:
Lydia Christina Calcanho Leite
CRF-RJ Nº 16435
Fabricado por:
Glaxo Operations UK Limited.
Priory Street, Ware, Hertfordshire,
SG12 0DJ – Inglaterra
Registrado e Importado por:
GlaxoSmithKline Brasil Ltda.
Estrada dos Bandeirantes, 8464
Rio de Janeiro - RJ
CNPJ: 33.247.743/0001-10
Venda sob prescrição médica.
Apresentações do Relvar Ellipta
Relvar® é um pó para inalação por via oral composto por dois strips, sendo 1 strip com furoato de fluticasona e um strip com trifenatato de vilanterol, acondicionados em um dispositivo plástico (Ellipta®) que contém 14 ou 30 doses. O dispositivo Ellipta® é embalado em uma bandeja com tampa laminada.
- Cada inalação de Relvar® Ellipta® 100/25 mcg fornece uma dose de 92/22 mcg de furoato de fluticasona e vilanterol.
- Cada inalação de Relvar® Ellipta® 200/25 mcg fornece uma dose de 184/22 mcg de furoato de fluticasona e vilanterol.
Uso inalatório por via oral.
Uso adulto e pediátrico acima de 12 anos.
O que devo fazer quando me esquecer de usar o Relvar Ellipta?
Não tome uma dose extra para compensar uma dose perdida. Apenas tome sua próxima dose no horário habitual.
Se você ficar sem ar ou com chiado, ou desenvolver qualquer outro sintoma de ataque de asma use o seu inalador de ação rápida ou procure ajuda médica.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Especificações sobre o Relvar Ellipta
Caracteristicas Principais
| Fabricante | GSK | |
| Tipo do Medicamento | Novo | |
| Necessita de Receita | Branca Comum (Venda Sob Prescrição Médica) | |
| Princípio Ativo | Furoato de Fluticasona + Trifenatato de Vilanterol | |
| Categoria do Medicamento | DPOC | |
| Classe Terapêutica | Antiasmáticos/DPOC Agonistas B2 Associados a Corticosteróides, Inalantes | |
| Especialidades | Pneumologia | |
| Registro no Ministério da Saúde | 1010702990046 | |
| Código de Barras | 7896015528843 | |
| Temperatura de Armazenamento | Temperatura ambiente | |
| Produto Refrigerado | Este produto não precisa ser refrigerado | |
| Bula do Paciente | Bula do Relvar Ellipta | |
| Bula do Profissional | Bula do Profissional do Relvar Ellipta | |
| Modo de Uso | Uso oral | |
| Pode partir | Esta apresentação não pode ser partida | |
Sobre a GSK
A GSK é uma das líderes mundiais no desenvolvimento de medicamentos com prescrição médica, vacinas e de cuidados com a saúde.Tem o objetivo de oferecer soluções terapêuticas para melhorar a qualidade de vida das pessoas.
A GlaxoSmithKline foi fundada em 2000, como resultado da fusão entre a Glaxo Wellcome e a SmithKline Beecham. Atualmente, está presente em todos os continentes e conta com mais de 100 mil pessoas trabalhando em 115 países.
A empresa se importa com a sustentabilidade, sempre operando de maneira responsável e desenvolvendo um negócio global diversificado. Como o mercado farmacêutico muda constantemente, a GSK também se preocupa em acompanhar as inovações e oferecer o melhor para seus consumidores.
Fonte: https://br.gsk.com
Ofertas deste produto
.webp)
 Relvar Ellipta 200mcg + 25mcg, caixa com 1 frasco com 30 doses de pó para inalação + bandeja
Relvar Ellipta 200mcg + 25mcg, caixa com 1 frasco com 30 doses de pó para inalação + bandeja