Exelon 3mg, caixa com 28 cápsulas duras
- DoseQuantidade de princípio ativo por unidade, como 50mg por comprimido.
- Quantidade na embalagemNúmero de unidades do produto por embalagem.
- Forma FarmacêuticaEstado físico do medicamento, como comprimido, cápsula ou solução.
- Rivastigmina
C1 Branca 2 vias (Venda Sob Prescrição Médica - Este medicamento pode causar Dependência Física ou Psíquica)
Temperatura ambiente
Não pode ser partido
Bula do Exelon
Exelon, para o que é indicado e para o que serve?
Como o Exelon funciona?
Exelon® pertence a uma classe de substâncias conhecida como inibidores da colinesterase.
Exelon® tem como substância ativa a rivastigmina que age aumentando a quantidade de acetilcolina no cérebro, substância que é necessária para um bom funcionamento cognitivo, como por exemplo, o aprendizado, a memória, a compreensão e a orientação, bem como a habilidade do paciente de lidar com situações do cotidiano. Agindo dessa maneira, Exelon® ajuda a diminuir o declínio mental que ocorre em pacientes com a doença de Alzheimer ou com a doença de Parkinson.
Quais as contraindicações do Exelon?
Não tome Exelon®:
- Se você souber que é alérgico (hipersensível) à rivastigmina (substância ativa de Exelon®) ou a qualquer outro componente da fórmula;
- Se você já teve uma reação alérgica a algum medicamento similar a este;
- Se você já teve uma reação na pele se espalhando além do tamanho do adesivo transdérmico de Exelon®, se houver uma reação mais intensa no local (tais como bolhas, aumentando a inflamação da pele, inchaço) e se não melhorou dentro de 48 horas após a remoção do adesivo transdérmico.
Se isso aplicar a você, não use Exelon® e informe ao seu médico.
Como usar o Exelon?
Solução oral
Siga cuidadosamente todas as instruções dadas pelo seu médico. Não exceda a dose recomendada.
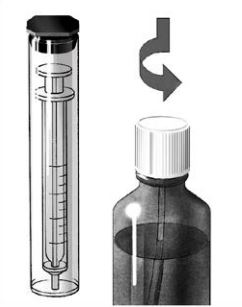
- Remova a seringa dosadora da embalagem protetora. Empurre para baixo e gire a trava resistente à crianças para abrir a frasco.
- Insira o bocal da seringa na abertura da tampa branca.
- Retire a quantidade prescrita de Exelon® solução oral do frasco.
- Antes de retirar a seringa com a dose prescrita do frasco, expulsar as bolhas grandes pressionando e puxando o êmbolo algumas vezes. A presença de algumas pequenas bolhas não tem qualquer importância e não vai afetar a dose.
- Engolir Exelon® solução oral diretamente da seringa ou primeiro misturar em um pequeno copo com água ou suco de fruta ou refrigerante. Agite e beba toda mistura imediatamente.
- Após usar, limpe a parte de fora da seringa com um tecido limpo e devolva na embalagem protetora. Feche o frasco usando a trava resistente a crianças.
Quanto tomar de Exelon®
Seu médico irá indicar a dose de Exelon® que você deverá tomar, começando com uma dose baixa e aumentando gradualmente, dependendo da sua resposta ao tratamento. A dose máxima permitida é de 6 mg duas vezes ao dia.
Quando tomar Exelon®
Você deve tomar Exelon® duas vezes ao dia, uma vez no café da manhã e outra no jantar. Tomar Exelon® no mesmo horário todos os dias o ajudará a lembrar quando tomar o medicamento.
Por quanto tempo tomar de Exelon®
Para ter os benefícios do medicamento, você deve tomá-lo todos os dias.
Informe ao seu cuidador que você está tomando Exelon®. Informe também se você não estiver tomando Exelon® por mais do que três dias.
A prescrição deste medicamento precisa de aconselhamento especializado antes do seu início e uma avaliação periódica dos benefícios terapêuticos. Seu médico também irá monitorar seu peso enquanto estiver utilizando este medicamento.
Se você tem dúvidas sobre quanto tempo deverá tomar Exelon®, fale com seu médico ou farmacêutico.
A duração do tratamento dependerá da resposta ao medicamento. Portanto, a posologia deverá ser orientada exclusivamente pelo seu médico.
Se você parar de tomar Exelon®
Não pare de tomar Exelon® ou altere a dose sem o conhecimento do seu médico. Somente o médico poderá avaliar a eficácia da terapia.
Caso você esteja há mais do que três dias sem tomar Exelon®, não tome a próxima dose sem antes conversar com o seu médico.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Não interrompa o tratamento sem o conhecimento do seu médico.
Cápsula
Siga cuidadosamente todas as instruções dadas pelo seu médico. Não exceda a dose recomendada.
Engula as cápsulas inteiras com líquido, sem abrir ou mastigar.
Quanto tomar de Exelon®
Seu médico irá indicar a dose de Exelon® que você deverá tomar, começando com uma dose baixa e aumentando gradualmente, dependendo da sua resposta ao tratamento. A dose máxima permitida é de 6 mg duas vezes ao dia.
Quando tomar Exelon®
Você deve tomar Exelon® duas vezes ao dia, uma vez no café da manhã e outra no jantar. Tomar Exelon® no mesmo horário todos os dias o ajudará a lembrar quando tomar o medicamento.
Por quanto tempo tomar de Exelon®
Para ter os benefícios do medicamento, você deve tomá-lo todos os dias.
Informe ao seu cuidador que você está tomando Exelon®. Informe também se você não estiver tomando Exelon® por mais do que três dias.
A prescrição deste medicamento precisa de aconselhamento especializado antes do seu início e uma avaliação periódica dos benefícios terapêuticos. Seu médico também irá monitorar seu peso enquanto estiver utilizando este medicamento.
Se você tem dúvidas sobre quanto tempo deverá tomar Exelon®, fale com seu médico ou farmacêutico.
A duração do tratamento dependerá da resposta ao medicamento. Portanto, a posologia deverá ser orientada exclusivamente pelo seu médico.
Se você parar de tomar Exelon®
Não pare de tomar Exelon®ou altere a dose sem o conhecimento do seu médico. Somente o médico poderá avaliar a eficácia da terapia.
Caso você esteja há mais do que três dias sem tomar Exelon®, não tome a próxima dose sem antes conversar com o seu médico.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Não interrompa o tratamento sem o conhecimento do seu médico.
Este medicamento não deve ser partido, aberto ou mastigado.
Quais cuidados devo ter ao usar o Exelon?
Tome um cuidado especial com Exelon®:
- Caso você apresente reações gastrintestinais, como náuseas (se sentir enjoado), vômitos e diarreia. Você poderá ficar desidratado (perder muito líquido) se os vômitos ou a diarreia forem prolongados;
- Se você tem ou tenha tido batimentos cardíacos irregulares (palpitação ou bradicardia), insuficiência cardíaca descompensada, infarto do miocárdio recente, baixo nível de potássio ou magnésio no sangue, histórico pessoal ou familiar de prolongamento do intervalo QT;
- Se você tem ou tenha tido úlcera gástrica ativa;
- Se você tem ou tenha tido obstrução urinária (dificuldade para urinar);
- Se você tem ou tenha tido convulsões (ataques ou crises epilépticas);
- Se você tem ou tenha tido asma ou doença respiratória grave;
- Se você sofre de tremores;
- Se você tem um baixo peso corporal (menos de 50 kg);
- Se você tem problemas nos rins e fígado.
Se algum destes itens se aplicar a você, seu médico pode precisar monitorá-lo mais proximamente durante o uso deste medicamento.
Converse com seu médico imediatamente se você tiver uma inflamação da pele, bolhas ou inchaço da pele que estão aumentando e se espalhando.
Se você passou por um período de mais do que três dias sem tomar Exelon®, não tome a próxima dose sem antes conversar com o seu médico.
Exclusivo solução oral: Um dos ingredientes da solução oral de Exelon® é o benzoato de sódio. O ácido benzoico é um irritante moderado da pele, olhos e membranas mucosas.
Pessoas idosas (com idade de 65 anos ou mais)
Exelon® pode ser usado em pacientes idosos.
Crianças e adolescentes
O uso de Exelon® em crianças e adolescentes não foi estudado e, portanto, não é recomendado.
Dirigir e operar máquinas
Seu médico irá informá-lo se a sua doença o permite dirigir veículos e operar máquinas com segurança. Exelon® pode causar tontura e sonolência, principalmente no início do tratamento e quando há aumento de dose. Portanto, você deve aguardar e certificar-se sobre os efeitos que o medicamento pode lhe causar, antes de se arriscar em tais atividades. Se sentir tonturas ou sonolência, não dirija, utilize máquinas ou realize outras tarefas que requeiram sua atenção.
Gravidez e lactação
Em caso de gravidez, os benefícios de Exelon® devem ser avaliados contra os possíveis efeitos sobre o feto. Informe ao seu médico se estiver grávida ou se planeja engravidar.
Você não deve amamentar durante o tratamento com Exelon®.
Peça orientações ao seu médico ou farmacêutico, antes de tomar qualquer medicamento durante a gravidez ou amamentação.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Superdose: o que acontece se tomar uma dose do Exelon maior do que a recomendada?
Informe ao seu médico se você tomar acidentalmente mais Exelon® do que foi indicado. Você poderá precisar de cuidados médicos.
Algumas pessoas que tomaram acidentalmente muito Exelon® tiveram náusea, vômito, diarreia, pressão alta e alucinações. Batimento cardíaco lento e desmaios também podem ocorrer.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Quais as reações adversas e os efeitos colaterais do Exelon?
Assim como com todos os medicamentos, os pacientes que tomam Exelon® podem experimentar efeitos secundários, embora nem todas as pessoas os apresentem.
Não se assuste com essa lista de possíveis efeitos adversos. Você pode não apresentar nenhum deles.
Esses efeitos tendem a ser mais frequentes quando você inicia a medicação ou passa para uma dosagem maior. As reações adversas desaparecem aos poucos, muito provavelmente porque seu corpo acostuma-se com o medicamento.
As reações adversas podem ocorrer com determinadas frequências, que são definidas como segue:
|
Muito comum |
Afeta mais de 1 em 10 pacientes |
|
Comum |
Afeta entre 1 e 10 a cada 100 pacientes |
|
Incomum |
Afeta entre 1 e 10 a cada 1.000 pacientes |
|
Rara |
Afeta entre 1 e 10 a cada 10.000 pacientes |
|
Muito rara |
Afeta menos de 1 a cada 10.000 pacientes |
|
Desconhecida |
A frequência não pode ser estimada a partir dos dados disponíveis |
Reações adversas muito comuns e comuns
- Muito comuns (ocorre em mais de 10% dos pacientes que utilizam este medicamento): se sentir enjoado (reações gastrintestinais tais como náusea), vômito, diarreia, tontura e perda de apetite;
- Comuns (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento): agitação, confusão, pesadelos, ansiedade, dor de cabeça, sonolência, dores de estômago, desconforto no estômago após as refeições, fraqueza, sensação de mal-estar, fadiga, transpiração excessiva, perda de peso e tremor. Informe ao seu médico caso estes efeitos desagradáveis persistam.
Algumas reações adversas podem ser sérias
- Incomuns (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento): depressão e desmaio;
- Raras (ocorre entre 0,01% e 0,1% dos pacientes que utilizam este medicamento): ataques ou crise epiléptica (convulsões), dor no peito, forte dor no peito (ataques cardíacos) e úlceras gástrica ou duodenal;
- Muito raras (ocorre em menos de 0,01% dos pacientes que utilizam este medicamento): alucinações, problemas com o ritmo cardíaco (batimento acelerado ou retardado), sangue na evacuação ou ao vomitar (hemorragia gastrintestinal), dor intensa na parte superior do estômago, frequentemente com náusea e vômito (inflamação do pâncreas), vômito grave que pode levar à ruptura do esôfago;
- Frequência desconhecida: perda de muito líquido (desidratação), pele amarela, amarelamento do branco dos olhos, escurecimento anormal da urina ou náuseas inexplicadas, vômitos, cansaço e perda de apetite (distúrbios hepáticos), inflamação da pele, bolhas ou inchaço da pele que estão aumentando e se espalhando, membros rígidos, mãos trêmulas (sintomas extrapiramidais).
Se você apresentar qualquer uma destas reações, pare de tomar Exelon® e procure um médico imediatamente.
Outras reações adversas
- Incomuns (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento): dificuldade para dormir, alterações nos resultados dos testes de função hepática e quedas acidentais;
- Raras (ocorre entre 0,01% e 0,1% dos pacientes que utilizam este medicamento): erupções da pele e prurido (coceira);
- Muito raras (ocorre em menos de 0,01% dos pacientes que utilizam este medicamento): pressão alta, infecção do trato urinário (dor para urinar), rigidez muscular, dificuldade em administrar movimentos (agravamento dos sintomas da doença de Parkinson ou desenvolvimento de sintomas similares);
- Frequência desconhecida: agressividade, síndrome de Stevens-Johnson e agitação.
Se você apresentar qualquer uma destas reações de forma grave, informe ao seu médico.
Informações adicionais para pacientes com doença de Parkinson
Algumas reações adversas são menos frequentes em pacientes com demência associada à doença de Parkinson
- Perda de apetite, tontura e diarreia (comum).
Algumas reações adversas são mais frequentes em pacientes com demência associada à doença de Parkinson
- Tremores, quedas acidentais (muito comum), perda de muito líquido (desidratação), dificuldade em dormir, agitação, agravamento dos sintomas da doença de Parkinson ou desenvolvimento de sintomas similares (movimentos lentos anormais, movimentos incontroláveis da boca, língua e membros, rigidez muscular, diminuição anormal dos movimentos musculares), batimento cardíaco lento, pressão arterial alta (comum), postura anormal com controle pobre de movimentos e problemas com ritmo cardíaco (rápidos e lentos) (incomum).
Algumas reações adversas adicionais em pacientes com demência associada à doença de Parkinson são:
- Salivação excessiva, modo de caminhar anormal, tontura e dor de cabeça leve devido à pressão arterial baixa (comum).
Outras reações adversas relatadas com Exelon® Patch
- Comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento): incapacidade de reter adequadamente a urina (incontinência urinária).
- Incomuns (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento): perda da coordenação, dificuldade em falar e distúrbios nos sinais do cérebro (acidente vascular cerebral), confusão grave e agitação incomum, inquietação (hiperatividade).
Adicionalmente, informe ao seu médico ou farmacêutico se você apresentar qualquer outra possível reação adversa não listada na bula.
Informe ao seu médico, cirurgião-dentista ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento. Informe também a empresa através do seu serviço de atendimento.
Interação medicamentosa: quais os efeitos de tomar Exelon com outros remédios?
Informe ao seu médico ou farmacêutico sobre qualquer outro medicamento que esteja utilizando ou que tenha utilizado recentemente, incluindo os que você comprou sem prescrição médica.
Exelon® não deve ser administrado junto com outros medicamentos com efeito similar à rivastigmina (agentes colinomiméticos) ou com medicamentos anticolinérgicos (tais como medicamentos utilizados para aliviar cólicas ou espasmos do estômago ou para evitar o enjoo em viagem).
Exelon® não deve ser administrado em conjunto com metoclopramida (um medicamento usado para aliviar ou prevenir náuseas e vômitos). Pode haver efeitos aditivos, tais como rigidez nos membros e mãos trêmulas.
Se você tiver que se submeter a uma cirurgia durante o tratamento com Exelon®, informe ao seu médico antes de receber qualquer anestesia, pois Exelon® pode exacerbar os efeitos de alguns relaxantes musculares durante a anestesia.
Cuidado quando Exelon® é administrado junto com betabloqueadores (medicamentos, tais como atenolol usado para tratar a hipertensão, angina e outros problemas cardíacos). Pode haver efeitos aditivos como bradicardia (diminuição do ritmo do coração), que pode resultar em síncope (desmaio, perda de consciência).
Deve-se ter precaução quando Exelon® é tomado juntamente com medicamentos conhecidos por induzir o prolongamento do intervalo QT e/ou torsade de pointes (incluindo, entre outros, a quinidina (medicamento usado para tratar batimentos cardíacos irregulares), amiodarona (medicamento usado para tratar batimentos cardíacos irregulares graves/fatais), pimozida (medicamento atua no sistema nervoso central), halofantrina (medicamento antimalárico), cisaprida (medicamento usado para tratar sintomas de refluxo gastroesofágico), citalopram (medicamento usado para tratar depressão), mizolastina (medicamento anti-histamínico) e medicamentos usados para tratar infecções bacterianas como moxifloxacino e eritromicina). Se algum destes casos se aplicar a você, seu médico pode precisar monitorá-lo mais proximamente durante o uso de Exelon®.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use este medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
Qual a composição do Exelon?
Cada 1 mL de Exelon® solução oral contém:
3,2 mg de hemitartarato de rivastigmina, equivalente a 2,0 mg de rivastigmina.
Excipientes: benzoato de sódio, ácido cítrico, citrato de sódio di-hidratado, corante amarelo de quinolina e água purificada.
Cada cápsula 1,5 mg de Exelon® contém:
2,4 mg de hemitartarato de rivastigmina, equivalente a 1,5 de rivastigmina.
Excipientes: gel de sílica coloidal anidra, hipromelose, estearato de magnésio, celulose microcristalina, óxido de ferro amarelo, dióxido de titânio e gelatina.
Cada cápsula 3,0 mg de Exelon® contém:
4,8 mg de hemitartarato de rivastigmina, equivalente 3,0 mg de rivastigmina.
Excipientes: gel de sílica coloidal anidra, hipromelose, estearato de magnésio, celulose microcristalina, óxido de ferro amarelo, óxido de ferro vermelho, dióxido de titânio e gelatina.
Cada cápsula 4,5 mg de Exelon® contém:
7,2 mg de hemitartarato de rivastigmina, equivalente 4,5 mg de rivastigmina.
Excipientes: gel de sílica coloidal anidra, hipromelose, estearato de magnésio, celulose microcristalina, óxido de ferro amarelo, óxido de ferro vermelho, dióxido de titânio e gelatina.
Cada cápsula 6,0 mg de Exelon® contém:
9,6 mg de hemitartarato de rivastigmina, equivalente 6,0 mg de rivastigmina.
Excipientes: gel de sílica coloidal anidra, hipromelose, estearato de magnésio, celulose microcristalina, óxido de ferro amarelo, óxido de ferro vermelho, dióxido de titânio e gelatina.
Como devo armazenar o Exelon?
O medicamento deve ser conservado em temperatura ambiente (entre 15 e 30°C).
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Exclusivo solução oral: A solução oral deve ser mantida na posição vertical e não deve ser refrigerada ou congelada.
Características físicas
Solução oral
Líquido límpido, levemente amarelado.
Cápsula
- Exelon® 1,5 mg: cápsula amarela opaca.
- Exelon® 3,0 mg: cápsula laranja opaca.
- Exelon® 4,5 mg: cápsula vermelha opaca.
- Exelon® 6,0 mg: cápsula de tampa vermelha e corpo laranja, opaca.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Dizeres Legais do Exelon
M.S – 1.2576.0034
Farm. Resp.:
Gladys Tiemi Morishita Silva
CRF-SP 48.054
Importado por:
United Medical Ltda.
Av. dos Imarés, 401, São Paulo, SP
CNPJ: 68.949.239/0001-46
Exclusivo Solução Oral:
Fabricado por:
Delpharm Huningue S.A.S
Huningue - França
Exclusivo Cápsula:
Fabricado por:
Siegfried Barbera S.L.
Barberà del Vallès - Espanha
SAC
0800-770-5180
® = Marca registrada de Novartis AG, Basileia, Suíça.
Venda sob prescrição médica.
Só pode ser vendido com retenção da receita.
Apresentações do Exelon
Solução oral 2 mg/mL
Embalagens contendo frascos de 120 mL de solução oral + 1 seringa dosadora.
Via oral.
Uso adulto.
Cápsulas 1,5 mg, 3,0 mg, 4,5 mg e 6,0 mg
Embalagens contendo 28 cápsulas gelatinosas duras.
Via oral.
Uso adulto.
O que devo fazer quando me esquecer de usar o Exelon?
Se você se esquecer de tomar uma dose de Exelon®, aguarde para tomar a próxima dose no horário usual. Não tome o dobro da dose de Exelon® para compensar a dose esquecida.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Especificações sobre o Exelon
Caracteristicas Principais
| Fabricante | United Medical | |
| Tipo do Medicamento | Novo | |
| Necessita de Receita | C1 Branca 2 vias (Venda Sob Prescrição Médica - Este medicamento pode causar Dependência Física ou Psíquica) | |
| Princípio Ativo | Rivastigmina | |
| Categoria do Medicamento | Alzheimer | |
| Classe Terapêutica | Produtos Antialzheimer, Inibidores Da Colinesterase | |
| Especialidades | Neurologia, Psiquiatria | |
| Registro no Ministério da Saúde | 1257600340041 | |
| Código de Barras | 7898054580264 | |
| Temperatura de Armazenamento | Temperatura ambiente | |
| Produto Refrigerado | Este produto não precisa ser refrigerado | |
| Bula do Paciente | Bula do Exelon | |
| Bula do Profissional | Bula do Profissional do Exelon | |
| Modo de Uso | Uso oral | |
| Pode partir | Esta apresentação não pode ser partida | |
Ofertas deste produto
.webp)
 Exelon 3mg, caixa com 28 cápsulas duras
Exelon 3mg, caixa com 28 cápsulas duras