Bula do Ticagrelor
Princípio Ativo:Ticagrelor
Ticagrelor, para o que é indicado e para o que serve?
Ticagrelor é indicado para a prevenção de eventos trombóticos (morte cardiovascular [CV], infarto do miocárdio [IM] e acidente vascular cerebral [AVC]) em pacientes com Síndrome Coronariana Aguda (SCA) (angina instável, infarto agudo do miocárdio sem elevação do segmento ST [IAMSST] ou infarto agudo do miocárdio com elevação do segmento ST [IAMCST]), incluindo pacientes tratados clinicamente, e aqueles que são tratados com intervenção coronária percutânea (ICP) ou cirurgia de revascularização do miocárdio (RM).
Quais as contraindicações do Ticagrelor?
Ticagrelor é contraindicado a pacientes com hipersensibilidade ao ticagrelor ou a qualquer componente da fórmula.
Este medicamento é contraindicado a pacientes com sangramento patológico ativo, com antecedente de hemorragia intracraniana e/ou com insuficiência hepática grave.
Como usar o Ticagrelor?
Ticagrelor deve ser administrado por via oral e pode ser ingerido com ou sem alimentos.
Os comprimidos de Ticagrelor não devem ser partidos ou mastigados.
Posologia do Ticagrelor
O tratamento de Ticagrelor deve ser iniciado com uma dose única de 180 mg (dois comprimidos de 90 mg) e então continuada com a dose de 90 mg duas vezes ao dia.
Os pacientes que estiverem utilizando Ticagrelor devem também tomar ácido acetilsalicílico diariamente a menos que especificamente contraindicado. Após uma dose inicial de ácido acetilsalicílico, Ticagrelor deve ser utilizado com uma dose de manutenção de 75-150 mg de ácido acetilsalicílico.
Lapsos durante a terapia devem ser evitados. Se o paciente esquecer-se de tomar uma dose de Ticagrelor deve tomar um comprimido de 90 mg (sua próxima dose) no horário programado.
Os médicos que desejam alterar a terapia dos pacientes de clopidogrel para Ticagrelor devem administrar a primeira dose de Ticagrelor 24 horas após a última dose do clopidogrel.
O tratamento é recomendado por pelo menos 12 meses, exceto se a interrupção do Ticagrelor for clinicamente indicada. Em pacientes com Síndrome Coronariana Aguda (SCA), a interrupção prematura com qualquer terapia antiplaquetária, incluindo Ticagrelor, poderia resultar em um aumento do risco de morte cardiovascular, infarto do miocárdio ou AVC devido à doença subjacente do paciente.
Populações Especiais
Pacientes pediátricos
A segurança e a eficácia em crianças abaixo de 18 anos de idade não foram estabelecidas.
Idosos
Não é necessário ajuste de dose.
Pacientes com insuficiência renal
Não é necessário ajuste de dose para pacientes com insuficiência renal.
Pacientes com insuficiência hepática
Não é necessário ajuste de dose para pacientes com insuficiência hepática leve. Ticagrelor não foi estudado em pacientes com insuficiência hepática moderada ou grave.
Superdose: o que acontece se tomar uma dose do Ticagrelor maior do que a recomendada?
Atualmente não há antídoto para reverter os efeitos do Ticagrelor não é dialisável. O tratamento da superdose deve seguir a prática médica local padrão.
O efeito esperado da dose excessiva de Ticagrelor é a duração prolongada do risco de sangramento associado com a inibição plaquetária. Se ocorrer sangramento, devem ser tomadas medidas de suporte apropriadas.
O ticagrelor é bem tolerado em doses únicas de até 900 mg. A toxicidade gastrointestinal foi dose-limitante em um único estudo de aumento de dose. Outros efeitos adversos significativos que podem ocorrer com a superdosagem incluem dispneia e pausas ventriculares.
Em caso de superdosagem, deve-se observar os efeitos adversos potenciais e considerar o monitoramento ECG.
Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações sobre como proceder.
Quais cuidados devo ter ao usar o Ticagrelor?
Risco de sangramento
Assim como com outros agentes antiplaquetários, o uso de Ticagrelor em pacientes com conhecido risco aumentado de sangramento deve ser balanceado em relação ao benefício em termos de prevenção de eventos trombóticos. Se clinicamente indicado, Ticagrelor deve ser utilizado com cuidado nos seguintes grupos de pacientes.
As seguintes considerações devem ser seguidas:
- Pacientes com propensão a sangrar (por exemplo, devido a um trauma recente, cirurgia recente, sangramento gastrointestinal ativo ou recente, ou insuficiência hepática moderada) ou que se encontram sob risco aumentado de trauma. O uso de Ticagrelor é contraindicado em pacientes com sangramento patológico ativo e em pacientes com antecedente de hemorragia intracraniana e insuficiência hepática grave.
- Pacientes com administração concomitante de medicamentos que podem aumentar o risco de sangramento (por exemplo, anti-inflamatórios não-esteroidais (AINEs), anticoagulantes orais e/ou fibrinolíticos dentro de 24 horas da dose de Ticagrelor).
Transfusão de plaquetas não reverteu o efeito antiplaquetário de Ticagrelor em voluntários saudáveis e é improvável que exista benefícios em pacientes com sangramento. Uma vez que a coadministração de Ticagrelor com desmopressina não diminuiu o tempo de sangramento padrão, é improvável que a desmopressina seja efetiva no manuseio clínico do sangramento.
Terapia antifibrinolítica (ácido aminocapróico ou ácido tranexâmico) e/ou fator VIIa recombinante pode aumentar a hemostasia. Ticagrelor pode ser retomado após a causa de sangramento ter sido identificada e controlada.
Cirurgia
Se um paciente necessita de cirurgia, os médicos devem considerar o perfil clínico de cada paciente, bemcomo os benefícios e riscos da terapia antiplaquetária continuada determinando quando a interrupção do tratamento de Ticagrelor deve ocorrer.
Devido à ligação reversível de Ticagrelor, a restauração da agregação plaquetária ocorre mais rapidamente com Ticagrelor comparado com o clopidogrel. No estudo OFFSET, a Inibição da Agregação Plaquetária (IAP) média para Ticagrelor em 72 horas pós-dose foi comparável à IAP média para o clopidogrel em 120 horas pós-dose. A reversão do efeito mais rápida pode predizer uma redução do risco de complicações hemorrágicas, como por exemplo, em situações nas quais a terapia antiplaquetária deve ser temporariamente interrompida devido a cirurgia ou trauma.
Nos pacientes do estudo PLATO que se submeteram a RM, Ticagrelor apresentou uma taxa similar de sangramentos maior em comparação ao clopidogrel em todos os dias da terapia com exceção do Dia 1 onde Ticagrelor teve a maior taxa de sangramento.
Se um paciente for submetido a cirurgia eletiva e efeito antiplaquetário não é desejado, Ticagrelor deve ser interrompido 5 dias antes da cirurgia.
Pacientes com insuficiência hepática moderada
É aconselhada cautela em pacientes com insuficiência hepática moderada, pois não há estudos com Ticagrelor nesses pacientes. Ticagrelor é contraindicado em pacientes com insuficiência hepática grave.
Pacientes com risco de bradiarritmia
A monitorização por Holter ECG demonstrou, na maioria das vezes, uma frequência aumentada de pausas ventriculares assintomáticas durante o tratamento com ticagrelor em comparação com o clopidogrel.
Eventos bradiarrítimicos foram relatados no cenário pós-comercialização. Nos estudos de fase 3 para avaliação da segurança e eficácia de Ticagrelor, os eventos bradiarrítimicos foram relatados em uma frequência similar para o ticagrelor e comparadores (placebo, clopidogrel e ácido acetilsalicílico).
Pacientes com um risco aumentado de eventos bradicárdicos (por exemplo, pacientes sem marcapasso que tinham síndrome do nó sinoatrial, bloqueio atrioventricular de 2º ou 3º grau ou síncope relacionada à bradicardia) foram excluídos dos estudos pivotais de Ticagrelor. Portanto, devido à experiência clínica limitada nestes pacientes, recomenda-se precaução.
Púrpura Trombocitopênica Trombótica (PTT)
A púrpura trombocitopênica trombótica foi reportada muito raramente com o uso de Ticagrelor. PTT é uma condição séria e requer tratamento imediato.
Interferência com testes laboratoriais
Testes de função plaquetária para diagnosticar trombocitopenia induzida pela heparina (TIH)
Resultados falso-negativos no teste da função plaquetária para trombocitopenia induzida por heparina (TIH) foram relatados em pacientes que receberam ticagrelor. Isso está relacionado à inibição do receptor P2Y12 nas plaquetas de doador saudável no teste com soro/plasma do paciente com ticagrelor. A informação sobre o tratamento concomitante com ticagrelor é necessária para interpretação dos testes de função plaquetária da TIH.
Antes de considerar a descontinuação do ticagrelor, o risco/benefício de continuar o tratamento deve ser avaliado, considerando tanto o estado protrombótico da TIH quanto o risco aumentado de hemorragia com tratamento concomitante com anticoagulante e ticagrelor.
Dispneia
Dispneia, geralmente de leve a moderada intensidade e frequentemente de resolução espontânea sem a necessidade de descontinuação do tratamento, foi relatada em pacientes tratados com Ticagrelor (aproximadamente 13,8%). O mecanismo ainda não foi elucidado. Se o paciente relatar nova, prolongada ou piora da dispneia deve-se fazer uma investigação completa e se não tolerado, o tratamento com Ticagrelor deve ser descontinuado.
Outros
Baseado na relação observada no estudo PLATO entre a dose de manutenção de ácido acetilsalicílico e a eficácia relativa do ticagrelor em comparação ao clopidogrel, a coadministração de ticagrelor com altas doses de ácido acetilsalicílico (>300 mg) não é recomendada.
A coadministração de Ticagrelor com potentes inibidores da CYP3A4 (por exemplo, cetoconazol, claritromicina, nefazodona, ritonavir e atazanavir) deve ser evitada visto que a coadministração pode levar a um aumento substancial de exposição ao Ticagrelor.
Descontinuações
Os pacientes que requerem a descontinuação de Ticagrelor estão em risco aumentado para eventos cardíacos ou AVC. A descontinuação prematura do tratamento deve ser evitada. Se Ticagrelor tiver que ser temporariamente interrompido devido a evento(s) adverso(s), o tratamento deve ser reiniciado assim que os benefícios superarem os riscos do evento adverso ou quando o evento adverso for resolvido.
Efeito sobre a capacidade de dirigir veículos e operar máquinas
Não foram realizados estudos sobre os efeitos de Ticagrelor sobre a capacidade de dirigir veículos e utilizar máquinas. Ticagrelor não tem influência ou é insignificante, sobre a capacidade de dirigir veículos e utilizar máquinas. Durante o tratamento da Síndrome Coronariana Aguda, tontura e confusão foram relatadas. Portanto, pacientes que apresentarem estes sintomas devem ser cautelosos enquanto estiverem dirigindo ou utilizando máquinas.
Atenção: este medicamento contém manitol (126 mg/comprimido), portanto, deve ser usado com cautela e a critério médico em pacientes portadores de diabetes.
Ticagrelor contém manitol, que pode ter um leve efeito laxativo.
Uso durante a gravidez e lactação
Categoria B.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica.
Não foi conduzido estudo clínico em mulheres grávidas ou lactantes.
Dados clínicos limitados sobre a exposição de Ticagrelor durante a gravidez estão disponíveis.
Estudos em animais não indicam efeitos prejudiciais diretos com relação a gravidez, desenvolvimento embrionário/fetal, parto ou desenvolvimento pós-natal. O ticagrelor não teve efeito na fertilidade masculina ou feminina (ver item “Dados de segurança pré-clínica”).
Como estudos de reprodução animal nem sempre são preditivos de uma resposta humana, o ticagrelor deve ser usado durante a gravidez somente se o benefício potencial para a mãe justificar qualquer risco potencial para o feto.
Não se sabe se este medicamento é excretado no leite humano. Estudos em ratos demonstraram que o ticagrelor e metabólitos ativos são excretados no leite. O uso de Ticagrelor durante a amamentação não é recomendada.
Quais as reações adversas e os efeitos colaterais do Ticagrelor?
O perfil de segurança de Ticagrelor foi avaliado em dois grandes estudos de fase 3 (PLATO e PEGASUS), incluindo mais de 39.000 pacientes. As reações adversas ao medicamento relevantes que foram observadas nestes estudos são discutidas abaixo.
A segurança de Ticagrelor em pacientes com síndrome coronariana aguda (AI, IAMSST e IAMCST) foi avaliada no estudo PLATO, que comparou os pacientes tratados com Ticagrelor (90 mg duas vezes ao dia) com pacientes tratados com clopidogrel (75 mg uma vez ao dia) ambos administrados em associação com ácido acetilsalicílico e outras terapias padrão.
A duração mediana do tratamento para Ticagrelor foi de 277 dias. No estudo PLATO, o grupo Ticagrelor teve maior incidência de descontinuação devido a eventos adversos do que o clopidogrel (7,4% versus 5,4%).
As reações adversas ao medicamento mais comumente relatadas em pacientes tratados com ticagrelor foram sangramento e dispneia.
Descrição das reações adversas ao medicamento selecionadas
Sangramento
As seguintes definições de sangramento foram utilizadas no estudo PLATO.
Maior fatal/Ameaça a vida:
Sangramento fatal ou intracraniano ou intrapericárdico com tamponamento cardíaco ou choque hipovolêmico ou hipotensão grave devido a sangramento e requerendo vasopressores ou cirurgia, ou sangramento clinicamente evidente ou aparente associado a uma diminuição na hemoglobina de mais de 50 g/L ou transfusão de 4 ou mais unidades (sangue total ou concentrado de hemácias) por sangramento.
Outros Maiores:
Significativamente debilitante (por exemplo, intraocular com perda permanente da visão), ou sangramento clinicamente evidente ou aparente associado com uma redução de hemoglobina de 30 a 50 g/L, ou transfusão de 2-3 unidades (sangue total ou concentrado de hemácias) por sangramento.
Menor:
Requer intervenção clínica para parar ou tratar o sangramento (por exemplo, epistaxe requerendo visita a estabelecimento médico para tamponamento).
Sangramento mínimo incluiu todos os outros sangramentos; estes foram coletados, mas não adjudicados.
Os sangramentos relatados no estudo PLATO também foram mapeados para a escala TIMI (Trombólise em Infarto do Miocárdio), para facilitar a comparação com outros estudos similares. O TIMI Maior é definido como sangramento clinicamente evidente associado a uma queda na hemoglobina > 50 g/L ou hemorragia intracraniana, e o critério TIMI Menor é definido como sangramento evidente associado a uma queda na hemoglobina de 30 g/L, mas < 50 g/L.
Resultados gerais de eventos hemorrágicos no estudo PLATO são mostrados na Figura 1 e Tabela 1, descritos a seguir.
Figura 1. Estimativa Kaplan Meier de tempo para o primeiro evento de sangramento ‘Maior Total’ segundo a definição do PLATO
Tabela 1. Análise de eventos de sangramento totais
|
Ticagrelor 90mg duas vezes ao dia |
Clopidogel 75mg uma vez ao dia (%) N=9186 |
Valor-p | |
| Desfecho primário de segurança Maior total |
11,6 | 11,2 | 0,4336 |
| Desfechos secundários Fatal / Ameaça a vida |
5,8 | 5,8 | 0,6988 |
| Combinado sangramento Maior total + Menor |
16,1 | 14,6 | 0,0084 |
| Não-RM Maior | 4,5 | 3,8 | 0,0264 |
| Não-Procedimento Maior | 3,1 | 2,3 | 0,0058 |
| Não-Procedimento Maior + Menor | 5,9 | 4,3 | <0,0001 |
| Categoria de sangramento definição TIMI TIMI-Maior |
7,9 | 7,7 | 0,5669 |
| TIMI-Maior + Menor | 11,4 | 10,9 | 0,3272 |
No estudo PLATO, tempo para o primeiro sangramento definido em PLATO como “Maior Total”, Ticagrelor não diferiu significativamente do clopidogrel. Houve pouco sangramento fatal no estudo, 20 (0,2%) para Ticagrelor 90 mg duas vezes ao dia e 23 (0,3%) para o clopidogrel 75 mg uma vez ao dia.
Quando o sangramento menor foi incluído, eventos de sangramento Maior e Menor definidos pelo PLATO combinados foram significativamente maiores para Ticagrelor do para o clopidogrel. As taxas globais de eventos de sangramento definido pelo TIMI não diferiram significativamente entre Ticagrelor e clopidogrel.
Sangramento relacionado a cirurgia de RM:
No estudo PLATO, 1584 pacientes (12%) foram submetidos à cirurgia de revascularização miocárdica (RM). Sangramento ‘Maior fatal/Ameaça a vida’ foi aproximadamente 42% em ambos os grupos de tratamento. Não houve diferença entre os grupos de tratamento no que diz respeito ao risco de sangramento ‘Maior fatal/Ameaça a vida’ relacionada a cirurgia em relação ao tempo da última dose antes do procedimento. Sangramento fatal relacionado à RM ocorreu raramente, 6 pacientes em cada grupo de tratamento (0,8% e 0,7% de pacientes submetidos à revascularização para Ticagrelor e clopidogrel, respectivamente).
Sangramento não-relacionado à RM:
Quando o sangramento por cirurgia de RM é removido da análise (ver Tabela 2 descrita a seguir), as taxas de sangramento absolutas para todas as categorias são menores.
Os grupos não diferiram em sangramento ‘Maior fatal/Ameaça a vida’ definido pelo PLATO não-RM, mas ‘Maior total’ definido pelo PLATO, TIMI Maior e sangramento TIMI Maior + Menor, foram mais comuns com Ticagrelor.
Tabela 2. Eventos de sangramento Maior definido no PLATO não relacionados a cirurgia de RM e eventos de sangramento definidos pelo TIMI
| Ticagrelor (%) N=9235 |
Ticagrelor (%) N=9186 |
Valor-p | |
| Categoria de sangramento definição PLATO Sangramento Maior Total |
4,5 | 3,8 | 0,0264 |
| Maior fatal/Ameaça a vida | 2,1 | 1,9 | 0,2516 |
| Categoria de sangramento definição TIMI TIMI Maior |
2,8 | 2,2 | 0,0246 |
| TIMI Maior + Menor | 4,5 | 3,6 | 0,0093 |
Sangramento não relacionado a qualquer procedimento:
Como mostrado na Tabela 1 sangramento não relacionado a procedimento, ‘Maior’ e ‘Maior + Menor’ segundo definição do PLATO foi mais freqüente com Ticagrelor. A descontinuação do tratamento devido a sangramento não relacionado a procedimento foi mais comum para Ticagrelor (2,9%) do que para o clopidogrel (1,2%; p <0,001). Sítios clinicamente importantes para sangramento 'Maior + Menor’ por ordem de freqüência foram (Ticagrelor versus clopidogrel): intracraniana (27 versus 14 eventos), pericárdico (11 versus 11), retroperitoneal (3 versus 3), intraocular (2 versus 4) e intra-articular (2 versus 1). Outros sítios comuns foram por ordem de freqüência: gastrointestinal (170 versus 135 eventos), epistaxe (116 versus 61), urinária (45 versus 37), subcutânea/cutânea (43 versus 38) e hemoptise (13 versus 7).
Não houve diferença com Ticagrelor em comparação ao clopidogrel para sangramento fatal nãorelacionado ao procedimento. Sangramento gastrointestinal ‘Maior fatal/Ameaça a vida’ foi o mesmo com Ticagrelor e clopidogrel, com eventos numericamente mais fatais para o clopidogrel (5) do que para Ticagrelor (nenhum). Houve numericamente mais sangramentos “Maior Fatal /Ameaça a vida” intracraniana não relacionados a procedimento com Ticagrelor (n=27 eventos em 26 pacientes, 0,3%) do que com o clopidogrel (n=14 eventos, 0,2%), dos quais 11 eventos de sangramento com Ticagrelor e 1 com o clopidogrel foram fatais.
Características basais, incluindo idade, sexo, peso, raça, região geográfica, antecedentes clínicos, condições simultâneas e terapia concomitante, foram avaliadas para explorar qualquer aumento no risco de sangramento com Ticagrelor. Nenhum grupo de risco particular foi identificado para qualquer subconjunto de sangramento.
Dispneia
No estudo PLATO, Eventos Adversos (EAs) de dispneia foram relatados em 13,8% dos pacientes tomando ticagrelor 90 mg duas vezes ao dia e em 7,8% dos pacientes tomando clopidogrel 75 mg uma vez ao dia.
A maior parte dos EAs de dispneia foi de intensidade leve a moderada, e, normalmente resolvida sem a necessidade de interrupção do tratamento. Dispneia foi geralmente relatada na fase inicial do tratamento e 87% dos pacientes que referiram dispneia, relataram ter apresentado um único episódio. Eventos adversos sérios de dispneia foram relatados em 0,7% dos pacientes tomando ticagrelor e em 0,4%, dos pacientes tomando clopidogrel. Os pacientes que relataram dispneia tendiam ser mais velhos e mais frequentemente apresentavam dispneia, ICC, DPOC ou asma no basal. Dados do estudo PLATO não sugerem que a maior frequência com Ticagrelor é devido ao aparecimento ou agravamento de doença cardíaca ou pulmonar.
Não havia nenhuma indicação de um efeito adverso de Ticagrelor sobre a função pulmonar.
Anormalidades Laboratoriais
No estudo PLATO, houve aumento da concentração de ácido úrico sérico maior que o limite superior da normalidade em 22% dos pacientes recebendo Ticagrelor comparado a 13% dos pacientes recebendo clopidogrel. A concentração média de ácido úrico sérico aumentou aproximadamente 15% com Ticagrelor comparado com aproximadamente 7% com clopidogrel e reduziu após o tratamento ser interrompido. Não houve diferença na freqüência de eventos adversos clínicos.
No estudo PLATO, a concentração sérica de creatinina aumentou para 50% em 8% dos pacientes que receberam Ticagrelor comparado a 7% dos pacientes que receberam clopidogrel. Os aumentos tipicamente não progrediram com o curso do tratamento e, frequentemente, diminuíram com a continuação da terapia. Sinais de reversibilidade na descontinuação foram observados mesmo naqueles com maiores aumentos durante o tratamento. Grupos de tratamento no estudo PLATO não diferiram para eventos adversos sérios relacionados.
As reações adversas ao medicamento a partir dos estudos clínicos PLATO e PEGASUS com Ticagrelor (Tabela 3) são listados pela Classe de Sistema de Órgãos MeDRA e categorias de frequência. Dentro de cada categoria de Classe de Sistema de Órgãos e frequência, as reações adversas são apresentadas por ordem decrescente de gravidade.
As categorias de frequência são definidas de acordo com os seguintes parâmetros:
Muito comum (≥ 1/10), comum (≥ 1/100 a < 1/10), incomum (≥ 1/1.000 a < 1/100), rara (≥ 1/10.000a < 1/1.000), muito rara (<1/10,000), não conhecido (não pode ser estimada a partir dos dados disponíveis).
As seguintes reações adversas foram identificadas nos estudos com Ticagrelor.
Tabela 3. Reações Adversas a Medicamentos observadas nos estudos clínicos fase 3 PLATO e PEGASUS
| Classificação por Sistema de órgãos | Muito comum (≥ 10%) |
Comum (≥ 1% e < 10%) |
Incomum (≥ 0,1% e < 1%) |
| Neoplasias benignas, malignas e não especificadas (incluindo cistos e pólipos) |
--- | --- | Hemorragias tumorais(b) |
| Distúrbios do sangue e do sistema linfático | Distúrbio hemorrágico(c) | --- | --- |
| Distúrbios do metabolismo e nutrição | Hiperuricemia(a) | Gota | --- |
| Distúrbios psiquiátricos | --- | --- | Confusão |
| Distúrbios do Sistema Nervoso | --- | Tontura, Síncope | intracraniana Hemorragia(l) |
| Distúrbios da visão | --- | --- | Hemorragia ocular(d) |
| Distúrbios do labirinto e audição | --- | Vertigem | Hemorragia auricular |
| Distúrbios vasculares | --- | Hipotensão | --- |
| Distúrbios respiratórios, torácico e do mediastino | Dispneia(b) | Hemorragia do sistema respiratório(c) | --- |
| Distúrbios gastrointestinais | --- | Hemorragia gastrointestinal (f), diarreia, náusea, vômito | Hemorragia retroperitoneal |
| Distúrbios da pele e tecido subcutâneo | --- | Sangramento dérmico ou subcutâneo (g), prurido | --- |
| Tecido conjuntivo do esqueleto muscular e osso | --- | --- | Hemorragia muscular(h) |
| Distúrbios renais e urinários | --- | Sangramento do trato urinário (i) | --- |
| Distúrbios do Sistema reprodutivo e da mama | --- | --- | Hemorragia do sistema reprodutivo(j) |
| Investigações | --- | Creatinina sanguínea aumentada (a) | --- |
| Lesão, intoxicação e complicações de procedimento | --- | Hemorragia pós procedimento, hemorragia traumática(k) | --- |
(a) Frequências derivadas das observações laboratoriais (aumento do ácido úrico para > LSN abaixo da linha de base ou no intervalo de referência e aumento de creatinina > 50% do valor basal) e não da frequência de relatos brutos de eventos adversos.
(b) por exemplo: sangramento de câncer de bexiga, câncer gástrico, câncer de cólon.
(c) por exemplo: o aumento da tendência de contusão, hematoma espontâneo, diátese hemorrágica.
(d) por exemplo: hemorragia da conjuntiva, da retina, intra-ocular.
(e) por exemplo: epistaxe, hemoptise.
(f) por exemplo: sangramento gengival, hemorragia retal, hemorragia da úlcera gástrica.
(g) por exemplo: equimose, hemorragia da pele, petéquias.
(h) por exemplo: hemartrose, hemorragia muscular.
(i) por exemplo: hematúria, cistite hemorrágica.
(j) por exemplo: hemorragia vaginal, hematospermia, hemorragia pós-menopausa.
(k) por exemplo: contusão, hematoma traumático, hemorragia traumática.
(l) isto é: hemorragia intracraniana traumática, relacionada a procedimentos ou espontânea.
Experiência pós-comercialização
As seguintes reações adversas foram identificadas no uso pós-comercialização de Ticagrelor. Uma vez que estas reações são reportadas voluntariamente por uma população de tamanho desconhecido, não é sempre possível estimar com exatidão suas frequências.
Distúrbios do sistema imune
Distúrbios do sistema imunológico; reações de hipersensibilidade, incluindo angioedema.
Distúrbios de pele e tecidos subcutâneos
Rash.
Distúrbios no sangue
Púrpura trombocitopênica trombótica.
Em caso de eventos adversos, notifique ao Sistema de Notificação de Eventos Adversos a Medicamentos - VIGIMED, disponível em http://portal.anvisa.gov.br/vigimed, ou para a Vigilância Sanitária Estadual ou Municipal.
Interação medicamentosa: quais os efeitos de tomar Ticagrelor com outros remédios?
Efeitos de outros medicamentos em Ticagrelor
Medicamentos metabolizados pela CYP3A4
- Cetoconazol (potentes inibidores da CYP3A4): a coadministração de cetoconazol com ticagrelor aumentou a Cmax e AUC de ticagrelor igual a 2,4 vezes e 7,3 vezes, respectivamente. A Cmax e AUC do metabólito ativo foram reduzidas em 89% e 56%, respectivamente. Outros potentes inibidores da CYP3A4 (claritromicina, nefazodona, ritonavir e atazanavir), devem ter efeitos similares e não devem ser administrados concomitantemente com Ticagrelor (ver item “Advertências e precauções”).
- Diltiazem (inibidores moderados da CYP3A4): a coadministração de ticagrelor e diltiazem aumentou a Cmax de ticagrelor em 69% e a AUC em 174% e diminuiu a Cmax do metabólito ativo em 38% e a AUC não foi alterada. Não houve efeito de ticagrelor nos níveis plasmáticos do diltiazem. Outros moderados inibidores da CYP3A4 (por exemplo, amprenavir, aprepitanto, eritromicina, fluconazol e verapamil) podem ser coadministrados com Ticagrelor.
- Rifampicina e outros indutores da CYP3A4: a coadministração de rifampicina com ticagrelor diminuiu a Cmax e AUC de ticagrelor em 73% e 86%, respectivamente. A Cmax do metabólito ativo foi inalterada e a AUC diminuiu em 46%, respectivamente. Outros indutores da CYP3A4 (por exemplo, fenitoína, carbamazepina e fenobarbital) devem diminuir a exposição ao ticagrelor e poderiam resultar em eficácia reduzida de Ticagrelor.
- Ciclosporina (GpP – glicoproteína P e inibidor CYP3A): a coadministração de ciclosporina (600 mg) com ticagrelor aumentou a Cmax e AUC de ticagrelor em 2,3 vezes e 2,8 vezes, respectivamente. A AUC do metabólito ativo aumentou 32% e a Cmax diminuiu 15% na presença da ciclosporina. Não houve efeito de ticagrelor nos níveis plasmáticos da ciclosporina.
- Outros: Estudos de interação de farmacologia clínica demonstraram que a coadministração de ticagrelor com heparina, enoxaparina e ácido acetilsalicílico não têm qualquer efeito sobre os níveis plasmáticos de ticagrelor ou do metabólito ativo. A coadministração de ticagrelor e heparina não teve efeito sobre a heparina baseado nos testes de Tempo de Tromboplastina Parcial ativada (TTPa) e Tempo de Coagulação Ativado (TCA). A coadministração de ticagrelor e enoxaparina não teve efeito sobre a enoxaparina com base no teste de fator Xa.
Uma exposição menor e tardia aos inibidores P2Y12 por via oral, incluindo o ticagrelor e o seu metabolito ativo, foi reportada em pacientes tratados com morfina (aproximadamente 35% de redução no ticagrelor).
Essa interação pode estar relacionada à redução da motilidade gastrintestinal, portanto, se aplica a outros opioides. A relevância clínica é desconhecida.
Efeitos de Ticagrelor em outros medicamentos
Medicamentos metabolizados pela CYP3A4
- Sinvastatina: a coadministração de ticagrelor com sinvastatina aumentou a Cmax da sinvastatina em 81% e a AUC em 56% e aumentou a Cmax em 64% e a AUC em 52% da sinvastatina ácida, com alguns aumentos individuais iguais a 2 a 3 vezes. Consideração de significância clínica deve ser dada referente a magnitude e variação de alterações na exposição a sinvastatina em pacientes que requerem mais de 40 mg de sinvastatina. Não houve efeito da sinvastatina nos níveis plasmáticos de ticagrelor. Ticagrelor pode ter efeito similar sobre a lovastatina, mas não é esperado ter um efeito clinicamente significativo sobre outras estatinas.
- Atorvastatina: a coadministração de atorvastatina e ticagrelor aumentou a Cmax da atorvastatina ácida em 23% e a AUC em 36%. Aumentos similares na AUC e Cmax foram observados para todos os metabólitos da atorvastatina ácida. Estes aumentos não são considerados clinicamente significativos.
Medicamentos metabolizados pela CYP2C9 – tolbutamida
- A coadministração de ticagrelor com a tolbutamida não resultou em alteração dos níveis plasmáticos de cada fármaco, o que sugere que ticagrelor não é um inibidor da CYP2C9 e é improvável que altere o metabolismo de fármacos mediados pela CYP2C9 como a varfarina e a tolbutamida.
- Anticoncepcionais orais: a coadministração de ticagrelor e levonorgestrel e etinilestradiol aumentou a exposição do etinilestradiol em aproximadamente 20%, mas não alterou a farmacocinética do levonorgestrel. Não é esperado efeito clinicamente relevante sobre a eficácia do contraceptivo oral quando levonorgestrel e etinilestradiol são coadministrados com Ticagrelor.
- Digoxina (substrato da GpP – glicoproteína P): a administração concomitante de ticagrelor aumentou a Cmax da digoxina em 75% e a AUC em 28%. Portanto, monitoramento laboratorial e/ou clínico adequado é recomendado quando da administração de medicamentos dependentes da GpP– glicoproteína P de índice terapêutico estreito como a digoxina concomitantemente com Ticagrelor.
- Outras terapias concomitantes: em estudos clínicos, Ticagrelor foi geralmente administrado com ácido acetilsalicílico, heparina, heparina de baixo peso molecular, inibidores da GpIIb/IIIa por via intravenosa, inibidores da bomba de prótons, estatinas, betabloqueadores, inibidores da enzima conversora da angiotensina e bloqueadores dos receptores da angiotensina, conforme a necessidade para condições concomitantes. Esses estudos não apresentaram qualquer evidência de interações adversas clinicamente significativas.
Qual a ação da substância do Ticagrelor?
Resultados de Eficácia
A eficácia de Ticagrelor é procedente do estudo PLATO (PLATelet Inhibition and Patient Outcomes), um estudo comparativo de Ticagrelor e clopidogrel, ambos administrados em combinação com ácido acetilsalicílico e outras terapias padrão.
O estudo PLATO foi um estudo randomizado, duplo-cego, de grupos paralelos, fase III, com 18.624 pacientes, que avaliou eficácia e segurança de Ticagrelor comparado com clopidogrel para prevenção de eventos vasculares em pacientes com Síndrome Coronariana Aguda (angina instável, infarto agudo do miocárdio sem elevação do segmento ST [IAMSST] ou infarto agudo do miocárdio com elevação do segmento ST [IAMCST]).
O estudo foi composto de pacientes que se apresentaram no prazo de 24 horas do início do episódio mais recente da dor no peito ou sintomas relacionados. Os pacientes foram randomizados para receber clopidogrel (75 mg uma vez ao dia, com uma dose de ataque inicial de 300 mg se a terapia com tienopiridina não houvesse sido administrada anteriormente.
Uma dose de ataque adicional de 300 mg foi permitida, a critério do investigador), ou uma dose de ataque de 180 mg de Ticagrelor seguido por uma dose de manutenção de 90 mg de Ticagrelor duas vezes ao dia. Os pacientes poderiam ser controlados clinicamente, tratados com intervenção coronária percutânea (ICP) ou cirurgia de revascularização do miocárdio (RM).
Figura. Mostra a estimativa do risco para a primeira ocorrência de qualquer evento no desfecho composto de eficácia

Ticagrelor reduziu a ocorrência do desfecho composto primário comparado ao clopidogrel em ambas as populações AI/ IAMCST e IAMSST.
Tabela. Eventos de desfecho no estudo PLATO
| Desfecho primário | Pacientes com eventos | ||||
|
Ticagrelor |
Clopidogrel (%) N=9291 |
Redução do Risco Relativo (a) (%) | Hazard Ratio (HR) (IC 95%) | valor-p | |
| Composto de morte CV/IM (excluindo IM silencioso)/AVC | 9,3 | 10,9 | 16 | 0,84 (0,77;0,92) |
p=0,0003 |
| Morte CV | 3,8 | 4,8 | 21 | 0,79 (0,69;0,91) |
p=0,0013 |
| IM (excluindo IM silencioso) (a) | 5,4 | 6,4 | 16 | 0,84 (0,75;0,95) |
p=0,0045 |
| AVC | 1,3 | 1,1 | -17 | 1,17 (0,91;1,52) |
p=0,2249 |
|
Desfechos secundários |
|||||
| Composto de morte CV/IM (excluindo IM silencioso) /AVC – intenção de tratar invasivamente(a) | 8,5 | 10,0 | 16 | 0,84 (0,75;0,94) |
p=0,0025 |
| Composto de mortalidade por todas as causas /IM (excluindo IM silencioso)/AVC | 9,7 | 11,5 | 16 | 0,84 (0,77;0,92) |
p=0,0001 |
| Composto de morte CV/IM total/AVC/IRS /IR/AIT/outros EAT(b) | 13,8 | 15,7 | 12 | 0,88 (0,81;0,95) |
p=0,0006 |
| Mortalidade por todas as causas | 4,3 | 5,4 | 22 | (0,69;0,89) 0,78 | p=0,0003** |
(a) RRR= (1-HR) x 100%. Valores com uma redução do risco relativo negativo indicam um aumento do risco relativo.
(b) IRS = isquemia recorrente severa / IR = isquemia recorrente / AIT= acidente isquêmico transitório / EAT= evento arterial trombótico.
** valor-p nominal.
Ticagrelor é superior ao clopidogrel na prevenção de eventos trombóticos (RRR 16%; RRA 1,9%; NNT =54) no desfecho composto de eficácia (morte CV, IM e AVC) em 12 meses. A diferença nos tratamentos foi determinada pela morte cardiovascular e infarto do miocárdio sem diferença nos acidentes vasculares cerebrais.
Ticagrelor demonstrou uma redução do risco relativo estatisticamente significativo de 16% (RRA 1,1%) para IM e uma redução do risco relativo de 21% (RRA 1,1%) para morte CV. Tratar 91 pacientes com Ticagrelor ao invés de clopidogrel prevenirá 1 morte CV.
Ticagrelor demonstrou superioridade em relação ao clopidogrel na prevenção do desfecho composto (morte CV, IM ou AVC). Os resultados foram precoces (redução de risco absoluto [RRA] de 0,6% e Redução do Risco Relativo [RRR] de 12% em 30 dias), com efeitos observados no tratamento mantidos durante o período de 12 meses, resultando em uma RRA de 1,9% ao ano com RRR de 16%. Isto sugere que o tratamento é apropriado por pelo menos 12 meses.
No estudo PLATO um grande número de comparações de subgrupos foram conduzidas do desfecho de eficácia primário para avaliar a robustez e consistência do benefício global. O efeito do tratamento de Ticagrelor em comparação ao clopidogrel parece consistente entre os múltiplos subgrupos de pacientes pelas características demográficas, incluindo peso, sexo, antecedentes clínicos, terapia concomitante e pelo diagnóstico final do evento (IAMSST, IAMCST e AI).
Uma fraca, mas significativa interação do tratamento foi observada por região em que o HR para o desfecho primário favorece Ticagrelor no resto do mundo, mas favorece o clopidogrel na América do Norte, que representou aproximadamente 10% do total da população estudada (valor-p da interação = 0,045).
Essa aparente interação de tratamento por região observada no PLATO pode plausivelmente ser atribuída ao acaso, pelo menos em parte. Análises adicionais sugerem que a eficácia de Ticagrelor em relação ao clopidogrel está associada à dose de ácido acetilsalicílico durante a terapia de manutenção. Os dados mostram uma maior eficácia de Ticagrelor em relação ao clopidogrel, quando utilizados em associação com uma dose baixa de ácido acetilsalicílico (75-150 mg).
A eficácia relativa de Ticagrelor versus clopidogrel, quando utilizado com altas doses de ácido acetilsalicílico (> 300 mg) é menos evidente. Baseado nessas observações da relação entre a dose de manutenção do ácido acetilsalicílico e a eficácia relativa de Ticagrelor em comparação ao clopidogrel, é recomendado que Ticagrelor seja utilizado com uma dose baixa de ácido acetilsalicílico de 75-150 mg.
Os benefícios associados com Ticagrelor também foram independentes do uso de outras terapias cardiovasculares indicadas na fase aguda e de longo-prazo, incluindo heparina, heparina de baixo peso molecular (HBPM), inibidores GpIIb/IIIa por via intravenosa, medicamentos hipolipemiantes, betabloqueadores, inibidores da enzima conversora da angiotensina (ECA), antagonistas dos receptores da angiotensina II e inibidores da bomba de prótons.
Ticagrelor demonstrou uma redução do risco relativo (RRR) estatisticamente significativa no desfecho composto de morte cardiovascular (CV), infarto do miocárdio (IM) e acidente vascular cerebral (AVC) em pacientes com SCA com intenção de tratamento invasivo (RRR 16%; RRA 1,7%; p = 0,0025). Em uma análise exploratória, Ticagrelor demonstrou uma redução do risco relativo do desfecho composto primário em pacientes com SCA com intenção de tratamento clínico (RRR 15%; RRA 2,3%; p nominal = 0,0444).
Consistente com o desfecho primário do estudo, o efeito nesses dois grupos foi determinado pela morte CV e IM, sem efeito em AVC. Em pacientes recebendo stents houve numericamente menos trombose definitiva de stent entre pacientes tratados com Ticagrelor comparado com o clopidogrel (73 versus 107; RRR 32%; RRA 0,6%; p nominal = 0,0123).
Ticagrelor demonstrou uma RRR estatisticamente significativa de 16% (RRA 2,1%) para o composto de mortalidade por todas as causas, IM e AVC comparado com o clopidogrel.
O desfecho secundário final (mortalidade por todas as causas) foi avaliado. Ticagrelor demonstrou uma RRR de 22% de mortalidade por todas as causas comparado com o clopidogrel com um nível de significância de p = 0,0003 e uma RRA de 1,4%.
Subestudo de Holter
Para estudar a ocorrência de pausas ventriculares e outros episódios arrítmicos durante o estudo PLATO, investigadores realizaram monitoramento de Holter em um subconjunto de cerca de 3.000 pacientes, dos quais aproximadamente 2.000 tinham gravações tanto na fase aguda da SCA quanto um mês depois. A principal variável de interesse foi a ocorrência de pausas ventriculares ≥ 3 segundos. Mais pacientes tiveram pausas ventriculares com Ticagrelor (6,0%) do que com o clopidogrel (3,5%) na fase aguda; e 2,2% e 1,6%, respectivamente, um mês depois. Mais pacientes tiveram pausas ventriculares com Ticagrelor que com clopidogrel, entretanto, não houve consequências clínicas adversas associadas a esta diferença (incluindo inserções de marcapasso) nesta população de pacientes.
O Ticagrelor é ativo oralmente. Diferente do clopidogrel, ele não requer a atividade enzimática da CYP450 para inibir a agregação plaquetária. Polimorfismos no gene codificador para a enzima 2C19 da CYP450 podem impactar a eficácia de clopidogrel. Polimorfismo no gene codificador para o transportador (ABCB1) da glicoproteína-P pode impactar na eficácia de ambos, clopidogrel e Ticagrelor.
No estudo PLATO, amostras genéticas de 10.285 pacientes foram analisadas para determinação do genótipo do CYP2C19 e loco ABCB1. Foram analisadas associações de grupos de genótipo em relação aos resultados de eficácia e segurança do estudo PLATO.
- A superioridade de Ticagrelor em relação ao clopidogrel não é significativamente afetada em pacientes genótipo CYP2C19.
- Ticagrelor reduz eventos CV maiores comparado ao clopidogrel independentemente do genótipo CYP2C19.
- As taxas de eventos para Ticagrelor não variaram com o genótipo CYP2C19.
- No grupo tratado com clopidogrel, portadores do alelo da CYP2C19 de perda da função tiveram um aumento das taxas de eventos de desfecho primário em comparação aos não-portadores.
- Assim como no estudo PLATO, o sangramento maior total não diferiu entre Ticagrelor e clopidogrel independentemente do genótipo CYP2C19, embora os pacientes com um ou mais alelos de ganho de função (GOF) tenham tido taxas mais altas de sangramento maior com clopidogrel.
- Assim como no estudo PLATO global, o sangramento não relacionado a procedimento cirúrgico de RM aorta-coronariana aumentou com Ticagrelor em relação ao clopidogrel em paciente com alelo da CYP2C19 de perda de função.
- Sangramento não relacionado a procedimento cirúrgico de RM aorta-coronariana foi similar entre Ticagrelor e clopidogrel em pacientes sem o alelo de perda de função.
Desfechos de eficácia e segurança combinados
Desfechos de eficácia e segurança combinados (morte CV, IM, AVC, ou sangramento “maior total” segundo a definição do PLATO) sustentam o benefício clínico do Ticagrelor comparado com o clopidogrel (RRR 8%; RRA 1,4%; HR 0,92; p = 0,0257) por mais de 12 meses após os eventos de SCA.
Características Farmacológicas
Propriedades Farmacodinâmicas
Mecanismo de ação
Ticagrelor contém Ticagrelor um membro da classe química ciclopentiltriazolopirimidinas (CPTP), que é antagonista seletivo oral, de ação direta e de ligação reversível ao receptor P2Y12 que previne a ativação e agregação plaquetária mediada por adenosina difosfato (ADP) P2Y12 dependente.
O Ticagrelor não previne a ligação do ADP, mas quando ligado ao receptor P2Y12 previne a transdução de sinal ADP induzida. Como as plaquetas participam na iniciação e/ou evolução de complicações trombóticas da doença arterosclerótica, a inibição da função plaquetária tem demonstrado redução do risco de eventos cardiovasculares como morte, infarto do miocárdio ou acidente vascular cerebral.
O Ticagrelor possui um mecanismo de ação adicional, aumentando os níveis de adenosina endógena pela inibição do transportador equilibrativo 1 de nucleosídeo (ENT-1). A adenosina é formada localmente nos pontos de hipóxia e dano tecidual, através da degradação da adenosina tri- e di-fosfato (ATP e ADP) liberada.
Como a degradação da adenosina é essencialmente restrita ao espaço intracelular, a inibição do ENT-1 pelo Ticagrelor prolonga a meia-vida da adenosina e, portanto, aumenta a sua concentração extracelular local promovendo aumento localizado das respostas à adenosina. O Ticagrelor não possui efeito significativo direto nos receptores de adenosina (A1, A2A, A2B, A3) e não é metabolizado à adenosina.
Tem sido documentado que a adenosina possui um número de efeitos que incluem: vasodilatação, cardioproteção, inibição da agregação plaquetária, modulação da inflamação e indução de dispneia, o que pode contribuir para o perfil clínico do Ticagrelor.
Efeitos farmacodinâmicos
Início da Ação
Extensão média final de Inibição (± EP*) da Agregação Plaquetária (IAP) após doses orais únicas de 180 mg de Ticagrelor ou 600 mg de clopidogrel em pacientes com Doença Arterial Coronariana (DAC) estável.

*EP: erro padrão.
Em pacientes com DAC estável em terapia com o ácido acetilsalicílico, Ticagrelor demonstra um rápido início de efeito farmacológico, como demonstrado pela média de IAP para Ticagrelor em 0,5 horas após dose de ataque de 180 mg em torno de 41%, com o efeito IAP máximo de 87,9% a 89,6% por 2-4 horas pós-dose. 90% dos pacientes tiveram um alcance final de IAP >70% por 2 horas pós-dose. O alto efeito da IAP de Ticagrelor entre 87% -89% foi mantido entre 2-8 horas.
Extensão média final de Inibição (± EP) da Agregação Plaquetária (IAP) após a última dose de manutenção de 90 mg duas vezes ao dia de Ticagrelor ou 75 mg de clopidogrel uma vez ao dia ou placebo.
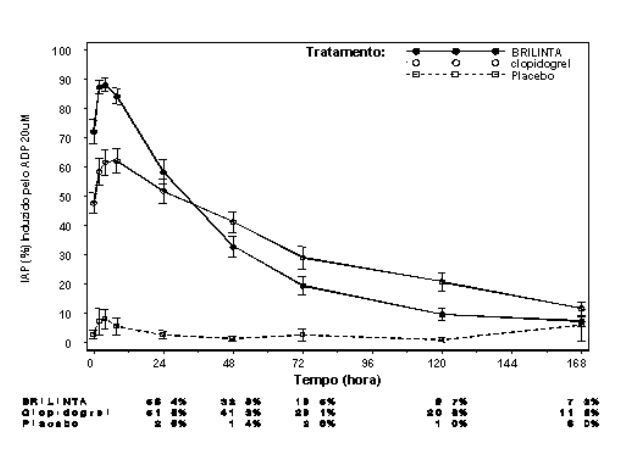
Reversão de Efeito
Após o declínio das concentrações de Ticagrelor e de seu metabólito ativo a um nível inferior ao requerido para saturação do receptor, a IAP diminui gradualmente com o declínio das concentrações plasmáticas. Uma vez que Ticagrelor se liga reversivelmente, a recuperação da função plaquetária não depende da reposição de plaquetas. Ticagrelor tem uma taxa de reversão mais rápida da IAP em comparação com o clopidogrel, conforme determinado pela inclinação de reversão de 4-72 horas após a última dose.
A extensão média final da IAP medida após a última dose de Ticagrelor é aproximadamente 20-30% maior para Ticagrelor comparado com o clopidogrel. Entretanto, por 24 horas pós-dose, a % da IAP é similar entre Ticagrelor e clopidogrel, e é menor para Ticagrelor a partir de 72 horas em até 7 dias comparado com o clopidogrel. A % média da IAP para Ticagrelor em 72 horas (Dia 3) após última dose foi comparável ao clopidogrel no Dia 5, e a % da IAP para Ticagrelor no Dia 5 foi similar ao clopidogrel no Dia 7, que não é estatisticamente diferente do placebo.
Respondedores ao Ticagrelor
A IAP induzida por Ticagrelor tem menor variabilidade nos picos de concentrações plasmáticas de Ticagrelor e seu metabólito ativo observados com a dose de 90 mg duas vezes ao dia em comparação ao clopidogrel.
Pacientes com doença arterial coronariana estável, predeterminados a terem menor resposta IAP ao clopidogrel (não-respondedores), e que receberam uma dose concomitante de ácido acetilsalicílico, exibiram maior média de resposta IAP após administração de Ticagrelor comparado ao clopidogrel. Em não-respondedores ao clopidogrel, a resposta observada de IAP ao Ticagrelor foi maior e mais consistente.
O tratamento de Ticagrelor resultou em IAP consistentemente mais elevada em comparação com o clopidogrel, e isso foi aparente após a dose para ambos os respondedores e não-respondedores.
Dados de troca
A troca de clopidogrel para Ticagrelor resulta em um aumento absoluto da IAP de 26,4% e a troca de Ticagrelor para clopidogrel resulta em uma diminuição absoluta da IAP de 24,5%. Os pacientes podem ser transferidos de clopidogrel para Ticagrelor sem a interrupção do efeito antiplaquetário.
Mecanismo da Adenosina (ENT-1)
O Ticagrelor aumenta a concentração plasmática de adenosina em pacientes SCA e tem demonstrado que amplia inúmeras respostas fisiológicas à adenosina. A adenosina é um vasodilatador; Ticagrelor demonstrou que amplia o aumento do fluxo sanguíneo coronário induzido por adenosina em voluntários saudáveis e em pacientes SCA. Adenosina é um inibidor plaquetário endógeno; Ticagrelor demonstrou que aumenta a inibição da agregação plaquetária mediada por adenosina em adição à inibição plaquetária decorrente do seu antagonismo ao P2Y12.
A adenosina está associada ao efeito cardioprotetor de pré-condicionamento; em um modelo em ratos com lesão de reperfusão, Ticagrelor demonstrou redução do tamanho do infarto através do mecanismo mediado por adenosina. A adenosina também induz dispneia; Ticagrelor demonstrou ampliação da dispneia adenosina-induzida em voluntários saudáveis. Desta maneira, a dispneia observada em alguns pacientes que utilizam Ticagrelor pode ser parcialmente ou completamente mediada por adenosina.
Propriedades Farmacocinéticas
Geral
O Ticagrelor demonstra farmacocinética linear, e a exposição ao Ticagrelor e ao metabólito ativo (ARC124910XX) são aproximadamente proporcionais à dose.
Absorção
A absorção de Ticagrelor é rápida, com uma tmax mediana de aproximadamente 1,5 horas. A formação do principal metabólito circulante AR-C124910XX (também ativo) de Ticagrelor é rápida, com uma Tmax mediana de aproximadamente 2,5 horas. A Cmáx e a AUC de Ticagrelor e do metabólito ativo aumentaram de uma maneira aproximadamente proporcional à dose por toda faixa de doses estudadas (30 - 1260 mg).
A biodisponibilidade média absoluta de Ticagrelor foi estimada em 36% (faixa de 25,4% a 64,0%). A ingestão de uma refeição rica em gordura não teve efeito sobre a Cmáx de Ticagrelor ou a AUC do metabólito ativo, mas resultou em um aumento de 21% na AUC de Ticagrelor e uma diminuição de 22% na Cmáx do metabólito ativo. Estas pequenas alterações são consideradas de mínima relevância clínica, portanto, Ticagrelor pode ser administrado com ou sem alimentos.
Distribuição
O volume de distribuição de Ticagrelor no estado de equilíbrio é 87,5 L. Ticagrelor e o metabólito ativo são extensivamente ligados às proteínas plasmáticas humanas (> 99,0%).
Metabolismo
A CYP3A é a principal enzima responsável pelo metabolismo de Ticagrelor e a formação do metabólito ativo e suas interações com outros substratos da CYP3A variam da ativação até a inibição. Ticagrelor e o metabólito ativo são fracos inibidores da glicoproteína-P.
O principal metabólito de Ticagrelor é o AR-C124910XX, que também é ativo como avaliado in vitro pela ligação ao receptor de ADP P2Y12 das plaquetas. A exposição sistêmica ao metabólito ativo é aproximadamente 30-40% do obtido por Ticagrelor.
Excreção
A principal via de eliminação de Ticagrelor é por metabolização hepática. Quando Ticagrelor marcado radioativamente é administrado, a recuperação média da radioatividade é de aproximadamente 84% (57,8% nas fezes, 26,5% na urina). Recuperações de Ticagrelor e do metabólito ativo na urina foram menor que 1% da dose. A primeira via de eliminação do metabólito ativo é principalmente através da secreção biliar. A t1/2 média foi aproximadamente 6,9 horas (faixa 4,5-12,8 horas) para Ticagrelor e 8,6 horas (faixa 6,5-12,8 horas) para o metabólito ativo.
Populações especiais
Idosos
Exposições maiores ao Ticagrelor (aproximadamente 60% para Cmáx e para AUC) e ao metabólito ativo (aproximadamente 50% para Cmáx e para AUC) foram observadas em indivíduos idosos (≥ 65 anos) em comparação com indivíduos mais jovens. Estas diferenças não são consideradas clinicamente significativas.
Pediátrico
Ticagrelor não foi avaliado em uma população pediátrica.
Sexo
Exposições maiores ao Ticagrelor (aproximadamente 52% e 37% para Cmáx e AUC, respectivamente) e ao metabólito ativo (aproximadamente 50% para Cmáx e para AUC) foram observadas em mulheres em relação aos homens. Estas diferenças não são consideradas clinicamente significativas.
Insuficiência renal
A exposição ao Ticagrelor foi aproximadamente 20% menor e a exposição ao metabólito ativo foi aproximadamente 17% maior em pacientes com insuficiência renal grave comparado a indivíduos com função renal normal. O efeito de IAP de Ticagrelor foi similar entre os dois grupos, entretanto, houve maior variabilidade observada na resposta individual em pacientes com insuficiência renal grave. Não é necessário ajuste de dose em pacientes com insuficiência renal. Não há informações disponíveis referente ao tratamento de pacientes em diálise renal.
Insuficiência hepática
A Cmáx e a AUC para Ticagrelor foram 12% e 23% maiores em pacientes com insuficiência hepática leve em comparação com indivíduos saudáveis, respectivamente, entretanto, o efeito de IAP de Ticagrelor foi similar entre os dois grupos. Não é necessário ajuste de dose em pacientes com insuficiência hepática leve. Ticagrelor não foi estudado em pacientes com insuficiência hepática moderada ou grave.
Raça
Pacientes de origem asiática têm uma biodisponibilidade média 39% mais alta em comparação com pacientes caucasianos. Pacientes autoidentificados como negros tiveram uma biodisponibilidade 18% menor de Ticagrelor comparados a pacientes caucasianos. Em estudos de farmacologia clínica, a exposição (Cmáx e AUC) de Ticagrelor em indivíduos japoneses foi aproximadamente 40% (20% após o ajuste para o peso corporal) maior comparada com a de caucasianos.
Dados de segurança pré-clínica
Dados pré-clínicos para o Ticagrelor e o principal metabólito não demonstraram risco inaceitável para efeitos adversos para humanos baseado em estudos convencionais de farmacologia de segurança, toxicidade de dose única e repetida e potencial genotóxico.
Reações adversas não observadas em estudos clínicos, mas observadas em animais com níveis de exposição similar ou superior aos níveis de exposição clínica e com possível relevância para o uso clínico foram: GI (gastrointestinais) e irritação gastrointestinal.
Não foram observados tumores relacionados ao composto em um estudo de 2 anos com camundongos em doses orais até 250 mg/kg/dia (> 18 vezes a exposição terapêutica humana). Não houve aumento nos tumores em ratos machos em doses orais até 120 mg/kg/dia (> 15 vezes a exposição terapêutica humana). Houve um aumento de adenocarcinomas uterinos e adenomas hepatocelulares mais adenocarcinomas e uma redução nos adenomas hipofisários e fibroadenomas mamários em ratas expostas somente a altas doses (> 25 vezes a exposição terapêutica humana).
Não foi observada alteração na incidência de tumores em doses de 60 mg/kg/dia (diferença > 8 vezes para a dose terapêutica humana.). Os tumores uterinos observados apenas em ratos foram achados ser o resultado de um efeito endócrino não-genotóxico do desequilíbrio hormonal presente em ratos que receberam altas doses de Ticagrelor.
Os tumores benignos do fígado são considerados secundários a resposta pelo fígado para a carga metabólica localizada no fígado a partir de doses elevadas de Ticagrelor.
O Ticagrelor foi testado em uma faixa de testes in vitro e in vivo e não foi mostrado ser genotóxico.
O Ticagrelor não demonstrou ter efeito na fertilidade de ratas fêmeas em doses orais até 200 mg/kg por dia (aproximadamente 20 vezes a exposição terapêutica humana) e não teve efeito sobre a fertilidade de ratos machos em doses até 180 mg/kg/dia (15,7 vezes a exposição terapêutica humana).
O Ticagrelor não teve efeito no desenvolvimento fetal em doses orais até 100 mg/kg por dia em ratos (5,1 vezes a exposição terapêutica humana) e até 42 mg/kg/dia em coelhos (equivalente à exposição terapêutica humana). O Ticagrelor não teve efeitos no parto ou no desenvolvimento pós-natal em ratos com doses até 60 mg/kg/dia (4,6 vezes a exposição terapêutica humana).
Qual a ação da substância do Ticagrelor?
Resultados de Eficácia
A eficácia de Ticagrelor é procedente do estudo PLATO (PLATelet Inhibition and Patient Outcomes), um estudo comparativo de Ticagrelor e clopidogrel, ambos administrados em combinação com ácido acetilsalicílico e outras terapias padrão.
O estudo PLATO foi um estudo randomizado, duplo-cego, de grupos paralelos, fase III, com 18.624 pacientes, que avaliou eficácia e segurança de Ticagrelor comparado com clopidogrel para prevenção de eventos vasculares em pacientes com Síndrome Coronariana Aguda (angina instável, infarto agudo do miocárdio sem elevação do segmento ST [IAMSST] ou infarto agudo do miocárdio com elevação do segmento ST [IAMCST]).
O estudo foi composto de pacientes que se apresentaram no prazo de 24 horas do início do episódio mais recente da dor no peito ou sintomas relacionados. Os pacientes foram randomizados para receber clopidogrel (75 mg uma vez ao dia, com uma dose de ataque inicial de 300 mg se a terapia com tienopiridina não houvesse sido administrada anteriormente.
Uma dose de ataque adicional de 300 mg foi permitida, a critério do investigador), ou uma dose de ataque de 180 mg de Ticagrelor seguido por uma dose de manutenção de 90 mg de Ticagrelor duas vezes ao dia. Os pacientes poderiam ser controlados clinicamente, tratados com intervenção coronária percutânea (ICP) ou cirurgia de revascularização do miocárdio (RM).
Figura. Mostra a estimativa do risco para a primeira ocorrência de qualquer evento no desfecho composto de eficácia

Ticagrelor reduziu a ocorrência do desfecho composto primário comparado ao clopidogrel em ambas as populações AI/ IAMCST e IAMSST.
Tabela. Eventos de desfecho no estudo PLATO
| Desfecho primário | Pacientes com eventos | ||||
|
Ticagrelor |
Clopidogrel (%) N=9291 |
Redução do Risco Relativo (a) (%) | Hazard Ratio (HR) (IC 95%) | valor-p | |
| Composto de morte CV/IM (excluindo IM silencioso)/AVC | 9,3 | 10,9 | 16 | 0,84 (0,77;0,92) |
p=0,0003 |
| Morte CV | 3,8 | 4,8 | 21 | 0,79 (0,69;0,91) |
p=0,0013 |
| IM (excluindo IM silencioso) (a) | 5,4 | 6,4 | 16 | 0,84 (0,75;0,95) |
p=0,0045 |
| AVC | 1,3 | 1,1 | -17 | 1,17 (0,91;1,52) |
p=0,2249 |
|
Desfechos secundários |
|||||
| Composto de morte CV/IM (excluindo IM silencioso) /AVC – intenção de tratar invasivamente(a) | 8,5 | 10,0 | 16 | 0,84 (0,75;0,94) |
p=0,0025 |
| Composto de mortalidade por todas as causas /IM (excluindo IM silencioso)/AVC | 9,7 | 11,5 | 16 | 0,84 (0,77;0,92) |
p=0,0001 |
| Composto de morte CV/IM total/AVC/IRS /IR/AIT/outros EAT(b) | 13,8 | 15,7 | 12 | 0,88 (0,81;0,95) |
p=0,0006 |
| Mortalidade por todas as causas | 4,3 | 5,4 | 22 | (0,69;0,89) 0,78 | p=0,0003** |
(a) RRR= (1-HR) x 100%. Valores com uma redução do risco relativo negativo indicam um aumento do risco relativo.
(b) IRS = isquemia recorrente severa / IR = isquemia recorrente / AIT= acidente isquêmico transitório / EAT= evento arterial trombótico.
** valor-p nominal.
Ticagrelor é superior ao clopidogrel na prevenção de eventos trombóticos (RRR 16%; RRA 1,9%; NNT =54) no desfecho composto de eficácia (morte CV, IM e AVC) em 12 meses. A diferença nos tratamentos foi determinada pela morte cardiovascular e infarto do miocárdio sem diferença nos acidentes vasculares cerebrais.
Ticagrelor demonstrou uma redução do risco relativo estatisticamente significativo de 16% (RRA 1,1%) para IM e uma redução do risco relativo de 21% (RRA 1,1%) para morte CV. Tratar 91 pacientes com Ticagrelor ao invés de clopidogrel prevenirá 1 morte CV.
Ticagrelor demonstrou superioridade em relação ao clopidogrel na prevenção do desfecho composto (morte CV, IM ou AVC). Os resultados foram precoces (redução de risco absoluto [RRA] de 0,6% e Redução do Risco Relativo [RRR] de 12% em 30 dias), com efeitos observados no tratamento mantidos durante o período de 12 meses, resultando em uma RRA de 1,9% ao ano com RRR de 16%. Isto sugere que o tratamento é apropriado por pelo menos 12 meses.
No estudo PLATO um grande número de comparações de subgrupos foram conduzidas do desfecho de eficácia primário para avaliar a robustez e consistência do benefício global. O efeito do tratamento de Ticagrelor em comparação ao clopidogrel parece consistente entre os múltiplos subgrupos de pacientes pelas características demográficas, incluindo peso, sexo, antecedentes clínicos, terapia concomitante e pelo diagnóstico final do evento (IAMSST, IAMCST e AI).
Uma fraca, mas significativa interação do tratamento foi observada por região em que o HR para o desfecho primário favorece Ticagrelor no resto do mundo, mas favorece o clopidogrel na América do Norte, que representou aproximadamente 10% do total da população estudada (valor-p da interação = 0,045).
Essa aparente interação de tratamento por região observada no PLATO pode plausivelmente ser atribuída ao acaso, pelo menos em parte. Análises adicionais sugerem que a eficácia de Ticagrelor em relação ao clopidogrel está associada à dose de ácido acetilsalicílico durante a terapia de manutenção. Os dados mostram uma maior eficácia de Ticagrelor em relação ao clopidogrel, quando utilizados em associação com uma dose baixa de ácido acetilsalicílico (75-150 mg).
A eficácia relativa de Ticagrelor versus clopidogrel, quando utilizado com altas doses de ácido acetilsalicílico (> 300 mg) é menos evidente. Baseado nessas observações da relação entre a dose de manutenção do ácido acetilsalicílico e a eficácia relativa de Ticagrelor em comparação ao clopidogrel, é recomendado que Ticagrelor seja utilizado com uma dose baixa de ácido acetilsalicílico de 75-150 mg.
Os benefícios associados com Ticagrelor também foram independentes do uso de outras terapias cardiovasculares indicadas na fase aguda e de longo-prazo, incluindo heparina, heparina de baixo peso molecular (HBPM), inibidores GpIIb/IIIa por via intravenosa, medicamentos hipolipemiantes, betabloqueadores, inibidores da enzima conversora da angiotensina (ECA), antagonistas dos receptores da angiotensina II e inibidores da bomba de prótons.
Ticagrelor demonstrou uma redução do risco relativo (RRR) estatisticamente significativa no desfecho composto de morte cardiovascular (CV), infarto do miocárdio (IM) e acidente vascular cerebral (AVC) em pacientes com SCA com intenção de tratamento invasivo (RRR 16%; RRA 1,7%; p = 0,0025). Em uma análise exploratória, Ticagrelor demonstrou uma redução do risco relativo do desfecho composto primário em pacientes com SCA com intenção de tratamento clínico (RRR 15%; RRA 2,3%; p nominal = 0,0444).
Consistente com o desfecho primário do estudo, o efeito nesses dois grupos foi determinado pela morte CV e IM, sem efeito em AVC. Em pacientes recebendo stents houve numericamente menos trombose definitiva de stent entre pacientes tratados com Ticagrelor comparado com o clopidogrel (73 versus 107; RRR 32%; RRA 0,6%; p nominal = 0,0123).
Ticagrelor demonstrou uma RRR estatisticamente significativa de 16% (RRA 2,1%) para o composto de mortalidade por todas as causas, IM e AVC comparado com o clopidogrel.
O desfecho secundário final (mortalidade por todas as causas) foi avaliado. Ticagrelor demonstrou uma RRR de 22% de mortalidade por todas as causas comparado com o clopidogrel com um nível de significância de p = 0,0003 e uma RRA de 1,4%.
Subestudo de Holter
Para estudar a ocorrência de pausas ventriculares e outros episódios arrítmicos durante o estudo PLATO, investigadores realizaram monitoramento de Holter em um subconjunto de cerca de 3.000 pacientes, dos quais aproximadamente 2.000 tinham gravações tanto na fase aguda da SCA quanto um mês depois. A principal variável de interesse foi a ocorrência de pausas ventriculares ≥ 3 segundos. Mais pacientes tiveram pausas ventriculares com Ticagrelor (6,0%) do que com o clopidogrel (3,5%) na fase aguda; e 2,2% e 1,6%, respectivamente, um mês depois. Mais pacientes tiveram pausas ventriculares com Ticagrelor que com clopidogrel, entretanto, não houve consequências clínicas adversas associadas a esta diferença (incluindo inserções de marcapasso) nesta população de pacientes.
O Ticagrelor é ativo oralmente. Diferente do clopidogrel, ele não requer a atividade enzimática da CYP450 para inibir a agregação plaquetária. Polimorfismos no gene codificador para a enzima 2C19 da CYP450 podem impactar a eficácia de clopidogrel. Polimorfismo no gene codificador para o transportador (ABCB1) da glicoproteína-P pode impactar na eficácia de ambos, clopidogrel e Ticagrelor.
No estudo PLATO, amostras genéticas de 10.285 pacientes foram analisadas para determinação do genótipo do CYP2C19 e loco ABCB1. Foram analisadas associações de grupos de genótipo em relação aos resultados de eficácia e segurança do estudo PLATO.
- A superioridade de Ticagrelor em relação ao clopidogrel não é significativamente afetada em pacientes genótipo CYP2C19.
- Ticagrelor reduz eventos CV maiores comparado ao clopidogrel independentemente do genótipo CYP2C19.
- As taxas de eventos para Ticagrelor não variaram com o genótipo CYP2C19.
- No grupo tratado com clopidogrel, portadores do alelo da CYP2C19 de perda da função tiveram um aumento das taxas de eventos de desfecho primário em comparação aos não-portadores.
- Assim como no estudo PLATO, o sangramento maior total não diferiu entre Ticagrelor e clopidogrel independentemente do genótipo CYP2C19, embora os pacientes com um ou mais alelos de ganho de função (GOF) tenham tido taxas mais altas de sangramento maior com clopidogrel.
- Assim como no estudo PLATO global, o sangramento não relacionado a procedimento cirúrgico de RM aorta-coronariana aumentou com Ticagrelor em relação ao clopidogrel em paciente com alelo da CYP2C19 de perda de função.
- Sangramento não relacionado a procedimento cirúrgico de RM aorta-coronariana foi similar entre Ticagrelor e clopidogrel em pacientes sem o alelo de perda de função.
Desfechos de eficácia e segurança combinados
Desfechos de eficácia e segurança combinados (morte CV, IM, AVC, ou sangramento “maior total” segundo a definição do PLATO) sustentam o benefício clínico do Ticagrelor comparado com o clopidogrel (RRR 8%; RRA 1,4%; HR 0,92; p = 0,0257) por mais de 12 meses após os eventos de SCA.
Características Farmacológicas
Propriedades Farmacodinâmicas
Mecanismo de ação
Ticagrelor contém Ticagrelor um membro da classe química ciclopentiltriazolopirimidinas (CPTP), que é antagonista seletivo oral, de ação direta e de ligação reversível ao receptor P2Y12 que previne a ativação e agregação plaquetária mediada por adenosina difosfato (ADP) P2Y12 dependente.
O Ticagrelor não previne a ligação do ADP, mas quando ligado ao receptor P2Y12 previne a transdução de sinal ADP induzida. Como as plaquetas participam na iniciação e/ou evolução de complicações trombóticas da doença arterosclerótica, a inibição da função plaquetária tem demonstrado redução do risco de eventos cardiovasculares como morte, infarto do miocárdio ou acidente vascular cerebral.
O Ticagrelor possui um mecanismo de ação adicional, aumentando os níveis de adenosina endógena pela inibição do transportador equilibrativo 1 de nucleosídeo (ENT-1). A adenosina é formada localmente nos pontos de hipóxia e dano tecidual, através da degradação da adenosina tri- e di-fosfato (ATP e ADP) liberada.
Como a degradação da adenosina é essencialmente restrita ao espaço intracelular, a inibição do ENT-1 pelo Ticagrelor prolonga a meia-vida da adenosina e, portanto, aumenta a sua concentração extracelular local promovendo aumento localizado das respostas à adenosina. O Ticagrelor não possui efeito significativo direto nos receptores de adenosina (A1, A2A, A2B, A3) e não é metabolizado à adenosina.
Tem sido documentado que a adenosina possui um número de efeitos que incluem: vasodilatação, cardioproteção, inibição da agregação plaquetária, modulação da inflamação e indução de dispneia, o que pode contribuir para o perfil clínico do Ticagrelor.
Efeitos farmacodinâmicos
Início da Ação
Extensão média final de Inibição (± EP*) da Agregação Plaquetária (IAP) após doses orais únicas de 180 mg de Ticagrelor ou 600 mg de clopidogrel em pacientes com Doença Arterial Coronariana (DAC) estável.

*EP: erro padrão.
Em pacientes com DAC estável em terapia com o ácido acetilsalicílico, Ticagrelor demonstra um rápido início de efeito farmacológico, como demonstrado pela média de IAP para Ticagrelor em 0,5 horas após dose de ataque de 180 mg em torno de 41%, com o efeito IAP máximo de 87,9% a 89,6% por 2-4 horas pós-dose. 90% dos pacientes tiveram um alcance final de IAP >70% por 2 horas pós-dose. O alto efeito da IAP de Ticagrelor entre 87% -89% foi mantido entre 2-8 horas.
Extensão média final de Inibição (± EP) da Agregação Plaquetária (IAP) após a última dose de manutenção de 90 mg duas vezes ao dia de Ticagrelor ou 75 mg de clopidogrel uma vez ao dia ou placebo.

Reversão de Efeito
Após o declínio das concentrações de Ticagrelor e de seu metabólito ativo a um nível inferior ao requerido para saturação do receptor, a IAP diminui gradualmente com o declínio das concentrações plasmáticas. Uma vez que Ticagrelor se liga reversivelmente, a recuperação da função plaquetária não depende da reposição de plaquetas. Ticagrelor tem uma taxa de reversão mais rápida da IAP em comparação com o clopidogrel, conforme determinado pela inclinação de reversão de 4-72 horas após a última dose.
A extensão média final da IAP medida após a última dose de Ticagrelor é aproximadamente 20-30% maior para Ticagrelor comparado com o clopidogrel. Entretanto, por 24 horas pós-dose, a % da IAP é similar entre Ticagrelor e clopidogrel, e é menor para Ticagrelor a partir de 72 horas em até 7 dias comparado com o clopidogrel. A % média da IAP para Ticagrelor em 72 horas (Dia 3) após última dose foi comparável ao clopidogrel no Dia 5, e a % da IAP para Ticagrelor no Dia 5 foi similar ao clopidogrel no Dia 7, que não é estatisticamente diferente do placebo.
Respondedores ao Ticagrelor
A IAP induzida por Ticagrelor tem menor variabilidade nos picos de concentrações plasmáticas de Ticagrelor e seu metabólito ativo observados com a dose de 90 mg duas vezes ao dia em comparação ao clopidogrel.
Pacientes com doença arterial coronariana estável, predeterminados a terem menor resposta IAP ao clopidogrel (não-respondedores), e que receberam uma dose concomitante de ácido acetilsalicílico, exibiram maior média de resposta IAP após administração de Ticagrelor comparado ao clopidogrel. Em não-respondedores ao clopidogrel, a resposta observada de IAP ao Ticagrelor foi maior e mais consistente.
O tratamento de Ticagrelor resultou em IAP consistentemente mais elevada em comparação com o clopidogrel, e isso foi aparente após a dose para ambos os respondedores e não-respondedores.
Dados de troca
A troca de clopidogrel para Ticagrelor resulta em um aumento absoluto da IAP de 26,4% e a troca de Ticagrelor para clopidogrel resulta em uma diminuição absoluta da IAP de 24,5%. Os pacientes podem ser transferidos de clopidogrel para Ticagrelor sem a interrupção do efeito antiplaquetário.
Mecanismo da Adenosina (ENT-1)
O Ticagrelor aumenta a concentração plasmática de adenosina em pacientes SCA e tem demonstrado que amplia inúmeras respostas fisiológicas à adenosina. A adenosina é um vasodilatador; Ticagrelor demonstrou que amplia o aumento do fluxo sanguíneo coronário induzido por adenosina em voluntários saudáveis e em pacientes SCA. Adenosina é um inibidor plaquetário endógeno; Ticagrelor demonstrou que aumenta a inibição da agregação plaquetária mediada por adenosina em adição à inibição plaquetária decorrente do seu antagonismo ao P2Y12.
A adenosina está associada ao efeito cardioprotetor de pré-condicionamento; em um modelo em ratos com lesão de reperfusão, Ticagrelor demonstrou redução do tamanho do infarto através do mecanismo mediado por adenosina. A adenosina também induz dispneia; Ticagrelor demonstrou ampliação da dispneia adenosina-induzida em voluntários saudáveis. Desta maneira, a dispneia observada em alguns pacientes que utilizam Ticagrelor pode ser parcialmente ou completamente mediada por adenosina.
Propriedades Farmacocinéticas
Geral
O Ticagrelor demonstra farmacocinética linear, e a exposição ao Ticagrelor e ao metabólito ativo (ARC124910XX) são aproximadamente proporcionais à dose.
Absorção
A absorção de Ticagrelor é rápida, com uma tmax mediana de aproximadamente 1,5 horas. A formação do principal metabólito circulante AR-C124910XX (também ativo) de Ticagrelor é rápida, com uma Tmax mediana de aproximadamente 2,5 horas. A Cmáx e a AUC de Ticagrelor e do metabólito ativo aumentaram de uma maneira aproximadamente proporcional à dose por toda faixa de doses estudadas (30 - 1260 mg).
A biodisponibilidade média absoluta de Ticagrelor foi estimada em 36% (faixa de 25,4% a 64,0%). A ingestão de uma refeição rica em gordura não teve efeito sobre a Cmáx de Ticagrelor ou a AUC do metabólito ativo, mas resultou em um aumento de 21% na AUC de Ticagrelor e uma diminuição de 22% na Cmáx do metabólito ativo. Estas pequenas alterações são consideradas de mínima relevância clínica, portanto, Ticagrelor pode ser administrado com ou sem alimentos.
Distribuição
O volume de distribuição de Ticagrelor no estado de equilíbrio é 87,5 L. Ticagrelor e o metabólito ativo são extensivamente ligados às proteínas plasmáticas humanas (> 99,0%).
Metabolismo
A CYP3A é a principal enzima responsável pelo metabolismo de Ticagrelor e a formação do metabólito ativo e suas interações com outros substratos da CYP3A variam da ativação até a inibição. Ticagrelor e o metabólito ativo são fracos inibidores da glicoproteína-P.
O principal metabólito de Ticagrelor é o AR-C124910XX, que também é ativo como avaliado in vitro pela ligação ao receptor de ADP P2Y12 das plaquetas. A exposição sistêmica ao metabólito ativo é aproximadamente 30-40% do obtido por Ticagrelor.
Excreção
A principal via de eliminação de Ticagrelor é por metabolização hepática. Quando Ticagrelor marcado radioativamente é administrado, a recuperação média da radioatividade é de aproximadamente 84% (57,8% nas fezes, 26,5% na urina). Recuperações de Ticagrelor e do metabólito ativo na urina foram menor que 1% da dose. A primeira via de eliminação do metabólito ativo é principalmente através da secreção biliar. A t1/2 média foi aproximadamente 6,9 horas (faixa 4,5-12,8 horas) para Ticagrelor e 8,6 horas (faixa 6,5-12,8 horas) para o metabólito ativo.
Populações especiais
Idosos
Exposições maiores ao Ticagrelor (aproximadamente 60% para Cmáx e para AUC) e ao metabólito ativo (aproximadamente 50% para Cmáx e para AUC) foram observadas em indivíduos idosos (≥ 65 anos) em comparação com indivíduos mais jovens. Estas diferenças não são consideradas clinicamente significativas.
Pediátrico
Ticagrelor não foi avaliado em uma população pediátrica.
Sexo
Exposições maiores ao Ticagrelor (aproximadamente 52% e 37% para Cmáx e AUC, respectivamente) e ao metabólito ativo (aproximadamente 50% para Cmáx e para AUC) foram observadas em mulheres em relação aos homens. Estas diferenças não são consideradas clinicamente significativas.
Insuficiência renal
A exposição ao Ticagrelor foi aproximadamente 20% menor e a exposição ao metabólito ativo foi aproximadamente 17% maior em pacientes com insuficiência renal grave comparado a indivíduos com função renal normal. O efeito de IAP de Ticagrelor foi similar entre os dois grupos, entretanto, houve maior variabilidade observada na resposta individual em pacientes com insuficiência renal grave. Não é necessário ajuste de dose em pacientes com insuficiência renal. Não há informações disponíveis referente ao tratamento de pacientes em diálise renal.
Insuficiência hepática
A Cmáx e a AUC para Ticagrelor foram 12% e 23% maiores em pacientes com insuficiência hepática leve em comparação com indivíduos saudáveis, respectivamente, entretanto, o efeito de IAP de Ticagrelor foi similar entre os dois grupos. Não é necessário ajuste de dose em pacientes com insuficiência hepática leve. Ticagrelor não foi estudado em pacientes com insuficiência hepática moderada ou grave.
Raça
Pacientes de origem asiática têm uma biodisponibilidade média 39% mais alta em comparação com pacientes caucasianos. Pacientes autoidentificados como negros tiveram uma biodisponibilidade 18% menor de Ticagrelor comparados a pacientes caucasianos. Em estudos de farmacologia clínica, a exposição (Cmáx e AUC) de Ticagrelor em indivíduos japoneses foi aproximadamente 40% (20% após o ajuste para o peso corporal) maior comparada com a de caucasianos.
Dados de segurança pré-clínica
Dados pré-clínicos para o Ticagrelor e o principal metabólito não demonstraram risco inaceitável para efeitos adversos para humanos baseado em estudos convencionais de farmacologia de segurança, toxicidade de dose única e repetida e potencial genotóxico.
Reações adversas não observadas em estudos clínicos, mas observadas em animais com níveis de exposição similar ou superior aos níveis de exposição clínica e com possível relevância para o uso clínico foram: GI (gastrointestinais) e irritação gastrointestinal.
Não foram observados tumores relacionados ao composto em um estudo de 2 anos com camundongos em doses orais até 250 mg/kg/dia (> 18 vezes a exposição terapêutica humana). Não houve aumento nos tumores em ratos machos em doses orais até 120 mg/kg/dia (> 15 vezes a exposição terapêutica humana). Houve um aumento de adenocarcinomas uterinos e adenomas hepatocelulares mais adenocarcinomas e uma redução nos adenomas hipofisários e fibroadenomas mamários em ratas expostas somente a altas doses (> 25 vezes a exposição terapêutica humana).
Não foi observada alteração na incidência de tumores em doses de 60 mg/kg/dia (diferença > 8 vezes para a dose terapêutica humana.). Os tumores uterinos observados apenas em ratos foram achados ser o resultado de um efeito endócrino não-genotóxico do desequilíbrio hormonal presente em ratos que receberam altas doses de Ticagrelor.
Os tumores benignos do fígado são considerados secundários a resposta pelo fígado para a carga metabólica localizada no fígado a partir de doses elevadas de Ticagrelor.
O Ticagrelor foi testado em uma faixa de testes in vitro e in vivo e não foi mostrado ser genotóxico.
O Ticagrelor não demonstrou ter efeito na fertilidade de ratas fêmeas em doses orais até 200 mg/kg por dia (aproximadamente 20 vezes a exposição terapêutica humana) e não teve efeito sobre a fertilidade de ratos machos em doses até 180 mg/kg/dia (15,7 vezes a exposição terapêutica humana).
O Ticagrelor não teve efeito no desenvolvimento fetal em doses orais até 100 mg/kg por dia em ratos (5,1 vezes a exposição terapêutica humana) e até 42 mg/kg/dia em coelhos (equivalente à exposição terapêutica humana). O Ticagrelor não teve efeitos no parto ou no desenvolvimento pós-natal em ratos com doses até 60 mg/kg/dia (4,6 vezes a exposição terapêutica humana).
Fontes consultadas
- Bula do Profissional do Medicamento Brilinta®.
Doenças relacionadas
O conteúdo desta bula foi extraído manualmente da bula original, sob supervisão técnica do(a) farmacêutica responsável: Karime Halmenschlager Sleiman (CRF- PR 39421). Última atualização: 18 de Março de 2025.
