Stocrin 600mg, caixa com 30 comprimidos revestidos
- Efavirenz
Branca Comum (Venda Sob Prescrição Médica)
Temperatura ambiente
Não pode ser partido
Bula do Stocrin
Stocrin, para o que é indicado e para o que serve?
Seu médico prescreveu Stocrin® porque você apresenta infecção por HIV. Stocrin®, tomado em combinação com outros antirretrovirais, reduz a quantidade de vírus em seu sangue.
Como o Stocrin funciona?
Stocrin® pertence à classe de antirretrovirais denominados inibidores da transcriptase reversa não nucleosídeos (ITRNNs). Trata-se de um antirretroviral que combate a infecção pelo HIV por meio da redução da quantidade de vírus no sangue.
Quais as contraindicações do Stocrin?
Você não deve tomar Stocrin® comprimidos se for alérgico a qualquer um de seus ingredientes. Stocrin® não deve ser tomado com alguns medicamentos listados a seguir em "Interação medicamentosa: quais os efeitos de tomar Stocrin com outros remédios?".
Como usar o Stocrin?
Uso oral.
Stocrin® comprimidos pode ser tomado com ou sem alimentos.
A dose para adultos ou crianças com peso igual ou superior a 40 kg é de 600 mg 1x/dia (um comprimido por dia). Stocrin® comprimidos não é indicado para crianças com peso inferior a 40 kg. (Observe que a dose de Stocrin® solução oral em mg de efavirenz não é a mesma que para Stocrin® comprimidos).
Seu médico irá lhe fornecer as informações para a dose correta. Stocrin® deve ser tomado diariamente.
Stocrin® nunca deve ser tomado isoladamente para tratar a infecção pelo HIV; deve ser sempre tomado em combinação com outros medicamentos anti-HIV.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento.
Não interrompa o tratamento sem o conhecimento do seu médico.
O que devo fazer quando eu me esquecer de usar o Stocrin?
Tente não se esquecer de tomar uma dose deste medicamento. Se você deixou de tomar uma dose, tome a próxima dose o mais rápido possível, porém sem duplicar a dose. Se precisar de ajuda para programar os melhores horários de ingestão de seu medicamento, peça ajuda a seu médico.
Quando a quantidade de Stocrin® começar a diminuir, solicite mais ao seu médico. É muito importante que você não fique sem o medicamento, pois a quantidade de vírus pode começar a aumentar se o tratamento for interrompido, mesmo por período curto de tempo, o que pode dificultar o tratamento da infecção.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Quais cuidados devo ter ao usar o Stocrin?
Informe ao seu médico sobre qualquer condição médica anterior ou atual, incluindo doença do fígado (por exemplo, hepatite crônica B ou C) ou alergias, convulsões, doenças mentais ou abuso de álcool ou outras substâncias. Informe-o também sobre quaisquer medicamentos, vitaminas ou suplementos nutricionais – incluindo erva-de-são-joão (Hypericum perforatum) – que esteja tomando atualmente ou planeje tomar. Informe ao seu médico se estiver amamentando, grávida ou se pretende engravidar.
Uso na Gravidez e Amamentação
As mulheres não devem engravidar durante o tratamento com Stocrin® e por 12 semanas após seu término.
As mulheres devem avisar seu médico se engravidarem durante o tratamento com Stocrin®.
Se houver a possibilidade de que você fique grávida enquanto estiver tomando Stocrin®, um método anticoncepcional de barreira confiável deverá ser sempre utilizado com outros métodos de contracepção incluindo anticoncepcionais orais (pílula) ou outros anticoncepcionais hormonais (p.ex., implantes, injeção). O efavirenz pode permanecer em seu sangue por um período de tempo após o término da terapia. Portanto, você deve continuar utilizando medidas contraceptivas por 12 semanas após parar de tomar Stocrin®.
Informe seu médico imediatamente se você está grávida ou tem intenção de engravidar. Se você está grávida, você deve tomar Stocrin® somente se você e seu médico decidirem que isto é claramente necessário.
Foram observadas malformações em fetos de animais tratados com Stocrin®, os quais receberam doses do medicamento semelhantes às utilizadas em humanos. Também foram observadas malformações em bebês de mulheres que tomaram Stocrin® durante a gravidez; portanto, a gravidez deve ser evitada por mulheres tratadas com Stocrin®.
É recomendado que mulheres infectadas pelo HIV não amamentem seus filhos devido a possibilidade de que seu bebê seja infectado pelo vírus HIV através do leite materno. Converse com seu médico sobre a melhor forma de alimentar seu bebê.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica. Informe imediatamente seu médico em caso de suspeita de gravidez.
Uso Pediátrico
Stocrin® não foi adequadamente estudado em crianças com menos de 3 anos de idade ou menos de 13 kg; portanto, o uso de Stocrin® para essa faixa etária não é recomendado. Stocrin® comprimidos não é indicado para crianças com peso menor que 40 kg; para esses pacientes, é mais indicado Stocrin® solução oral.
Dirigir ou operar máquinas
Durante o tratamento com Stocrin® foram relatados casos de tontura, capacidade de concentração prejudicada e sonolência. Se apresentar esses sintomas, você deve evitar tarefas potencialmente perigosas como conduzir veículos ou operar máquinas.
Atenção: o uso incorreto causa resistência do vírus da AIDS e falha no tratamento.
Quais as reações adversas e os efeitos colaterais do Stocrin?
Qualquer medicamento pode apresentar efeitos inesperados ou indesejáveis, denominados efeitos adversos.
Stocrin® em geral é bem tolerado. As reações adversas mais frequentemente relatadas (ocorre em mais de 5% dos pacientes que utilizam este medicamento) associadas com Stocrin® em combinação com outros medicamentos anti-HIV incluem erupções cutâneas, náuseas, tontura, dor de cabeça e fadiga.
Os efeitos indesejáveis de maior importância são erupções cutâneas e sintomas do sistema nervoso que incluem tontura, insônia, sonolência, concentração prejudicada e sonhos anormais.
Entre em contato com seu médico se apresentar erupções cutâneas, pois algumas delas podem ser graves; no entanto, na maioria dos casos, as erupções desaparecem sem modificação do tratamento com Stocrin®. As erupções cutâneas foram mais comuns em crianças do que em adultos tratados com Stocrin®.
Os sintomas do sistema nervoso tendem a ocorrer no início do tratamento, mas, em geral, diminuem nas primeiras semanas. Se você apresentá-los, seu médico poderá sugerir que você tome Stocrin® na hora de dormir e com o estômago vazio. Raramente, alguns pacientes apresentam sintomas mais graves, que podem afetar o humor ou a capacidade de raciocínio. Esses sintomas incluem depressão, pensamentos suicidas, comportamento agressivo e pensamentos estranhos. Alguns pacientes tentaram realmente o suicídio. Esses problemas tendem a ocorrer mais frequentemente em pacientes com histórico de doença mental. Sempre informe ao seu médico se apresentar esses sintomas ou quaisquer efeitos colaterais durante o tratamento com Stocrin®.
Nos pacientes tratados com Stocrin®, raramente foram relatados casos de distúrbios de coordenação e equilíbrio, convulsões, coceira, dor de estômago, visão turva, aumento de mamas em homens, insuficiência hepática, inflamação do pâncreas, aumento de gordura em regiões como pescoço, mamas, abdômen, e costas, rubor, tremores, e zumbido no ouvido.
Podem ocorrer outros efeitos colaterais com Stocrin®. Seu médico possui uma lista mais completa desses efeitos. Informe ao seu médico imediatamente a ocorrência desses e de outros efeitos indesejáveis, especialmente os não mencionados nesta bula. Se a condição persistir ou piorar, procure assistência médica.
Informe ao seu médico, cirurgião-dentista ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento.
Informe também à empresa através do seu serviço de atendimento.
Qual a composição do Stocrin?
Cada comprimido contém:
600 mg de efavirenz como ingrediente ativo.
Ingredientes inativos: croscarmelose sódica, celulose microcristalina, laurilsulfato de sódio, hiprolose, lactose monoidratada, estearato de magnésio, cera de carnaúba, hipromelose, dióxido de titânio, macrogol e óxido férrico amarelo.
Apresentação do Stocrin
Stocrin® 600 mg comprimidos é apresentado em frascos com 30 comprimidos revestidos.
Uso oral.
Uso adulto e pediátrico (crianças a partir de 3 anos de idade e com peso maior ou igual a 40 kg).
Stocrin® comprimidos não é indicado para crianças com peso menor que 40 kg. Para esses pacientes, está disponível Stocrin® solução oral.
Superdose: o que acontece se tomar uma dose do Stocrin maior do que a recomendada?
Se ingerir uma grande quantidade de Stocrin® entre em contato com seu médico ou sua clínica. Alguns pacientes que acidentalmente tomaram 600 mg por dia relataram aumento dos sintomas do sistema nervoso. Um paciente teve contrações musculares involuntárias.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível.
Ligue para 0800 722 6001, se você precisar de mais orientações.
Interação medicamentosa: quais os efeitos de tomar Stocrin com outros remédios?
Informe seu médico se estiver tomando algum medicamento que contém efavirenz. Stocrin® não deve ser tomado junto com outros medicamentos que contenham efavirenz.
Stocrin® comprimidos pode ser tomado com ou sem alimentos. Os medicamentos que devem ser tomados precaução com Stocrin® incluem a cisaprida, o midazolam, o triazolam, a pimozida, o bepridil e os derivados do ergô. Ao tomar esses medicamentos com Stocrin®, pode se desenvolver um potencial para efeitos colaterais graves e/ou potencialmente fatais.
A dose geralmente recomendada de Stocrin® não deve ser tomada com a dose geralmente recomendada de voriconazol, um medicamento que é utilizado para tratar infecções fúngicas. Stocrin® pode fazer com que o voriconazol tenha menos probabilidade de agir. Além disso, o voriconazol pode aumentar a ocorrência das reações adversas de Stocrin®. Uma dose mais alta de voriconazol pode ser tomada ao mesmo tempo que uma dose reduzida de efavirenz, porém antes você deve verificar com seu médico.
Não tome Stocrin® com erva-de-são-joão (Hypericum perforatum) – um fitoterápico comercializado como suplemento nutricional – ou com produtos que contenham essa erva, pois o efeito de Stocrin® ou de outros fármacos relacionados com o HIV pode ser diminuído.
Stocrin® pode ser tomado com muitos outros medicamentos comumente utilizados por pessoas infectadas pelo HIV. Esses medicamentos incluem inibidores da protease e inibidores da transcriptase reversa análogos de nucleosídeos (ITRNs). A dose ótima de indinavir quando administrada em combinação com efavirenz, não é conhecida. A dose de atazanavir deve ser ajustada quando administrada com Stocrin® e ritonavir. A dose de darunavir pode necessitar de ajuste quando administrada com Stocrin® e ritonavir. Não se recomenda o uso de Stocrin® com saquinavir. Pode ser requerido aumento da dose de lopinavir/ritonavir quando administrada em combinação com Stocrin®.
Se você estiver sendo tratado com telaprevir (um medicamento para tratamento de hepatite C) enquanto estiver tomando Stocrin®, o seu médico poderá ter que ajustar a dose de telaprevir.
Se você estiver tomando o antibiótico claritromicina, seu médico pode optar por prescrever outro tipo de antibiótico. Se estiver tomando rifampicina, seu médico irá prescrever uma dose mais alta de Stocrin®.
Se você estiver tomando metadona, seu médico irá ter de ajustar a dose de metadona após iniciar o tratamento com Stocrin®.
Se você estiver sendo tratado com sertralina ao começar o tratamento com Stocrin®, seu médico precisará ajustar a dose da sertralina.
Se você estiver sendo tratado com bupropiona ao começar o tratamento com Stocrin®, seu médico poderá realizar ajuste da dose de bupropiona.
Stocrin® pode fazer com que o itraconazol (utilizado para tratar infecções fúngicas) tenha menos probabilidade de agir. Informe seu médico se estiver tomando o itraconazol.
Se você estiver fazendo tratamento com atorvastatina, pravastatina ou sinvastatina (medicamentos hipolipemiantes, também conhecidos como estatinas) quando começar a tomar Stocrin®, seu médico pode ter de ajustar sua dose de estatina.
Se você estiver fazendo tratamento com um imunossupressor (como por exemplo ciclosporina, tacrolimo ou sirolimo) quando iniciar ou parar de tomar Stocrin®, seu médico irá monitorar as concentrações plasmáticas de imunossupressor e poderá precisar ajustar sua dose.
Stocrin® pode fazer com que a carbamazepina (utilizada para prevenir convulsões) tenha menos probabilidade de agir. Além disso, a carbamazepina pode fazer com que Stocrin® tenha menos probabilidade de agir. Informe seu médico se estiver tomando carbamazepina.
Se você estiver fazendo tratamento com diltiazem ou medicamentos semelhantes (chamados de bloqueadores do canal de cálcio) quando começar a tomar Stocrin®, seu médico pode precisar ajustar sua dose do bloqueador do canal de cálcio.
Se você estiver fazendo tratamento com varfarina ou acenocumarol (medicamentos utilizados para reduzir a formação de coágulo no sangue) ao começar o tratamento com Stocrin® seu médico pode ter de ajustar a dose destes medicamentos.
Se você estiver fazendo tratamento com atovaquona/proguanil ou arteméter/lumefantrina (medicamentos que tratam malária), Stocrin® pode reduzir a quantidade de atovaquona/proguanil ou arteméter/lumefantrina em seu sangue. Seu medico poderá precisar ajustar a dose destes medicamentos.
Stocrin® pode ser tomado independentemente da presença de alimentos.
Stocrin® não deve ser tomado junto com outros medicamentos que contêm efavirenz.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
Interação Alimentícia: posso usar o Stocrin com alimentos?
Efavirenz pode ser ingerido com ou sem alimento.
A administração de Efavirenz com alimentos pode aumentar a exposição ao efavirenz e pode levar a um aumento na freqüência de efeitos adversos. Tomar Efavirenz com o estômago vazio, de preferência antes de se deitar, pode ser considerado.
Qual a ação da substância do Stocrin?
Resultados de Eficácia
Nos estudos clínicos descritos a seguir, a principal medida de eficácia foi a porcentagem de pacientes com níveis plasmáticos de RNA do HIV <400 cópias/mL, medidos pelo ensaio monitor de HIV-1 (Amplicor®) PCR-TR. O limite inferior de quantificação desse ensaio é mais baixo do que 400 cópias/mL; portanto, ficou estabelecido que, para a análise da alteração média em relação ao período basal, valores abaixo do limite de quantificação seriam considerados 400 cópias/mL. A quantificação de RNA do HIV também foi obtida por um ensaio de PCRTR, cujo limite inferior era de 50 cópias/mL (ultrassensível).
Nas análises NC=F (pacientes que não completaram o tratamento e os quais foram considerados falha terapêutica) apresentadas, foram consideradas falhas terapêuticas quando os pacientes terminaram o estudo precocemente por qualquer razão ou para os quais faltava um resultado de RNA do HIV, precedido ou seguido de um resultado acima do limite de quantificação do ensaio (>400 cópias/mL). Nas análises de dados observados, apresentadas nas tabelas abaixo, considerou-se falha terapêutica quando, no ponto de tempo especificado, os pacientes sob tratamento apresentavam RNA do HIV >400 cópias/mL.
Estudo 006: Efavirenz + indinavir ou Efavirenz + zidovudina + lamivudina versus indinavir + zidovudina + lamivudina em pacientes nunca tratados com antirretroviral ou já tratados com ITRNs (não tratados com lamivudina)
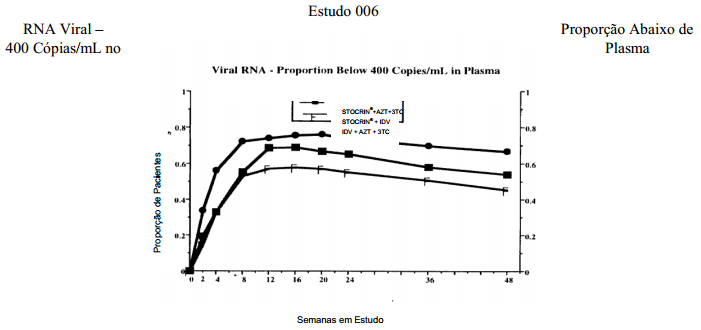
O estudo 006 foi um estudo randômico e aberto para avaliar a supressão de RNA do HIV no plasma por Efavirenz em combinação com o indinavir (IDV) ou com a associação zidovudina (AZT) + lamivudina (3TC) em comparação com a combinação indinavir + zidovudina + lamivudina em pacientes infectados pelo HIV não tratados anteriormente com lamivudina, inibidores da protease e ITRNNs. Os pacientes receberam um dos três esquemas de tratamento: Efavirenz (600 mg uma vez ao dia) + indinavir (1.000 mg a cada 8 horas) ou Efavirenz (600 mg uma vez ao dia) + zidovudina (300 mg a cada 12 horas) + lamivudina (150 mg a cada 12 horas) versus indinavir (800 mg a cada 8 horas) + zidovudina (300 mg a cada 12 horas) + lamivudina (150 mg a cada 12 horas). São apresentadas as análises referentes aos dados de 48 semanas de 614 pacientes (média de idade de 36,3 anos [variação de 18 a 64 anos], 58% caucasianos e 86% homens). No período basal, o número médio de células CD4 era de 342 células/mm3 e o nível plasmático médio de RNA do HIV, 4,76 log10 cópias/mL. A figura 1 apresenta a análise NC=F da porcentagem de pacientes que atingiram níveis plasmáticos de RNA do HIV <400 cópias/mL. A tabela 1 apresenta, de forma resumida, outros resultados de eficácia.
Figura 1
Tabela 1. Estudo 006 – Resumo dos Principais Resultados de Eficácia – 48a Semana
| - | IDV + AZT + 3TC | Efavirenz + IDV |
Efavirenz + AZT + 3TC |
|
Total de pacientes (distribuição randômica) |
206 | 206 |
20 |
| Pacientes com níveis plasmáticos de RNA do HIV <400 cópias/mL | |||
|
Observados (n/N) |
84,4% (92/109) | 85,8% (109/127) |
96,9% (126/130) * |
|
(IC 95%) |
(77,6, 91,2) | (79,8, 91,9) |
(94,0, 99,9) |
| Pacientes com níveis plasmáticos de RNA do HIV <50 cópias/mL | |||
| Ensaio ultrassensível | |||
|
Observados (n/N) |
(IC 95%) 76,9% (83/108) | 76,4% (97/127) |
90,7% (117/129) * |
|
(IC 95%) |
(68,9, 84,8) | (69,0, 83,8) |
(85,7, 95,7 |
|
NC=F (n/N) |
40,4% (82/203) | 47,8% (96/201) |
61,6% (117/190) * |
|
(IC 95%) |
(33,6, 47,1) | (40,9, 54,7) |
(54,7, 68,5) |
| Alteração média em relação ao período basal de RNA do HIV plasmático transformado em log10 (EPM) | |||
|
Amplicor |
-1,67 (0,07) **, *** | -1,73 (0,06) **, *** |
-1,98 (0,05) *, **, *** |
|
Ultrassensível |
-1,76 (0,10) **, *** | -2,08 (0,09) **, ***,† |
-2,32 (0,09) *, **, *** |
| Alteração média em relação ao período basal do número de células CD4 (EPM) | |||
| - | 152,60 (12,3) *** | 176,78 (11,3) *** |
187,04 (11,8) *, *** |
* Diferença estatisticamente significativa (p< 0,05) entre Efavirenz +AZT+3TC e IDV+AZT+3TC.
** Diferença estatisticamente significativa (p< 0,05) entre os grupos de tratamento.
*** Diferença estatisticamente significativa (p< 0,05) em relação ao período basal.
† Diferença estatisticamente significativa (p< 0,05) entre Efavirenz +IDV e IDV+AZT+3TC.
IC: Intervalo de Confiança.
NC=F: Não Completou o Estudo = Falha Terapêutica.
Estudo 020: inibidor da protease + dois ITRNs com/sem Efavirenz em pacientes já tratados com ITRN
O estudo 020 foi um estudo randômico, duplo-cego e controlado com placebo, que envolveu pacientes já tratados com ITRN e não tratados anteriormente com inibidor de protease e ITRNNs, para comparar o tratamento quádruplo com Efavirenz + indinavir + 2 inibidores da transcriptase reversa análogos de nucleosídeos versus tratamento triplo com indinavir + 2 ITRNs após 24 semanas de tratamento. Os pacientes receberam Efavirenz (600 mg uma vez ao dia) + indinavir (1.000 mg a cada 8 horas) + 2 ITRNs ou indinavir (800 mg a cada 8 horas) + 2 ITRNs. Dos 327 pacientes (média de idade de 38,5 anos [variação de 20 a 69 anos], 52% caucasianos, 83% homens), 69% mudaram seus esquemas de ITRN no início do estudo. No período basal, o número médio de células CD4 era de 328 células/mm3 e o nível médio de RNA do HIV no plasma, 4,41 log10 cópias/mL. A figura 2 mostra a análise NC=F da porcentagem de pacientes que atingiram níveis plasmáticos de RNA do HIV <400 cópias/mL na 24a semana. A tabela 2 apresenta, de forma resumida, outros resultados de eficácia.
Figura 2
Tabela 2. Estudo 020 – Resumo dos Principais Resultados de Eficácia – 24a Semana
| - | IDV + AZT + 3TC |
Efavirenz + IDV + AZT + 3TC |
|
Total de pacientes (distribuição randômica) |
170 |
157 |
| Pacientes com níveis plasmáticos de RNA do HIV <400 cópias/mL | ||
|
Observados (n/N) |
65,2% (86/132) |
83,0% (93/112) * |
|
(IC 95%) |
(56,6; 73,7) |
(75,6; 90,4) |
| Pacientes com níveis plasmáticos de RNA do HIV <50 cópias/mL | ||
|
Ensaio ultrassensível |
||
|
Observados (n/N) |
47,7% (63/132) |
68,8% (77/112) |
|
(IC 95%) |
(38,8; 56,6) |
(59,7; 77,8) |
|
NC=F (n/N) |
37,5% (63/168) |
49,4% (77/156) * |
|
(IC 95%) |
(29,9; 45,1) |
(41,2; 57,5) |
| Alteração média em relação ao período basal de RNA do HIV plasmático transformado em log10 (EPM | ||
|
Amplicor |
-1,12 (0,08) ** |
-1,45 (0,08) *, ** |
|
Ultrassensível |
-1,72 (0,11) ** |
-2,25 (0,10) *, ** |
| Alteração média em relação ao período basal do número de células CD4 (EPM) | ||
| - | 77 (9,9) ** |
104 (9,1) *, ** |
* Diferença estatisticamente significativa (p< 0,05) entre os grupos de tratamento.
** Alteração média estatisticamente significativa (p< 0,05) em relação ao período basal.
IC: Intervalo de Confiança.
NC=F: Não Completou o Estudo = Falha Terapêutica.
Estudo ACTG 364: Efavirenz em combinação com nelfinavir em pacientes já tratados com ITRN
O estudo ACTG 364 foi um estudo com duração de 48 semanas, duplo-cego, randômico, controlado com placebo, que envolveu 196 pacientes infectados pelo HIV já tratados com ITRN (média de idade de 41 anos [variação de 18 a 76 anos], 74% caucasianos, 88% homens). Os pacientes receberam ITRNs em combinação com Efavirenz (600 mg uma vez ao dia) ou nelfinavir (NFV; 750 mg três vezes ao dia), ou Efavirenz (600 mg uma vez ao dia) + nelfinavir. Ao serem admitidos no estudo, todos os pacientes foram designados para um novo esquema aberto com ITRN, dependendo da sua experiência anterior de tratamento com esses antirretrovirais. A tabela 3 apresenta, de forma resumida, os resultados globais de eficácia.
Tabela 3. ACTG 364 – Resumo dos Principais Resultados de Eficácia – 48a Semana
| - | NFV + ITRN | Efavirenz + ITRNs |
Efavirenz + NFV + ITRNs |
|
Total de pacientes (distribuição randômica) |
66 | 65 |
65 |
| Pacientes com níveis plasmáticos de RNA do HIV <500 cópias/mL | |||
|
Observados (n/N) |
48,3% (28/58) * | 76,9% (40/52) *, *** |
82,1% (46/56) *,†† |
|
(IC 95%) |
(35,4; 61,1) | (65,5; 88,4) |
(72,1; 92,2) |
|
NC=F |
30,2% (19/63) * | 58,1% (36/62) *, *** |
70,3% (45/64) *,†† |
|
(IC 95%) |
(18,8; 41,5) | (45,8; 70,3) |
(59,1; 81,5) |
| Alteração média em relação ao período basal de RNA do HIV plasmático transformado em log10 (EPM)† | |||
|
Amplicor (Observados) |
-0,57 (0,13) ** | -0,88 (0,11) ** |
-0,96 (0,11) ** |
| Alteração média em relação ao período basal do número de células CD4 (EPM)† | |||
| - | 94 (13,6) ** | 114 (21,0) ** |
107 (17,9) ** |
* Diferença estatisticamente significativa (p< 0,05) entre os grupos de tratamento.
** Diferença estatisticamente significativa (p< 0,05) em relação ao período basal.
*** Diferença estatisticamente significativa entre os grupos com NFV e com Efavirenz (p< 0,05).
† As análises excluem os dados de acompanhamento obtidos após o término do tratamento randômico.
†† Diferença estatisticamente significativa entre os grupos com NFV e com Efavirenz + NFV (p< 0,05).
IC: Intervalo de Confiança.
NC=F: Não Completou o Estudo = Falha Terapêutica.
Outros Estudos
Estudo 003
Em uma fase-piloto desse estudo, 32 pacientes (75% já tratados com ITRN) foram designados de modo randômico para receber placebo (10) ou monoterapia (22) com 200 mg de Efavirenz uma vez ao dia durante duas semanas. Em dois grupos que receberam 200 mg de Efavirenz uma vez ao dia como monoterapia durante duas semanas, os níveis plasmáticos médios de RNA do HIV medidos pelo ensaio Amplicor foram reduzidos para 1,67 log10 cópias/mL em relação a 5,02 log10 cópias/mL no período basal (98% de supressão) e para 1,52 log10 cópias/mL em relação a 5,21 log10 cópias/mL no período basal (97% de supressão), respectivamente. Observou-se aumento de células CD4 de 98 ± 57,5 células/mm3; no grupo placebo não houve alteração. Em uma segunda fase deste estudo, 59 pacientes (63% já tratados com ITRN, 19% já tratados com lamivudina) foram designados de modo randômico para receber Efavirenz (200 mg uma vez ao dia, aumentados a seguir para 600 mg uma vez ao dia) e indinavir (800 mg ou 1.000 mg a cada 8 horas, aumentados a seguir para 1.000 mg a cada 8 horas para todos os pacientes). Entre os pacientes designados de modo randômico para receber Efavirenz mais indinavir, a proporção de pacientes com RNA do HIV <400 cópias/mL na análise NC=F foi de 67,2% na 72a semana. A taxa de resposta foi semelhante, independentemente de tratamento anterior com ITRN.
Estudo 005
Estudo duplo-cego, controlado com placebo, de variação de dose, que avaliou a segurança e a eficácia de Efavirenz em combinação com a zidovudina e a lamivudina em 137 pacientes infectados pelo HIV-1 não tratados anteriormente com antirretroviral. No período basal, o número médio de células CD4 era de 367 células/mm3 e o RNA do HIV no plasma, 4,72 log10 cópias/mL. Os pacientes foram designados de modo randômico para receber 200 mg, 400 mg ou 600 mg de Efavirenz ou placebo equivalente em combinação com zidovudina (300 mg duas vezes ao dia) e lamivudina (150 mg duas vezes ao dia). Na 16a semana, a taxa de resposta observada (porcentagem <400 cópias de RNA do HIV/mL) nos grupos tratados com Efavirenz foi significativamente mais alta do que nos grupos do placebo (zidovudina + lamivudina) e variou de 88,9% a 93,5% em todos os grupos de tratamento com Efavirenz versus 44,4% no grupo controle. A análise NC=F da taxa de resposta foi significativamente superior à do placebo e variou de 72,7% a 80,6% em todos os grupos de tratamento com Efavirenz versus 36,4% no grupo controle. O número de células CD4 aumentou significativamente em todos os grupos de tratamento; não foram observadas diferenças estatisticamente significativas entre os quatro grupos de tratamento.
Em uma extensão de longo prazo do estudo 005, em andamento, todos os 11 pacientes originalmente designados de modo randômico para receber 600 mg de Efavirenz – cujos níveis plasmáticos de RNA do HIV situavam-se abaixo do limite de detecção na 16a semana e para os quais estão disponíveis resultados de 36 semanas – mantiveram níveis plasmáticos de RNA do HIV inferiores a 400 cópias/mL.
O estudo ACTG 382 é um estudo em andamento, aberto, com 48 semanas de duração, envolvendo 57 pacientes pediátricos já tratados com ITRN, para caracterizar a farmacocinética, a atividade antirretroviral e a segurança de Efavirenz em combinação com nelfinavir (20-30 mg/kg três vezes ao dia) e ITRNs. A média de idade é de oito anos (variação de 3 a 16 anos). Os níveis plasmáticos médios de RNA do HIV no período basal eram de 4,09 log10 (+0,69) cópias/mL. A dose inicial de Efavirenz foi de 600 mg uma vez ao dia, ajustada pela superfície corpórea, com o objetivo de obter níveis de AUC entre 190-380 µM•h. Nos pacientes que completaram 48 semanas de tratamento, a taxa de respondentes com RNA do HIV <400 cópias/mL foi de 60% (34/57). O número médio de células CD4 aumentou em 63 células/mm3 em relação ao período basal.
Características Farmacológicas
Mecanismo de Ação
O efavirenz é um inibidor seletivo não nucleosídeo da transcriptase reversa do vírus da imunodeficiência humana tipo 1 (HIV-1). O efavirenz é um inibidor não competitivo da transcriptase reversa (TR) do HIV-1 no que diz respeito à matriz e trifosfatos básicos ou nucleosídeos, com um pequeno componente de inibição competitiva. A transcriptase reversa do HIV tipo 2 e as DNA polimerases α, β, γ e δ de células humanas não são inibidas por concentrações do efavirenz muito acima daquelas atingidas clinicamente.
Farmacocinética
Absorção
Concentrações plasmáticas máximas de 1,6-9,1 µM de efavirenz foram alcançadas cerca de 5 horas após doses únicas de 100 mg a 1.600 mg, administradas por via oral a voluntários não infectados. Com doses de até 1.600 mg, foram observados aumentos da Cmáx e da AUC relacionados à dose; os aumentos não chegaram a ser proporcionais, sugerindo redução da absorção com doses mais altas. O tempo até a obtenção de concentrações plasmáticas máximas (3-5 horas) não foi alterado após administração múltipla e as concentrações plasmáticas em estado de equilíbrio foram alcançadas em 6-7 dias.
Em pacientes infectados pelo HIV-1, a Cmáx, a Cmín e a AUC médias em estado de equilíbrio foram lineares com doses de 200 mg, 400 mg e 600 mg ao dia. Em 35 pacientes que receberam 600 mg de Efavirenz uma vez ao dia, a Cmáx e a Cmín em estado de equilíbrio foram de 12,9 µM e de 5,6 µM, respectivamente, e a AUC foi de 184 µM•h.
Em voluntários adultos não infectados, a Cmáx e a AUC de uma dose de 240 mg da solução oral de Efavirenz foram 78% e 97%, respectivamente, dos valores obtidos quando Efavirenz foi administrado em cápsulas duras de 200 mg.
Efeito de alimentos na absorção oral: a biodisponibilidade de uma dose única de 600 mg de efavirenz em voluntários não infectados aumentou 22% e 17%, respectivamente, quando administrada com uma refeição com alto teor de gordura ou com uma refeição de composição normal em relação à biodisponibilidade da dose de 600 mg administrada em jejum. Efavirenz pode ser administrado com ou sem alimentos.
Distribuição
O efavirenz liga-se intensamente (aproximadamente 99,5%-99,75%) às proteínas plasmáticas humanas, principalmente à albumina. Em pacientes infectados pelo HIV-1 (N= 9) que receberam 200 mg a 600 mg de Efavirenz uma vez ao dia durante pelo menos um mês, as concentrações no líquor variaram de 0,26% a 1,19% (média de 0,69%) da concentração plasmática correspondente. Essa proporção é aproximadamente três vezes maior do que a fração não ligada às proteínas (livre) de efavirenz no plasma.
Metabolismo
Estudos em seres humanos e estudos in vitro nos quais foram utilizados microssomos hepáticos humanos demonstraram que o efavirenz é metabolizado principalmente pelo sistema do citocromo P450 em metabólitos hidroxilados, que sofrem glicuronidação subsequente. Esses metabólitos são essencialmente inativos contra o HIV-1. Os estudos in vitro sugerem que a CYP3A4 e a CYP2B6 são as principais isoenzimas responsáveis pelo metabolismo do efavirenz. Os estudos in vitro mostraram que o efavirenz inibiu as isoenzimas CYP 2C9, 2C19 e 3A4 com valores de Ki (8,5-17 µM) na faixa das concentrações de efavirenz observadas no plasma. Em estudos in vitro, o efavirenz não inibiu a CYP2E1 e inibiu a CYP2D6 e a CYP1A2 (valores de Ki de 82-160 µM) apenas em concentrações muito acima das alcançadas clinicamente.
A exposição plasmática de efavirenz pode ser aumentada em pacientes com a variante genética homozigota G516T da isoenzima CYP2B6. As implicações clínicas dessa associação são desconhecidas; no entanto, o potencial para um aumento de freqüência e gravidade de eventos adversos associados ao efavirenz não pode ser excluído.
O efavirenz demonstrou induzir as enzimas do citocromo P450, o que resulta na indução do seu próprio metabolismo. Doses múltiplas de 200-400 mg ao dia durante 10 dias resultaram em acúmulo menor do que o previsto (22%-42% mais baixo) e em meia-vida terminal mais curta, de 40-55 horas (meia-vida da dose única: de 52-76 horas). Espera-se que o grau de indução da CYP3A4 seja semelhante entre uma dose de 400 mg e outra de 600 mg de efavirenz com base nos estudos de interação farmacocinética, nos quais doses diárias de 400 mg ou 600 mg de efavirenz, em combinação com o indinavir, não pareceram causar redução adicional da AUC do indinavir em comparação com uma dose de 200 mg de efavirenz.
Eliminação
O efavirenz tem meia-vida terminal relativamente longa: de 52 a 76 horas após doses únicas e de 40 a 55 horas após doses múltiplas. Aproximadamente 14%-34% de uma dose de efavirenz marcado radioativamente foi recuperada na urina e menos de 1% da dose foi excretada na urina como efavirenz inalterado.
Farmacodinâmica
Sensibilidade in vitro do HIV
O significado clínico da sensibilidade do HIV-1 ao efavirenz in vitro não foi estabelecido. A atividade antiviral do efavirenz in vitro foi avaliada em linhagens celulares linfoblastóides, em células mononucleares do sangue periférico (CMSPs) e em culturas de macrófagos/monócitos enriquecidas a partir de CMSPs. A concentração inibitória de 90%-95% (CI90-95) do efavirenz para cepas do tipo selvagem adaptadas em laboratório e para isolados clínicos variou de 1,7 a ≤25 nM. A potência do efavirenz contra variantes com mutações de S48T, V108I, V179D, Y181C, P236L ou variantes com substituições de aminoácidos no gene da protease foi semelhante à observada contra o tipo selvagem. Foi observada resistência modesta (inferior a nove vezes) contra variantes com as mutações A98G, K101E, V106A, Y188C ou G190A. As mutações pontuais que levaram à resistência mais alta aparente à inibição pelo efavirenz in vidro foram L100I (resistência de 17 a 22 vezes) e K103N (resistência de 18 a 33 vezes). As seguintes variantes de múltiplos pares de base, que sofreram mutação que codificam as TRs com uma ou mais substituições de aminoácidos, mostraram aumento da resistência ao efavirenz in vitro em relação ao tipo selvagem: S48T+G190S (97 vezes), Y181C+K103N (133 vezes), G190A+K103N (130 vezes), Y188L (140 a 500 vezes), K101E+K103N (500 vezes) e L100I+K103N (>1.000 vezes).
O efavirenz demonstrou atividade sinérgica em cultura celular em associação com os inibidores da transcriptase reversa análogos de nucleosídeos (ITRNs), zidovudina (AZT) ou didanosina (ddl), ou com o indinavir, um inibidor da protease.
Resistência ao Medicamento
A potência do efavirenz em cultura celular contra variantes virais com substituições de aminoácidos nas posições 48, 108, 179, 181 ou 236 na TR ou variantes com substituições de aminoácidos na protease foi semelhante à observada contra cepas virais do tipo selvagem. As substituições isoladas que levaram à resistência mais alta ao efavirenz em cultura celular correspondem a uma alteração leucina-para-isoleucina na posição 100 (L100I, resistência de 17 a 22 vezes) e uma lisina-para-asparagina na posição 103 (K103N, resistência de 18 a 33 vezes). Foi observada perda de sensibilidade superior a 100 vezes contra variantes do HIV que expressam K103N além de outras substituições de aminoácidos na TR. K103N foi a substituição na TR mais frequentemente observada em isolados virais de pacientes que apresentaram rebote significativo da carga viral durante estudos clínicos que avaliaram o efavirenz em combinação com o indinavir ou a associação zidovudina + lamivudina. Também foram observadas substituições nas posições 98, 100, 101, 108, 138, 188, 190 ou 225 da TR, porém em menor frequência e muitas vezes somente em combinação com K103N. O padrão de substituição de aminoácidos na TR associado com resistência ao efavirenz foi independente de outras medicações antivirais usadas em combinação com o efavirenz.
Resistência Cruzada a Outros Agentes Antivirais
Os perfis de resistência cruzada para o efavirenz, a nevirapina e a delavirdina em cultura celular mostraram que a substituição de K103N confere perda de sensibilidade aos três inibidores da transcriptase reversa não nucleosídeos (ITRNNs). Dois de três isolados clínicos resistentes à delavirdina examinados apresentavam resistência cruzada ao efavirenz e continham a substituição de K103N. Um terceiro isolado com substituição na posição 236 da TR não apresentou resistência cruzada ao efavirenz.
Isolados virais recuperados de CMSPs de pacientes envolvidos em estudos clínicos com o efavirenz e que mostraram evidência de falha terapêutica (rebote da carga viral) foram avaliados quanto à sensibilidade aos ITRNNs. Treze isolados anteriormente caracterizados como resistentes ao efavirenz foram também resistentes à nevirapina e à delavirdina. Observou-se que cinco desses isolados resistentes aos ITRNNs apresentavam substituição na posição K103N ou uma substituição valina-para isoleucina na posição 108 (V108I) na TR. Três dos isolados testados que não apresentaram resposta ao tratamento com o efavirenz permaneceram sensíveis ao efavirenz em cultura celular e também foram sensíveis à nevirapina e à delavirdina.
O potencial de resistência cruzada entre o efavirenz e os inibidores da protease é baixo por causa dos diferentes alvos enzimáticos envolvidos. O potencial de resistência cruzada entre o efavirenz e os ITRNs é baixo em função dos diferentes locais de ligação no alvo e mecanismos de ação.
Como devo armazenar o Stocrin?
Conserve o frasco de Stocrin® comprimidos fechado e em temperatura entre 15° a 30° C.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Aparência
Stocrin® 600 mg
Comprimido amarelo, com forma capsular modificada, de um lado gravado “225” e do outro plano.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Mensagens de Alerta do Stocrin
Leia esta bula com atenção antes de iniciar o tratamento com Stocrin®, ou mesmo se apenas estiver dando continuidade ao tratamento. Algumas das informações contidas na bula anterior podem ter sido alteradas.
Lembre-se de que seu médico prescreveu este medicamento apenas para você. Nunca ofereça este medicamento a outra pessoa.
Outras considerações
Stocrin® deve ser tomado com outros medicamentos que agem contra o vírus HIV. Se o tratamento com Stocrin® for iniciado porque seu tratamento atual não evitou a multiplicação do vírus, outro medicamento que você ainda não tomou antes pode ser iniciado ao mesmo tempo.
Você deve estar ciente de que Stocrin® não é uma cura da infecção pelo HIV e que você pode continuar a desenvolver infecções ou outras doenças associadas à doença pelo HIV. Você deve continuar sob os cuidados de seu médico durante o tratamento com Stocrin®.
Em alguns pacientes com infecção avançada por HIV (AIDS) e histórico de infecções oportunistas, podem ocorrer sinais e sintomas de inflamação das infecções anteriores quando o tratamento de combinação antirretroviral for iniciado. Além de infecções oportunistas, também podem ocorrer distúrbios autoimunes (uma condição que ocorre quando o sistema imune ataca o tecido saudável do corpo). Informe seu médico imediatamente caso você note quaisquer sintomas de infecção ou inflamação.
Não se verificou que o tratamento com Stocrin® reduza o risco de transmissão da infecção pelo HIV a outras pessoas por contato sexual ou contaminação por sangue.
Este medicamento foi prescrito apenas para você. Nunca ofereça este medicamento a outra pessoa.
Dizeres Legais do Stocrin
Reg. MS 1.0029.0018
Farm. Resp.:
Fernando C. Lemos
CRF-SP nº 16.243
Registrado e importado por:
Merck Sharp & Dohme Farmacêutica Ltda.
Rua 13 de Maio, 815 - Sousas, Campinas/SP
CNPJ: 45.987.013/0001-34 – Indústria Brasileira
MSD On Line 0800-0122232
E-mail: online@merck.com
Fabricado por:
Zhejiang Huahai Pharmaceutical Co., Ltd.
Xunqiao, Linhai, Zhejiang – China
Embalado por:
Merck Sharp & Dohme Farmacêutica Ltda.
Rua 13 de Maio, 1.161 - Sousas, Campinas/SP
Venda sob prescrição médica - só pode ser vendido com retenção da receita.
Especificações sobre o Stocrin
Caracteristicas Principais
| Fabricante: | MSD |
| Necessita de Receita: | Branca Comum (Venda Sob Prescrição Médica) |
| Princípio Ativo: | Efavirenz |
| Categoria do Medicamento: | HIV/AIDS |
| Especialidades: | Infectologia |
| Doenças Relacionadas: | HIV |
| Bula do Paciente: | Bula do Stocrin |
| Bula do Profissional: | Bula do Profissional do Stocrin |
| Tipo do Medicamento: | Referência |
| Registro no Ministério da Saúde: | 1002900180074 |
| Código de Barras: | 7897337707534 |
| Temperatura de Armazenamento: | Temperatura ambiente |
| Produto Refrigerado: | Este produto não precisa ser refrigerado |
| Modo de Uso: | Uso oral |
| Pode partir: | Esta apresentação pode ser partida |
Que tal conferir outros itens? Temos outras opções que podem te interessar!