Xigduo XR
- DoseQuantidade de princípio ativo por unidade, como 50mg por comprimido.
- Quantidade na embalagemNúmero de unidades do produto por embalagem.
- Dapagliflozina + Cloridrato de Metformina
Branca Comum (Venda Sob Prescrição Médica)
Temperatura ambiente
Não pode ser partido
Bula do Xigduo XR
Xigduo XR, para o que é indicado e para o que serve?
Xigduo XR é indicado para adultos com diabetes melittus tipo 2 quando o tratamento com ambos dapagliflozina e metformina é apropriado para:
- Tratamento da diabetes mellitus tipo 2 como adjuvante da dieta e do exercício;
- Prevenção do desenvolvimento ou agravamento de insuficiência cardíaca ou morte cardiovascular;
- Prevenção do desenvolvimento ou agravamento da nefropatia.
Limitações de uso
Xigduo XR não é indicado para uso em pacientes com diabetes tipo 1.
Xigduo XR não deve ser usado para o tratamento da cetoacidose diabética.
Como o Xigduo XR funciona?
Xigduo XR é uma associação de dois medicamentos, a dapagliflozina e a metformina. A dapagliflozina é um medicamento que bloqueia o cotransportador sódio-glicose 2 (SGLT2), uma proteína responsável pela reabsorção de glicose (açúcar) no rim, fazendo com que essa glicose seja eliminada na urina. A metformina diminui a produção de glicose no fígado, diminui a absorção intestinal de glicose e melhora a sensibilidade à insulina. A ação desses dois medicamentos age melhorando o controle do diabetes mellitus tipo 2.
Foi observada redução da quantidade de açúcar no sangue em jejum após uma semana de tratamento com Xigduo XR.
Quais as contraindicações do Xigduo XR?
Você não deve utilizar Xigduo XR nas seguintes situações:
- Doença renal grave ou insuficiência renal grave;
- Acidose metabólica (excesso de acidez no sangue);
- Hipersensibilidade à substância ativa ou a qualquer um dos excipientes;
- Insuficiência hepática.
Como usar o Xigduo XR?
Dose Recomendada
A dose de Xigduo XR deve ser individualizada com base na situação atual de cada paciente, desde que não exceda a dose máxima recomendada de 10 mg de dapagliflozina e de 2000 mg de cloridrato de metformina de liberação prolongada.
Xigduo XR deve, de modo geral, ser administrado por via oral uma vez ao dia com a refeição da noite.
Se a terapia com um comprimido contendo dapagliflozina e metformina em combinação for considerada apropriada, a dose recomendada de dapagliflozina é de 10 mg uma vez ao dia. A dose inicial recomendada da metformina de liberação prolongada é de 500 mg uma vez ao dia, que pode ser titulada para 2000 mg uma vez ao dia. A dose máxima de Xigduo XR é dapagliflozina 10 mg/cloridrato de metformina de liberação prolongada 2000 mg tomada como dois comprimidos de 5 mg/1000 mg uma vez ao dia.
A dose inicial recomendada de Xigduo XR para pacientes que precisam de 10 mg de dapagliflozina e que não estão sendo tratados no momento com a metformina é de 10 mg dapagliflozina/500 mg de cloridrato de metformina de liberação prolongada, uma vez ao dia, com aumento gradual da dose para reduzir os efeitos colaterais gastrointestinais decorrentes da metformina.
Nos pacientes tratados com metformina, a dose de Xigduo XR deve fornecer metformina na dose que já estava sendo tomada, ou na dose terapeuticamente apropriada mais próxima. Após a mudança da metformina de liberação imediata para a metformina de liberação prolongada, o controle glicêmico deve ser monitorado de perto e os ajustes na dose devem ser feitos de acordo.
Para os pacientes que precisam de 5 mg de dapagliflozina, e que não estão sendo tratados atualmente com metformina, a dose recomendada é de 5 mg dapagliflozina/500 mg cloridrato de metformina de liberação prolongada, uma vez ao dia, com aumento gradual da dose para reduzir os efeitos colaterais gastrointestinais decorrentes da metformina. Estes pacientes devem utilizar os medicamentos individualmente.
Os pacientes que precisam de 5 mg de dapagliflozina em combinação com cloridrato de metformina de liberação prolongada podem ser tratados com Xigduo XR 5 mg/1000 mg. Pacientes que precisam de 5 mg de dapagliflozina e que necessitam de uma dose de metformina superior a 1000 mg devem utilizar os medicamentos individualmente.
Nenhum estudo foi realizado para examinar especificamente a segurança e a eficácia de Xigduo XR em pacientes previamente tratados com outros agentes hipoglicemiantes que mudaram para o Xigduo XR.
Qualquer mudança na terapia do diabetes tipo 2 deve ser feita com cuidado e com acompanhamento médico, uma vez que podem ocorrer alterações no controle glicêmico.
Os comprimidos de Xigduo XR devem ser engolidos inteiros, e nunca esmagados, cortados ou mastigados.
Ocasionalmente, os ingredientes inativos de Xigduo XR serão eliminados nas fezes como uma massa mole, hidratada que pode se assemelhar ao comprimido original.
Este medicamento não deve ser partido, aberto ou mastigado.
Não há estudos dos efeitos de Xigduo XR comprimidos revestidos administrado por vias não recomendadas. Portanto, por segurança e para eficácia desta apresentação, a administração deve ser somente pela via oral.
Populações Especiais
Insuficiência renal
Não são necessários ajustes de dose se você tiver insuficiência renal leve ou moderada. Xigduo XR não deve ser utilizado em pacientes com insuficiência renal grave.
Insuficiência hepática
Xigduo XR deve, de modo geral, ser evitado se você apresenta insuficiência hepática (diminuição da função do fígado).
Crianças e Adolescentes
A segurança e eficácia de Xigduo XR em pacientes pediátricos e adolescentes não foram estabelecidas.
Idosos
Xigduo XR deve ser usado com cautela em pacientes idosos.
Pacientes sob risco de depleção de volume
- Para pacientes que apresentam risco de depleção de volume (alteração no organismo que tem como sintomas: pressão baixa, desmaio, desidratação ou tontura ao levantar-se) uma dose inicial de 5 mg de dapagliflozina pode ser apropriada. Estes pacientes devem utilizar os medicamentos individualmente.
Siga a orientação do seu médico, respeitando sempre os horários, as doses e a duração do tratamento.
Não interrompa o tratamento sem o conhecimento de seu médico.
O que devo fazer quando me esquecer de usar o Xigduo XR?
Se você deixar de tomar uma dose de Xigduo XR, tome-a assim que se lembrar. Se estiver quase na hora da dose seguinte, pule a dose que esqueceu. Apenas tome a dose seguinte no horário normal. Não tome duas doses ao mesmo tempo. Converse com seu médico se tiver dúvidas sobre uma dose que esqueceu.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Quais cuidados devo ter ao usar o Xigduo XR?
Informe seu médico se:
- Você apresentar diabetes tipo 1. Xigduo XR não é indicado para diabetes tipo 1.
- Você apresentar ou se já apresentou dispneia acidótica (falta de ar), dor abdominal e hipotermia (queda da temperatura corporal) ou qualquer outro sintoma que possa indicar acidose láctica (condição causada pelo acúmulo de ácido láctico no organismo).
- Você apresenta alteração grave do funcionamento do rim.
- Você apresenta alteração do funcionamento do fígado.
- Você apresenta depleção de volume (alteração no organismo manifestada por pressão baixa, desmaio, desidratação ou tontura ao levantar-se).
- Você apresentar infecções urinárias.
- Você apresentar problemas cardíacos.
- Você tem ou já teve câncer de bexiga.
O tratamento com Xigduo XR deve ser descontinuado no momento ou antes da realização de procedimentos com utilização de contraste com material iodado. O tratamento deve ser suspenso pelas 48 horas após o exame e reinstituído apenas após o seu médico avaliar que sua função renal está normal.
O uso de Xigduo XR deve ser temporariamente suspenso quando da realização de qualquer procedimento cirúrgico que requeira ingestão restrita de alimentos e líquidos, e não deve ser reiniciado até que você possa se alimentar normalmente por via oral e que o seu médico tenha avaliado sua função renal como normal.
Uso concomitante com álcool
O álcool é conhecido potencializador do efeito da metformina, portanto deve-se ter cautela ao ingerir bebidas alcoólicas.
Cetoacidose
Se você apresentar sinais e sintomas compatíveis com cetoacidose, como náuseas, vômito, dor abdominal, malestar e falta de ar, você deve consultar imediatamente seu médico para avaliação de suspeita de cetoacidose. Em caso de suspeita de cetoacidose, seu médico pode suspender temporariamente ou interromper o uso de Xigduo XR.
Alteração no estado clínico de pacientes com diabetes tipo 2 previamente controlada
Se você apresentar diabetes tipo 2 previamente bem controlada com Xigduo XR e desenvolver anormalidades laboratoriais ou sintomas (especialmente doenças vagas e mal definidas), você deve consultar imediatamente seu médico para avaliação de suspeita de cetoacidose ou acidose láctica. Em caso de suspeita de qualquer forma de acidose, seu médico deve suspender o uso de Xigduo XR.
Diminuição/deficiência de vitamina B12
A metformina, um dos componentes do Xigduo XR, pode reduzir os níveis de vitamina B12 no seu sangue. O risco de baixos níveis de vitamina B12 aumenta com o aumento da dose de metformina, duração do tratamento e/ou em pacientes com fatores de risco conhecidos por causar deficiência de vitamina B12. Em caso de suspeita de deficiência de vitamina B12 (o que pode ocorrer em pacientes com anemia ou neuropatia), seu médico poderá solicitar o monitoramento dos níveis de vitamina B12 no seu sangue.
Fasciíte necrosante do períneo (Gangrena de Fournier)
Casos raros, mas que podem levar à morte, de fasciíte necrosante ou gangrena de Fournier, uma infecção dos tecidos moles da região genital, causada por bactérias, foram relatados no período pós-comercialização do produto. Se você apresentar sintomas como sensibilidade, vermelhidão ou inchaço na área genital, acompanhados de febre e mal-estar, procure um médico e pare imediatamente o uso do medicamento.
Uso na gravidez
Não existem estudos adequados e bem controlados de Xigduo XR em mulheres grávidas. Quando a gravidez for detectada, Xigduo XR deve ser descontinuado.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica.
Uso durante amamentação
Xigduo XR não deve ser usado por mulheres que estão amamentando.
Uso em pacientes com risco de depleção de volume
Devido ao mecanismo de ação da dapagliflozina, Xigduo XR induz a diurese osmótica (suor), o que pode levar a uma redução da pressão arterial. Para pacientes com risco de depleção de volume devido a condições coexistentes, o médico poderá indicar uma dose menor de Xigduo XR. Deve-se considerar a suspensão temporária de Xigduo XR em pacientes que desenvolverem depleção de volume.
Não se espera que Xigduo XR afete a capacidade de dirigir veículos e operar máquinas.
Não foram realizados estudos sobre os efeitos na capacidade de dirigir veículos e operar máquinas.
Quais as reações adversas e os efeitos colaterais do Xigduo XR?
As reações adversas são descritos na tabela abaixo.
As frequências são definidas como:
- Muito comum (ocorre em mais de 10% dos pacientes que utilizam este medicamento);
- Comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento);
- Incomum (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento);
- Rara (ocorre entre 0,01% e 0,1% dos pacientes que utilizam este medicamento);
- Muito rara (ocorre em menos de 0,01% dos pacientes que utilizam este medicamento);
- Não conhecida (não pode ser estimada com os dados disponíveis).
Tabela 1 - Reações Adversas de pacientes tratados com dapagliflozina 10mg:
|
Sistema ou classe de órgãos / Termo preferido |
Frequência |
|
Infecções ou infestações |
|
| Infecção genitala,b |
Comum |
|
Infecções do trato urinárioa,c [cistite (infeção na bexiga), infecção dos rins, uretra ou próstata] |
Comum |
|
Disfunção do musculo esquelético e tecidos de conexão |
|
|
Dor nas costasd |
Comum |
|
Desordens renal–urinárias |
|
|
Polaciúriaa e Poliúriaa,e (aumento da produção de urina) |
Comum |
|
Distúrbios do metabolismo e nutrição |
|
|
Cetoacidose diabéticaf (produção de ácidos sanguíneos em excesso) |
Rara |
|
Distúrbios da pele e tecido subcutâneo |
|
| Erupção cutâneag,h (vermelhidão, inchaço e coceira na pele) | Desconhecida |
|
Fasciíte necrosante do períneoh (Gangrena de Fournier)i (infecção com morte do tecido da região genital que pode causar sensibilidade, vermelhidão ou inchaço na área genital, além de febre e mal-estar) |
Desconhecidai |
a Identificado de 8 estudos controlados por placebo, incluindo 2 combinações iniciais com metformina, 2 adicionais à metformina, 1 suplemento à insulina, 1 acréscimo à sitagliptina e 2 estudos com terapia adjuvante combinada.
b Vários termos de eventos adversos, incluindo infecções vulvovaginais e candidíase, balanopostite, balanite candida, abscesso peniano, infecção peniana, abscesso vulvar e vaginite bacteriana.
c Vários termos de eventos adversos, incluindo infecção do trato geniturinário, cistite, pielonefrite, trigonite, uretrite e prostatite.
d Eventos adicionais identificados dos 13 estudos controlados com placebo com dapagliflozina 10 mg incluindo 3 de monoterapia, 1 de combinação inicial com metformina, 2 com adição de metformina, 2 com adição de insulina, 1 com adição de pioglitazona, 1 com adição de sitagliptina, 1 com adição de glimepirida e 2 estudos com combinação de terapia de adição.
e Representa vários termos de eventos adversos, incluindo poliúria, aumento da produção de urina.
f Identificado a partir do estudo de desfechos cardiovasculares em pacientes com diabetes tipo 2. A frequência é baseada na taxa anual.
g Identificado durante o uso pós-comercialização de dapagliflozina. Como essas reações são relatadas voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência.
h Erupção cutânea inclui os seguintes termos preferidos, listados por ordem de frequência em ensaios clínicos: erupção cutânea, erupção cutânea generalizada, erupção cutânea pruriginosa, erupção cutânea macular, erupção cutânea maculopapular, erupção cutânea pustular, erupção cutânea vesicular, erupção eritematosa. Em ensaios clínicos controlados com placebo e ativo (Dapagliflozina, N = 5936, Controle, N = 3403), a frequência de erupção cutânea foi semelhante para Dapagliflozina (1,4%) e Controle (1,4%), respectivamente, correspondendo à frequência 'Comum'.
i Em um estudo de desfecho cardiovascular (Declare), incluindo 17160 pacientes, os pacientes randomizados para dapagliflozina apresentaram menos Gangrena de Fournier (infecção com morte do tecido da região genital que pode causar sensibilidade, vermelhidão ou inchaço na área genital, além de febre e mal-estar) em comparação com pacientes randomizados para placebo (1 versus 5).
Tabela 2 - Frequência de Reações Adversas de metformina:
|
Sistema ou classe de órgãos / Termo preferido |
Frequência |
|
Distúrbios gastrointestinais |
|
|
Sintomas gastrointestinaisa |
Muito comum |
|
Distúrbios do Sistema Nervoso |
|
|
Distúrbios do paladar |
Comum |
|
Distúrbios do metabolismo e nutrição |
|
|
Acidose lática (acúmulo de ácido lático no corpo) |
Muito rara |
|
Deficiência de vitamina B12 |
Comum |
|
Distúrbios da função hepática, hepatite (inflamação do fígado) |
Muito rara |
|
Distúrbios de pele e tecidos subcutâneos |
|
|
Urticaria, eritema e prurido (vermelhidão, inchaço e coceira na pele) |
Muito rara |
a Sintomas gastrointestinais, como náuseas, vômitos, diarreia, dor na barriga (abdominal) e perda de apetite, ocorrem com mais frequência durante o início da terapia e desaparecem espontaneamente na maioria dos casos.
Atenção: este produto é um medicamento que possui nova indicação terapêutica no país e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Neste caso, informe seu médico.
Apresentações do Xigduo XR
Xigduo XR (dapagliflozina + cloridrato de metformina) é apresentado na forma de:
- Comprimidos revestidos de liberação prolongada de 5 mg/1000 mg em embalagens com 14 e 60 comprimidos.
- Comprimidos revestidos de liberação prolongada de 10 mg/500 mg em embalagens com 14 comprimidos.
- Comprimidos revestidos de liberação prolongada de 10 mg/1000 mg em embalagens com 14 e 30 comprimidos.
Uso oral.
Uso adulto.
Qual a composição do Xigduo XR?
Cada comprimido revestido de liberação prolongada de 5 mg/1000 mg contém:
|
Dapagliflozina propanodiol |
6,15 mg (equivalente a 5 mg de dapagliflozina) |
|
Cloridrato de metformina |
1000 mg (equivalente a 780 mg de metformina base) |
Excipientes: celulose microcristalina, lactose, crospovidona, dióxido de silício, estearato de magnésio, carmelose sódica, hipromelose, álcool polivinílico, dióxido de titânio, macrogol, talco e óxido de ferro vermelho.
Cada comprimido revestido de liberação prolongada de 10 mg/500 mg contém:
|
Dapagliflozina propanodiol |
12,30 mg (equivalente a 10 mg de dapagliflozina) |
|
Cloridrato de metformina |
500 mg (equivalente a 390 mg de metformina base) |
Excipientes: celulose microcristalina, lactose, crospovidona, dióxido de silício, estearato de magnésio, carmelose sódica, hipromelose, álcool polivinílico, dióxido de titânio, macrogol, talco e óxido de ferro vermelho.
Cada comprimido revestido de liberação prolongada de 10 mg/1000 mg contém:
|
Dapagliflozina propanodiol |
12,30 mg (equivalente a 10 mg de dapagliflozina) |
|
Cloridrato de metformina |
1000 mg (equivalente a 780 mg de metformina base) |
Excipientes: celulose microcristalina, lactose, crospovidona, dióxido de silício, estearato de magnésio, carmelose sódica, hipromelose, álcool polivinílico, dióxido de titânio, macrogol, talco e óxido de ferro amarelo.
Superdose: o que acontece se tomar uma dose do Xigduo XR maior do que a recomendada?
Se você tomar uma grande quantidade de Xigduo XR, entre em contato com seu médico ou o centro de controle de intoxicações local, ou vá imediatamente para um pronto socorro mais próximo.
Em estudos com doses de dapagliflozina maiores que as recomendadas, não houve aumento nas taxas de eventos adversos incluindo desidratação (perda de líquidos) ou hipotensão (queda de pressão arterial). Não ocorreram alterações clinicamente significativas relacionadas aos exames laboratoriais incluindo eletrólitos séricos (por exemplo, sódio e potássio no sangue) e indicadores do funcionamento dos rins. A remoção da dapagliflozina por hemodiálise (filtração do sangue por equipamento) não foi estudada.
Acidose lática, condição causada pelo aumento de ácido lático no sangue pode ocorrer em casos de superdose com o cloridrato de metformina. Para casos de superdose de cloridrato de metformina, a hemodiálise (filtração do sangue por equipamento) pode ser útil. Nestes casos, o médico deve iniciar um tratamento de suporte apropriado de acordo com os sinais e sintomas clínicos do paciente.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Interação medicamentosa: quais os efeitos de tomar Xigduo XR com outros remédios?
Relate a seu médico os medicamentos que está tomando, incluindo medicamentos vendidos com ou sem prescrição médica, vitaminas e suplementos naturais. Conheça os medicamentos que você toma. Mantenha uma lista de seus medicamentos e mostre-a a seu médico e farmacêutico quando começar a tomar um novo medicamento. Avise a seu médico se você estiver tomando outros medicamentos para o diabetes, especialmente sulfonilureias (por exemplo, glibenclamida, glipizida, glimepirida, gliclazida), insulina e medicamentos catiônicos (por exemplo, amilorida, digoxina, morfina, procainamida, quinidina, quinina, ranitidina, triantereno, trimetoprima ou vancomicina).
O uso concomitante de dapagliflozina e lítio pode levar a uma redução nas concentrações do lítio no sangue devido a um possível aumento da eliminação do lítio na urina. A dose de lítio pode precisar ser ajustada.
Outras interações
Os efeitos do fumo, dieta, produtos a base de plantas, e uso de álcool sobre a farmacocinética da dapagliflozina não foram especificamente estudados. O álcool potencializa o efeito da metformina.
O uso de dapagliflozina e bumetanida juntas não alterou a excreção de sódio na urina e nem o volume urinário em indivíduos saudáveis.
A dapagliflozina não afetou a ação anticoagulante (isto é, de prevenir a formação de trombos sanguíneos que impedem sangramento) da varfarina.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamentos sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
Interação Alimentícia: posso usar o Xigduo XR com alimentos?
Ingestão de álcool
Cloridrato de Metformina
O álcool é conhecido por potencializar o efeito da metformina sobre o metabolismo do lactato. Desta forma, os pacientes devem ser advertidos contra a ingestão excessiva de álcool, aguda ou crônica, enquanto estiverem recebendo este medicamento.
Qual a ação da substância do Xigduo XR?
Resultados de Eficácia
A coadministração de Dapagliflozina + Cloridrato de Metformina foi estudada para tratamento de pacientes virgens de medicação, não controlados com dieta e exercício.
A coadministração de Dapagliflozina + Cloridrato de Metformina foi estudada em pacientes com diabetes tipo 2 inadequadamente controlados com uso de metformina isoladamente ou em combinação com inibidor da DPP4 (com ou sem metformina) ou insulina (com ou sem outro antidiabético oral) e comparado com uma sulfonilureia em combinação com metformina em pacientes com controle glicêmico inadequado com uso de metformina isoladamente.
O tratamento com Dapagliflozina + Cloridrato de Metformina em todas as doses produziu melhora clinicamente relevante e estatisticamente significativa na HbA1c e glicemia de jejum, comparado ao controle, na 24º semana. Esses efeitos glicêmicos clinicamente relevantes foram mantidos nas extensões de longo prazo até 208 semanas. Reduções na HbA1c foram vistas entre os subgrupos incluindo o sexo, idade, raça, duração da doença e IMC basal. Além disso, na semana 24, melhora clinicamente relevante e estatisticamente significativa nas variações médias em relação ao basal no peso corporal foram observadas nos tratamentos combinados de dapagliflozina e metformina comparados ao controle. As reduções no peso corporal foram mantidas nas extensões de longo prazo até 208 semanas. Em um estudo clínico especial, a diminuição no peso foi atribuída principalmente a uma redução na massa corporal gorda, conforme medido por DXA (absorciometria por dupla emissão de raios-X). Adicionalmente, o tratamento com a dapagliflozina, duas vezes ao dia, combinado à metformina se mostrou eficaz e seguro em pacientes com diabetes tipo 2.
Além disso, dapagliflozina 10 mg ou placebo foram estudadas em pacientes diabéticos tipo 2 com doença cardiovascular (aproximadamente 37% dos pacientes de 2 estudos receberam dapagliflozina 10 mg ou placebo mais metformina sozinha [com ou sem insulina]). Em dois estudos de dapagliflozina 10 mg em pacientes com diabetes tipo 2 e com doença cardiovascular, melhorias estatisticamente significativas na HbA1c e reduções significativas no peso corporal e pressão arterial sistólica quando sentados foram vistos na semana 24 nos pacientes tratados com 10 mg de dapagliflozina em comparação com os pacientes tratados com placebo, e foram mantidas até a semana 104.
Nestes estudos, a dapagliflozina e o cloridrato de metformina foram administrados separadamente. Entretanto, demonstrou-se bioequivalência entre Dapagliflozina + Cloridrato de Metformina e os comprimidos de dapagliflozina e cloridrato de metformina de liberação prolongada coadministrados.
Nos estudos clínicos realizados com os medicamentos administrados separadamente (coadministração) foram utilizados tanto a metformina de liberação imediata quanto a metformina de liberação prolongada. Somente estudos de biodisponibilidade relativa entre Dapagliflozina + Cloridrato de Metformina e a coadministração de comprimidos de Dapagliflozina + Cloridrato de Metformina de liberação prolongada foram realizados.
Coadministração de dapagliflozina com metformina em pacientes virgens de tratamento
Terapia de Combinação Inicial com metformina XR
Um total de 1241 pacientes virgens de tratamento com diabetes tipo 2 inadequadamente controlado (HbA1c ≤ 7,5% e ≤ 12%) participaram de dois estudos com controle ativo de 24 semanas de duração para avaliar a eficácia e segurança da terapia inicial com 5 mg ou 10 mg de dapagliflozina em combinação com a formulação de metformina de liberação prolongada (XR).
Em um estudo, 638 pacientes foram randomizados para um dos três braços de tratamento após um período de introdução de 1 semana: dapagliflozina 10 mg combinado com metformina XR (até 2000 mg por dia), dapagliflozina 10 mg combinado com placebo, ou metformina XR (até 2000 mg por dia) combinado com placebo. A dose de metformina era aumentada semanalmente em incrementos de 500 mg, conforme tolerada, com uma dose mediana atingida de 2000 mg.
O tratamento da combinação de dapagliflozina 10 mg mais metformina proporcionou redução significativa na HbA1c e na glicemia de jejum (FPG), comparado com cada um dos tratamentos de monoterapia e redução significativa no peso corporal comparado à metformina isoladamente (Tabela 1, Figuras 1 e 2). A dapagliflozina 10 mg como monoterapia também proporcionou redução significativa na glicemia de jejum e peso corporal comparado com a metformina isolada e foi não inferior à monoterapia com metformina na redução da HbA1c. A proporção de pacientes que necessitaram de medicação de resgate ou foram descontinuados por falta de controle glicêmico durante o período de tratamento duplo-cego de 24 semanas (ajustado para a HbA1c basal) foi maior durante o tratamento com metformina combinado com placebo (13,5%) que durante dapagliflozina 10 mg combinado com placebo e dapagliflozina 10 mg combinado com metformina (7,8%, e 1,4%, respectivamente).
Tabela 1. Resultados na Semana 24 (LOCF* ) em um Estudo com Controle Ativo da Terapia de Combinação Inicial de Dapagliflozina + Cloridrato de Metformina XR
|
Parâmetro de Eficácia |
Dapagliflozina 10 mg + Metformina XR N=211† | Dapagliflozina 10 mg N=219† |
Metformina XR N=208† |
|
HbA1c (%) |
|||
|
Basal (média) |
9,10 | 9,03 |
9,03 |
|
Variação em relação ao basal (média ajustada‡ ) |
−1,98 | −1,45 |
−1,44 |
|
Diferença em relação à dapagliflozina (média ajustada‡ ) (IC 95%) |
−0,53§ (−0,74; −0,32) | - | - |
|
Diferença em relação à metformina (média ajustada‡ ) (IC 95%) |
−0,54§ (−0,75; −0,33) | −0,01¶ (−0,22; 0,20) | - |
|
Percentual de pacientes que atingiu HbA1c <7%. Ajustado para o basal |
46,6%# |
31,7% |
35,2% |
|
Variação em relação ao basal na HbA1c em pacientes com HbA1c basal ≥9% (média ajustada‡ ) |
−2,59# | −2,14 |
−2,05 |
|
Glicemia de jejum (mg/dL) |
|||
|
Basal (média) |
189,6 | 197,5 |
189,9 |
|
Variação em relação ao basal (média ajustada‡ ) |
−60,4 |
−46,4 |
−34,8 |
|
Diferença em relação à dapagliflozina (média ajustada‡ ) (IC 95%) |
−13,9§ (−20,9; −7,0) |
- | - |
|
Diferença em relação à metformina (média ajustada‡ ) (IC 95%) |
−25,5§ (−32,6; −18,5) |
−11,6¶ (−18,6; −4,6) | - |
|
Peso Corporal (kg) |
|||
|
Basal (média) |
88,56 | 88,53 |
87,24 |
|
Variação em relação ao basal (média ajustada‡ ) |
−3,33 | −2,73 |
−1,36 |
|
Diferença em relação à metformina (média ajustada‡ ) (IC 95%) |
−1,97§ (−2,64; −1,30) | −1,37§ (−2,03; −0,71) | - |
*LOCF: última observação avançada (antes do uso de medicação de resgate para os pacientes que necessitaram de resgate).
† Todos os pacientes randomizados que tomaram pelo menos uma dose do medicamento do estudo durante o período duplo-cego de curta duração.
‡ Média dos quadrados mínimos ajustada para o basal.
§ Valor de p < 0,0001.
¶ Não inferior versus metformina.
# Valor de p <0,05.
Figura 1: Variação da Média Ajustada da HbA1c em Relação ao Basal ao Longo do Tempo (LOCFa ) em um Estudo com Controle Ativo de 24 Semanas da Terapia Combinada Inicial de Dapagliflozina com Metformina XR

Figura 2: Variação da Média Ajustada de Peso Corporal Total (Kg) em Relação ao Basal ao Longo do Tempo (LOCFa ) em um Estudo Com Controle Ativo de 24 Semanas da Terapia Combinada Inicial de Dapagliflozina com Metformina XR

Pacientes randomizados que receberam pelo menos uma dose da medicação do estudo duplo–cego.
Valor médio baseado no modelo ANCOVA com o grupo de tratamento como valores covariantes efetivos e basais.
LOCF: última observação avançada (antes do uso de medicação de resgate para os pacientes que necessitaram de resgate).
As barras de erro representam os intervalos de confiança de 95% para a variação da média ajustada em relação ao basal.
Outro estudo de 24 semanas que avaliou dapagliflozina 5 mg mais metformina XR mostrou melhorias clinicamente relevantes e estatisticamente significativas nos parâmetros glicêmicos versus dapagliflozina 5 mg em monoterapia e metformina XR em monoterapia.
Adição de dapagliflozina à metformina IR
Um total de 546 pacientes com diabetes tipo 2 com controle glicêmico inadequado (HbA1c ≤7% e 10%) participou de um estudo controlado com placebo de 24 semanas com um período de extensão cego controlado de 78 semanas para avaliar a dapagliflozina em combinação com metformina. Os pacientes em uso de metformina em uma dose de pelo menos 1500 mg por dia foram randomizados depois de completar o período de introdução de placebo simples-cego de 2 semanas. Após o período de introdução, os pacientes elegíveis foram randomizados para dapagliflozina 2,5 mg, 5 mg ou 10 mg, ou placebo em adição à sua dose atual de metformina.
Como tratamento de adição à metformina, dapagliflozina 10 mg proporcionou melhora significante na HbA1c, glicemia de jejum, e peso corporal comparado com o placebo na semana 24 (Tabela 2). Na Semana 102, a variação da média ajustada em relação ao basal na HbA1c (Figura 3), glicemia de jejum e peso corporal foi −0,78%, −24,5 mg/dL e −2,81 kg, respectivamente, para os pacientes tratados com dapagliflozina 10 mg combinado com metformina e 0,02%, −10,4 mg/dL e −0,67 kg, respectivamente, para os pacientes tratados com placebo combinado com metformina com base na análise das medidas repetidas longitudinais excluindo os dados após o uso de medicação de resgate. A proporção de pacientes que necessitou de resgate ou foi descontinuada por falta de controle glicêmico durante o período de tratamento duplo-cego de 24 semanas (ajustado para a HbA1c basal) foi maior no grupo placebo combinado com metformina (15,0%) que no grupo dapagliflozina 10 mg combinado com metformina (4,4%). Próximo à semana 102 (ajustado para a HbA1c basal), mais pacientes usando placebo combinado com metformina (60,1%) precisaram de terapia de resgate quando comparado aos pacientes usando dapagliflozina 10 mg combinado metformina (44,0%).
Tabela 2: Resultados de um estudo de 24 semanas (LOCF* ) controlado com placebo de dapagliflozina em adição combinada com metformina
| Parâmetro de Eficácia | dapagliflozina 10 mg + metformina N=135† | Placebo + metformina N=137† |
| HbA1c (%) | ||
| Média basal | 7,92 | 8,11 |
| Variação em relação ao basal (média ajustada‡) | −0,84 | -0,30 |
| Diferença em relação ao placebo (média ajustada‡ ) (IC de 95%) |
−0,54§ (−0,74, −0,34) |
- |
| Percentual de pacientes que atingiu HbA1c <7% ajustado para o basal | 40,6%¶ | 25,9% |
| Variação em relação ao basal na HbA1c em pacientes com HbA1c basal ≥9% (média ajustada‡) |
−1,32¶ (N= 18) |
−0,53 (N= 22) |
| FPG (mg/dL) | ||
| Média basal | 156,0 | 165,6 |
| Variação em relação ao basal na semana 24 (média ajustada‡) | −23,5 | −6,0 |
| Diferença em relação ao placebo (média ajustada‡) (IC de 95%) |
−17,5§ (−25,0, −10,0) |
- |
| Variação desde o basal na semana 1 (média ajustada‡) |
−16,5§ (N=115) |
1,2 (N=126) |
| Peso Corporal (kg) | ||
| Média basal | 86,28 | 87,74 |
| Variação em relação ao basal (média ajustada‡) | −2,86 | −0,89 |
| Diferença em relação ao placebo (média ajustada‡) (IC de 95%) |
−1,97§ (−2,63, −1,31) |
- |
* LOCF: última observação avançada (antes do uso de medicação de resgate para pacientes necessitaram de resgate).
† Todos os pacientes randomizados que tomaram pelo menos uma dose do medicamento do estudo durante o período de tratamento duplo-cego de curto prazo.
‡ Média dos quadrados mínimos ajustada para o valor basal.
§ Valor de p <0,00001 vs placebo + metformina.
¶ Valor de p <0,05 vs placebo + metformina.
Figura 3: Variação da Média Ajustada em relação ao Basal de HbA1c ao Longo do Tempo em um Estudo Controlado com Placebo de 102 Semanas de Dapagliflozina em Combinação com Metformina (Análise de Medidas Repetidas Longitudinais, Excluindo os Dados Após Terapia de Resgate)
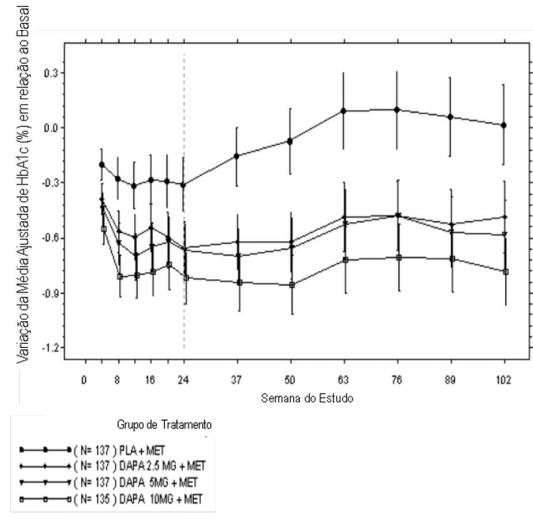
As barras de erro representam os intervalos de confiança de 95% para a variação da média ajustada em relação ao basal.
Estudo de Adição à Metformina IR Controlado com Glipizida Ativa
Um total de 816 pacientes com diabetes tipo 2 com controle glicêmico inadequado (HbA1c >6,5% e ≤10%) foi randomizado em estudo de não inferioridade de 52 semanas, controlado com glipizida, de com um período de extensão de 156 semanas, para avaliar dapagliflozina como terapia de adição à metformina. Os pacientes em uso de metformina numa dose de pelo menos 1500 mg por dia foram andomizados após um período de introdução de placebo de 2 semanas para glipizida ou dapagliflozina (5 mg ou 2,5 mg, respectivamente) e foram titulados ao longo de 18 semana até o efeito glicêmico ótimo (glicemia de jejum <110 mg/dL, <6,1 mmol/L) ou para o maior nível de dose (até glipizida 20 mg e dapagliflozina 10 mg) conforme tolerado pelos pacientes. A partir desse momento, as doses foram mantidas constantes, exceto para diminuição da dose para prevenção de hipoglicemia. Terapia de resgate para ausência de controle glicêmico não foi disponibilizada neste estudo até a semana 104, mas foi introduzida, de acordo com a necessidade, entre as semanas 105 e 208.
Ao final do período de titulação, 87% dos pacientes tratados com dapagliflozina tinham sido titulados para a dose máxima do estudo (10 mg), versus 73% dos tratados com glipizida (20 mg). A dapagliflozina levou a uma redução média semelhante na HbA1c em relação ao basal até a semana 52 (LOCF), comparado com glipizida, demonstrando assim não inferioridade (Tabela 3). O tratamento com dapagliflozina levou a uma redução média significativa no peso corporal em relação ao basal até a semana 52, comparado com o aumento médio no peso corporal no grupo glipizida.
Nas semanas 104 e 208, a variação da média da HbA1c ajustada em relação ao basal foi de −0,32% e -0,10%, respectivamente; e a alteração do peso corporal foi de −3,70 kg e -3,95 Kg, respectivamente, para os pacientes tratados com dapagliflozina; e variação da média ajustada de HbA1c em relação ao basal foi de −0,14% e -0,20%, respectivamente, e alteração do peso corporal foi de 1,36 kg e 1,12 kg, respectivamente, para os pacientes tratados com glipizida, com base na análise de medidas repetidas longitudinais (Figuras 4 e 5). O percentual de pacientes que atingiu perda de peso de ≥5% (ajustado) nas semanas 104 e 208 foi de 23,8% e 10,2%, respectivamente, para os pacientes tratados com dapagliflozina; e 2,8% e 1,8%, respectivamente, para os pacientes tratados com glipizida.
Nas semanas 52, 104 e 208, a proporção de pacientes que descontinuou ou foram resgatados por falta de controle glicêmico (ajustada para a HbA1c basal) foi maior com glipizida combinado com metformina (3,6%, 21,6% e 44,9%, respectivamente) do que com a dapagliflozina combinado com metformina (0,2%, 14,5% e 39,4% respectivamente). Em 52, 104 e 208 semanas, respectivamente, uma proporção significativamente menor de pacientes em uso de dapagliflozina (3,5%, 4,3% e 5,0%) apresentou pelo menos um evento de hipoglicemia quando comparado com a glipizida (40,8%, 47,0% e 50,0%).
Tabela 3: Resultados na Semana 52 (LOCF* ) em um Estudo com Controle Ativo Comparando a Dapagliflozina à Glipizida como Terapia de Adição à Metformina
| Parâmetro de Eficácia | Dapagliflozina +Metformina N=400† | Glipizida +Metformina N=401† |
| HbA1c (%) | ||
| Basal (média) | 7,69 | 7,74 |
| Variação em relação ao basal (média ajustada‡) | −0,52 | −0,52 |
| Diferença de glipizida+metformina (média ajustada‡) | 0,00§ | - |
| (IC de 95%) | (−0,11, 0,11) | - |
| Peso Corporal (kg) | ||
| Basal (média) | 88,44 | 87,60 |
| Variação em relação ao basal (média ajustada‡) | −3,22 | 1,44 |
| Diferença de glipizida+metformina (média ajustada‡) | −4,65¶ | - |
| (IC de 95%) | (−5,14, −4,17) | - |
| Percentual de pacientes que atingiu perda de peso ≥5% (ajustado) |
33,3%¶ |
2,5% |
| (IC de 95%) | (28,7, 37,9) | (1,0, 4,0) |
* LOCF: última observação avançada.
† Pacientes randomizados e tratados com basal e pelo menos uma medida de eficácia pós-basal.
‡ Média dos quadrados mínimos ajustada para o valor basal. § Não inferior a glipizida + metformina
¶ Valor de p <0,0001.
Figura 4: Variação da Média Ajustada de HbA1c (%) em relação ao Basal ao Longo do Tempo na em um Estudo de 208 Semanas com Controle Ativo Comparando Dapagliflozina a Glipizida como Terapia de Adição à Metformina (Análise de Medidas Repetidas Longitudinais,)
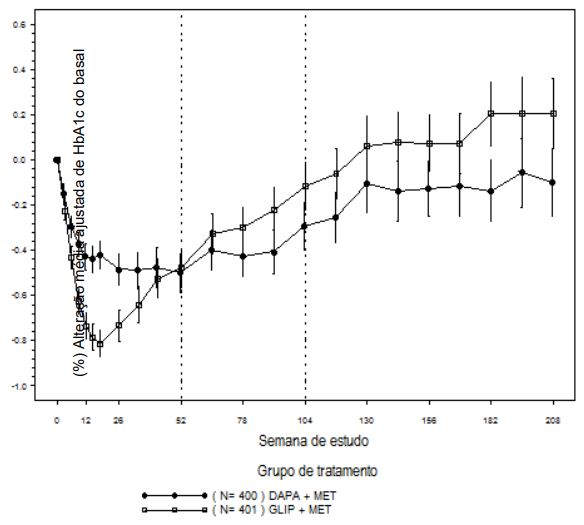
As barras de erro representam os intervalos de confiança de 95% para a variação da média ajustadelação ao basal.
Figura 5: Variação da Média Ajustada do Peso Corporal em relação ao Basal ao Longo do Tempo em um Estudo de 208 Semanas com Controle Ativo Comparando Dapagliflozina a Glipizida como Adição à Metformina (Análise de Medidas Repetidas Longitudinais,)

As barras de erro representam os intervalos de confiança de 95% para a variação da média ajustada em relação ao basal.
Figura 5: Variação da Média Ajustada do Peso Corporal em relação ao Basal ao Longo do Tempo em um Estudo de 208 Semanas com Controle Ativo Comparando Dapagliflozina a Glipizida como Adição à Metformina (Análise de Medidas Repetidas Longitudinais,)
As barras de erro representam os intervalos de confiança de 95% para a variação da média ajustada em relação ao basal.
Adição à sitagliptina isolada ou em combinação com metformina IR
Um total de 452 pacientes com diabetes tipo 2 que eram virgens de medicação, ou que eram tratados inicialmente com metformina ou um inibidor da DPP4 isoladamente ou em combinação, e que tinha controle glicêmico inadequado (HbA1c ≥7,0% e ≤10,0% na randomização), foi randomizado neste estudo de 24 semanas, controlado com placebo com um período de extensão de 24 semanas para avaliar a dapagliflozina em combinação com sitagliptina (um inibidor da DPP4) isoladamente ou em combinação com metformina.
Os pacientes elegíveis foram estratificados com base na presença ou ausência de metformina de base (≥1500 mg/dia) e dentro de cada estrato foram randomizados para dapagliflozina 10 mg combinado com sitagliptina 100 mg, uma vez ao dia, ou placebo combinado sitagliptina 100 mg uma vez ao dia. Duzentos e vinte e seis (226) pacientes foram analisados no estrato sitagliptina com metformina, 113 pacientes receberam dapagliflozina 10 mg com sitagliptina e metformina, e 113 pacientes receberam placebo com sitagliptina e metformina. A titulação da dose de dapagliflozina, sitagliptina ou metformina não era permitida durante o estudo.
Em pacientes que receberam sitagliptina, metformina e dapagliflozina 10 mg houve redução significativa de HbA1c, HbA1c nos pacientes com HbA1c ≥8% no basal, glicemia de jejum e peso corporal comparado com o grupo placebo na semana 24 (ver Tabela 4).
Na semana 48, a variação da média ajustada em relação ao basal na HbA1c, HbA1c em pacientes com HbA1c ≥8% no basal (não ajustada), Glicemia de jejum, Glicemia pós prandial, e peso corporal foi de −0,44%, −1,05 %, −23,7 mg/dL, −47,2 mg/dL, e −2,53 kg, respectivamente, para os pacientes tratados com dapagliflozina 10 mg combinado com sitagliptina e metformina, e 0,15%, −0,54 %, 6,3 mg/dL, −18,6 mg/dL, e −0,45 kg, respectivamente, para os pacientes tratados com placebo combinado com sitagliptina e metformina com base na análise de medidas repetidas longitudinais, excluindo os dados após o resgate.
Tabela 4: Resultados de Estudo de 24 Semanas (LOCF*) Controlado com Placebo de Sapagliflozina em Adição Combinada à Sitagliptina (Estratos com metformina)
| Parâmetro de Eficácia | dapagliflozina 10 mg +sitagliptina +metformina N=113† | Placebo +sitagliptina +metformina N=113† |
| HbA1c (%) | ||
| Basal (média) | 7,80 | 7,87 |
| Variação em relação ao basal (média ajustada‡) | −0,43 | −0,02 |
|
Diferença em relação ao placebo (média ajustada‡) (IC de 95%) |
−0,40§ (-0,58, -0,23)
|
- |
| Variação em relação ao basal na HbA1c em pacientes com HbA1c ≥8% no basal (média ajustada‡) |
−0,79§ (N = 39) |
0,0 (N = 43) |
| Glicemia de jejum (mg/dL) | ||
| Basal (média) | 165,9 | 164,7 |
| Variação em relação ao basal na Semana 24 (média ajustada‡) | -26,2 | 3,0 |
|
Diferença em relação ao placebo (média ajustada‡) (IC de 95%) |
−29,2§ (−38,0, −20,4) |
- |
| Peso corporal (Kg) | ||
| Basal (média) | 93,95 | 94,17 |
| Variação em relação ao basal (média ajustada‡) | −2,35 | −0,47 |
|
Diferença em relação ao placebo (média ajustada‡) (IC de 95%) |
−1,87§ (−2,61, −1,13) |
- |
| PAS sentado na Semana 8 em pacientes com PAS sentada no basal ≥130 mmHg (mmHg) | ||
| Basal (média) | 141,9 | 140,3 |
| Variação em relação ao basal (média ajustada‡) | −5,3 | −5,5 |
|
Diferença em relação ao placebo (média ajustada‡) (IC de 95%) |
0,2 (−3,85, 4,32) |
- |
| Glicose pós prandial de 2 horas ¶ (mg/dL) | ||
| Basal (média) | 230,2 |
221,0 |
| Variação em relação ao basal (média ajustada‡) | −48,9 | −7,2 |
|
Diferença em relação ao placebo (média ajustada‡) (IC de 95%) |
−41,6 (−55,4, −27,8) |
- |
| Pacientes com redução na HbA1c ≥ 0,7% (% ajustado) | 28,0 | 16,0 |
* LOCF: última observação avançada (antes do uso de medicação de resgate nos pacientes que necessitaram de resgate).
† Pacientes randomizados e tratados com medida basal e pelo uma medida de eficácia pósbasal.
‡ Média dos quadrados mínimos ajustada para o valor basal.
§ valor de p <0,0001 versus placebo.
¶ Nível de glicose pós-prandial de 2 horas como uma resposta a um teste oral de tolerância de à glicose com 75 gramas (TOTG).
Terapia de Ação Combinada com insulina
Um total de 808 pacientes com diabetes tipo 2 que tinham controle glicêmico inadequado (HbA1c ≥7,5% e ≤10,5%) foi randomizado neste estudo de 24 semanas, controlado com placebo com um período de extensão de 80 semanas para avaliar a dapagliflozina como terapia de adição à insulina. Pacientes em um regime estável de insulina, com uma dose média de pelo menos 30 UI de insulina injetável por dia, por um período de pelo menos 8 semanas anteriores, e no máximo com dois OADs incluindo metformina foram randomizados depois de completar um período de inclusão de 2 semanas para receber dapagliflozina 2,5 mg, 5 mg, ou 10 mg, ou placebo em adição à sua dose atual de insulina e outros OADs, se apropriado. Os pacientes foram estratificados de acordo com a presença ou ausência de OADs de base. A titulação da dose da insulina para maior ou menor era permitida apenas durante a fase de tratamento nos pacientes que não conseguiram atingir as metas glicêmicas específicas. As modificações na dose do medicamento do estudo cego ou OADs não eram permitidas durante a fase de tratamento do estudo, com exceção da diminuição dos OADs quando houvesse preocupação com hipoglicemia após a parada da terapia com insulina.
Neste estudo, 50% dos pacientes estavam em uso de 1 ou 2 OADs além da insulina; desses, 80% estavam em uso de metformina isolada e 14% estavam em uso de metformina mais outro OAD. Na semana 24, a dose de dapagliflozina de 10 mg proporcionou melhora significativa na HbA1c, FPG, dose média de insulina e redução significativa no peso corporal quando comparado com o placebo em combinação com insulina, com ou sem até 2 OADs (ver tabela 5); o efeito da dapagliflozina na HbA1c foi semelhante nos pacientes em uso isolado de insulina e nos pacientes em uso de insulina mais OADs. Na semana 48 e 104, a variação da média ajustada em relação ao basal na HbA1c foi de –0,93% e -0,71%; no FPG foi de -21,5 mg/dL e -18,2 mg/dL; e no peso corporal foi de −1,79 kg e - 1,97 kg, respectivamente, para os pacientes tratados com dapagliflozina 10 mg mais insulina; e a variação da média ajustada em relação ao basal na HbA1c foi de −0,43% e 0,06%, no FPG foi de −4,4 mg/dL e -11,2 mg/dL, e no peso corporal foi de −0,18 kg e 0,91 kg, respectivamente, para os pacientes tratados com placebo mais insulina (ver Figura 6).
Na semana 24, uma proporção significativamente maior de pacientes em uso de dapagliflozina 10 mg pôde reduzir a dose da insulina em pelo menos 10% comparado com o placebo. A proporção de pacientes que precisou aumentar a dose da insulina ou ser descontinuado devido à falta de controle glicêmico (ajustada para a HbA1c basal) foi maior no grupo placebo mais insulina (29,2%) que no grupo dapagliflozina 10 mg mais insulina (9,7%). Nas semanas 48 e 104, a dose da insulina permaneceu estável comparada com o basal nos pacientes tratados com dapagliflozina 10 mg numa dose média de 76 UI/dia, mas continuou a aumentar (aumento médio de 10,5 UI/dia e 18,3 UI/dia, respectivamente, em relação ao basal) nos pacientes tratados com placebo. Nas semanas 48 e 104 (ajustada da HbA1C basal), mais pacientes em uso de placebo (42,8% e 50,4%, respectivamente) precisou aumentar a dose de insulina para manter os níveis glicêmicos ou foram descontinuados devido à falta de controle glicêmico que nos pacientes em uso de dapagliflozina 10 mg (15,3% e 25,5%, respectivamente).
Em uma análise separada de pacientes em uso de insulina mais metformina IR isolada, melhoras semelhantes àquelas observadas na população total do estudo foram observadas nos pacientes tratados com dapagliflozina mais insulina com metformina na HbA1c, peso corporal, e dose média de insulina quando comparado com o placebo mais insulina com metformina na Semana 24 (Tabela 5).
Tabela 5: Resultados do Estudo de 24 Semanas (LOCF*) Controlado com Placebo de dapagliflozina em Combinação com insulina com ou sem até 2 Terapias Antidiabéticas Orais
| Parâmetro de Eficácia | Dapagliflozina 10 mg | Placebo |
| População Intenção de tratar | N=194†‡ | N=193†‡ |
| HbA1c(%) | ||
| Basal (média) | 8,58 | 8,46 |
| Variação em relação ao basal (média ajustada§) | −0,90 | −0,30 |
|
Diferença em relação ao placebo (média ajustada§) (IC de 95%) |
−0,60¶ (−0,74, −0,45) |
- |
| Pacientes que recebiam insulina + metformina isoladamente** | N=83 | N=77 |
| HbA1c (%) | ||
| Basal (média) | 8,52 | 8,43 |
| Variação em relação ao basal (média ajustada§) | −0,93 | −0,31 |
|
Diferença em relação ao placebo (média ajustada§) (IC de 95%) |
−0,61 (−0,83, −0,40) |
- |
| População Intenção de tratar | N=194†‡ | N=193†‡ |
| Dose Média Diária de Insulina (UI)†† | ||
| Basal (média) | 77,96 | 73,96 |
| Variação em relação ao basal (média ajustada§) | −1,16 | 5,08 |
|
Diferença em relação ao placebo (IC de 95%) |
−6,23¶ (−8,84, −3,63) |
- |
| Percentual de pacientes com redução na dose média diária de insulina de pelo menos 10% ajustada para o basal | 19,7%# | 11,0% |
| Pacientes que recebiam insulina + metformina isoladamente** | N=83 | N=77 |
| Dose Média Diária de Insulina (UI) †† | ||
| Basal (média) | 79,75 | 82,14 |
| Variação em relação ao basal (média ajustada§) | −1,70 | 3,46 |
|
Diferença em relação ao placebo (IC de 95% ) |
−5,15 (−9,06, −1,25) |
- |
| Percentual de pacientes com redução na dose média diária de insulina de pelo menos 10% ajustada para o basal | 19,0% | 13,1% |
| População Intenção de tratar | N=194†‡ | N=193†‡ |
| FPG (mg/dL) | ||
| Basal (média) | 173,7 | 170,0 |
| Variação em relação ao basal (média ajustada§) | −21,7 |
3,3 |
|
Diferença em relação ao placebo (média ajustada§) (IC de 95%) |
−25,0¶ (−34,3, −15,8) |
- |
| Pacientes que receberam insulina + metformina isoladamente** | N=83 | N=77 |
| FPG (mg/dL) | ||
| Basal (média) | 173,8 | 166,3 |
| Variação em relação ao basal (média ajustada§) | −25,7 | 11,4 |
|
Diferença em relação ao basal (média ajustada§) (IC de 95%) |
−37,1 (−50,4, −23.8) |
- |
| População Intenção de tratar | N=194†‡ | N=193†‡ |
| Peso Corporal (kg) | ||
| Basal (média) | 94,63 | 94,21 |
| Variação em relação ao basal (média ajustada§) | −1,67 | 0,02 |
|
Diferença em relação ao basal (média ajustada§) (IC de 95%) |
−1,68¶ (−2,19, −1,18) |
- |
| Pacientes que receberam insulina + metformina isoladamente** | N=83 | N=77 |
| Peso Corporal (kg) | ||
| Basal (média) | 95,68 | 98,69 |
| Variação em relação ao basal (média ajustada§) | −1,77 | −0,06 |
|
Diferença em relação ao basal (média ajustada§) (IC de 95%) |
−1,71 (−2,47, −0,95) |
- |
* LOCF: última observação avançada (antes do resgate para pacientes resgatados).
† Pacientes randomizados e tratados com medida basal e pelo menos uma medida de eficácia pósbasal.
‡ 50% dos pacientes estavam em uso de monoterapia com insulina no basal.
§ Média dos quadrados mínimos ajustada para o valor basal.
** Análise post-hoc.
¶ Valor de p <0,0001 versus placebo.
# Valor de p <0,05 versus placebo.
Figura 6: Variação da Média Ajustada em relação ao Basal ao Longo do Tempo na HbA1c (%) no Estudo de 104 Semanas controlado com Placebo de dapagliflozina em Combinação com insulina com ou sem até 2 Terapias Antidiabéticas Orais Excluindo os Dados Após Aumento da Dose da insulina (Titulação)

As barras de erro representam os intervalos de confiança de 95% para a variação da média ajustada em relação ao placebo.
Estudos de Apoio
Uso em pacientes com diabetes tipo 2 e doença cardiovascular
Em dois estudos de 24 semanas, controlados por placebo, com períodos de extensão de 80 semanas, um total de 1887 pacientes com diabetes do tipo 2 e doença cardiovascular (DCV) foram tratados com dapagliflozina 10 mg ou placebo.
Os pacientes com DCV estabelecida e controle glicêmico inadequado (HbA1c ≥ 7.0% e ≤10.0%), apesar do tratamento pré-existente estável com antidiabéticos orais ou insulina (isoladamente ou em combinação) antes da entrada, foram elegíveis para estes estudos e foram estratificados de acordo com a idade ( 1 ano ou <1 ano antes do recrutamento). Dentre os 2 estudos, 942 pacientes foram tratados com dapagliflozina 10 mg e 945 com o placebo. Noventa e seis por cento (96%) dos pacientes tratados com 10 mg de dapagliflozina em ambos os estudos tinham hipertensão desde a entrada no estudo, a maioria por mais de 10 anos; os eventos cardiovasculares qualificados mais comuns foram doença cardíaca coronária (75%) e acidente vascular cerebral (22%). Cerca de 19% dos pacientes receberam diuréticos de alça no início do estudo e 15% tinham insuficiência cardíaca congestiva (2% tinha classe NYHA III). Aproximadamente 37% dos pacientes tratados com dapagliflozina 10 mg também receberam metformina e um antidiabético oral adicional (sulfonilureias, tiazolidinedionas, inibidor de DPP4, ou outro antidiabético oral com ou sem insulina no início do estudo), 39% receberam insulina e pelo menos mais um antidiabético oral, e 18% receberam insulina apenas.
Na semana 24, para ambos os estudos, quando adicionado aos tratamentos antidiabéticos pré- existente, o tratamento com dapagliflozina 10 mg propiciou melhora significativa para os endpoints co-primários HbA1c e benefício clínico múltiplo em comparação com placebo. O benefício clínico múltiplo foi definido como a proporção de pacientes com uma queda absoluta da linha de base de 0,5% na HbA1c, queda relativa da linha de base de pelo menos 3% do peso corpóreo total, e uma queda absoluta de linha de base de pelo menos 3 mm Hg na pressão arterial sistólica quando sentado (Tabela 6). Reduções significativas no peso corpóreo total e pressão arterial sistólica quando sentado também foram observados em pacientes tratados com 10 mg de dapagliflozina em comparação com placebo.
Em uma análise separada dos pacientes tratados com metformina em monoterapia (com ou sem insulina) nestes dois estudos, melhorias semelhantes na HbA1c e redução percentual do peso foram observadas na população total do estudo para os pacientes tratados com 10 mg de dapagliflozina mais metformina em monoterapia em comparação com placebo mais metformina em monoterapia na semana 24. A redução média na pressão sanguínea sistólica foi observada para pacientes sentados, sendo consistente com o observado no estudo da população total de pacientes tratados com dapagliflozina 10 mg mais metformina isoladamente, em comparação com placebo mais metformina isoladamente na semana 24 no Estudo 1, mas não no Estudo 2.
Na semana 52 e semana 104 para Estudo 1, a variação da média ajustada para a HbA1c, da pressão arterial sistólica quando sentado, e alteração percentual ajustada a partir da linha de base para peso corporal foram -0,44% e -0,41%, -3.40 mmHg e -2.64 mmHg, e -2,89% e -3,53%, respectivamente, para os pacientes tratados com 10 mg de dapagliflozina mais o tratamento habitual com base na análise das medidas repetidas longitudinais. Os valores correspondentes para os pacientes tratados com placebo mais tratamento usual foram 0,22% e 0,50%, 0,18 mmHg e 1,54 mmHg, e -0,29% e - 0,02%. Nas semanas 52 e 104, o percentual do benefício clínico múltiplo ainda foi maior no grupo da dapagliflozina 10 mg (6,6% e 3,8%) do que no grupo do placebo (0,7% e 0,5%).
Nas semanas 24, 52 e 104 para o Estudo 1, a proporção de pacientes que foram resgatados por falta de controle glicêmico (ajustado para HbA1c da linha de base) foi maior no grupo tratado com placebo mais tratamento habitual (24,0%, 51,8%, e 57,3%, respectivamente) do que no grupo dapagliflozina 10 mg mais tratamento habitual (7,8%, 24,6%, e 31,8%, respectivamente).
Na semana 52 e na semana 104 para Estudo 2, a média ajustada da variação da linha de base da HbA1c, pressão arterial sistólica quando sentado, e a alteração percentual ajustada a partir da linha de base para peso corporal foram -0,47% e -0,37%, -3.56 mmHg e -1.96 e mmHg, e -3,20% e -3,51%, respectivamente, para os pacientes tratados com 10 mg de dapagliflozina mais o tratamento habitual, baseados na análise longitudinal de medidas repetidas.
Os valores correspondentes para os pacientes tratados com placebo mais tratamento usual foram 0,03% e -0,18%, -0.91 mmHg e -0.37 e mmHg, e - 1,12% e -0.65%. Na semana 52 e semana 104, o percentual de benefício clínico múltiplo ainda foi maior no grupo tratado com dapagliflozina 10 mg (10,6% e 4,2%) do que no grupo tratado com placebo (3,1% e 1,1%). Na semana 24, semana 52 e semana 104 para Estudo 2, a proporção de pacientes resgatados por falta de controle glicêmico (ajustado para HbA1c da linha de base) foi maior no grupo com placebo mais tratamento habitual (22,3%, 43,6%, e 50,5%, respectivamente) do que no grupo com dapagliflozina 10 mg mais tratamento habitual (7,6%, 18,7%, e 27,5%, respectivamente).
Tabela 6. Resultados na semana 24 (LOCF *) em dois estudos controlados por placebo comparando dapagliflozina e placebo em doentes com diabetes tipo 2 e doença cardiovascular
| - | Estudo 1 |
Estudo 2 |
||
|
Parâmetro de Eficácia |
Dapagliflozina 10 mg + tratamento usual | Placebo + tratamento usual | Dapagliflozina 10 mg + tratamento usual |
Placebo + tratamento usual |
| - | N=455† | N=459† | N=480† |
N=482† |
|
HbA1c (%) |
||||
|
Basal (média) |
8,18 | 8,08 | 8,04 |
8,07 |
|
Alteração em relação ao basal (média ajustada‡ ) |
-0,38 | 0,08 | -0,33 |
0,07 |
|
Diferença em relação ao placebo (média ajustada‡ ) (IC 95%) |
-0,46§ (-0,56; -0,37) | - | -0,40§ (-0,50; -0,30) | - |
|
Responsivos do benefício clínico combinado (%) |
11,7 | 0,9 | 10,0 |
1,9 |
|
Diferença em relação ao placebo (% ajustada) |
9,9§ | - | 7,0§ | - |
|
Componentes do desfecho composto (%) |
||||
|
Pacientes com redução absoluta de HbA1c ≥ 0,5% (% ajustada) |
46,2 | 19,7 | 42,2 |
21,2 |
|
Pacientes com redução do peso corporal de pelo menos 3% do basal (% ajustada) |
40,0 | 13,9 | 41,3 |
15,4 |
|
Pacientes com redução absoluta da pressão arterial sistólica ≥ 3mmHg (% ajustada) |
49,1 | 41,6 | 46,2 |
40,9 |
|
Peso Corporal (kg) |
||||
|
Basal (média) |
92,63 | 93,59 | 94,53 |
93,22 |
|
Alteração em relação ao basal (porcentagem ajustada‡ ) |
-2,56 | -0,30 | -2,53 |
-0,61 |
|
Diferença em relação ao placebo (porcentagem ajustada‡ ) (IC 95%) |
-2,27§ (-2,64; -1,89) | - | -1,93§ (-2,31; -1,54) | - |
|
Perda de peso corporal de pelo menos 5% em pacientes com IMC ≥ 27 kg/m2 (%) |
16,5§ | 4,0 | 18,4§ |
4,8 |
|
Pressão arterial sistólica em posição sentado (mmHg) |
||||
|
Alteração em relação ao basal na semana 24 (média ajustada‡ ) |
-2,99 | -1,03 | -2,70 |
0,32 |
|
Diferença em relação ao placebo (média ajustada‡ ) (IC 95%) |
-1,95¶ (-3,56; -0,34) | - | -3,02¶ (-4,59; -1,46) | - |
|
Alteração na pressão arterial sistólica em posição sentada do basal (mmHg) na semana 8 em pacientes com pressão arterial sistólica basal ≥ 130 mmHg (média ajustada‡ ) |
- | - | -5,33¶ |
-1,89 |
* LOCF: última observação (antes do resgate de pacientes) levada adiante.
† Pacientes randomizados e tratados com medidas basais e pelo menos 1 medida pós-basal de eficácia.
‡ Média dos quadrantes mínimos ajustada para o basal.
§ Valor de p < 0,0001.
¶ Valor de p < 0,05.
Na semana 24, os pacientes tratados com dapagliflozina 10 mg nas faixas etárias pré-definidas (<65 e ≥65 anos de idade) também apresentaram melhoras significativas nos parâmetros coprimários de HbA1c e benefício clínico múltiplo em comparação com placebo em ambos os estudos. Uma redução significativa no peso corporal total também foi vista em ambos os grupos de idade, bem como redução significativa da pressão arterial sistólica quando sentados em pacientes <65 anos tratados com 10 mg de dapagliflozina em comparação com placebo na semana 24. Estes efeitos foram mantidos na semana 52 e semana 104.
Dapagliflozina por absortometria ao Raio-X de Dupla Energia em Pacientes Diabéticos
Devido ao mecanismo de ação da dapagliflozina, foi realizado um estudo para avaliar a composição corporal e a densidade mineral óssea em 182 pacientes com diabetes tipo 2. O tratamento com dapagliflozina 10 mg adicionada à metformina IR em 182 pacientes com diabetes tipo 2 ao longo de um período de 24 semanas proporcionou melhora significativa em comparação ao placebo mais metformina, respectivamente, no peso corporal (variação média em relação ao basal: −2,96 kg vs −0,88 kg); circunferência da cintura (variação média em relação ao basal: −2,51 cm vs −0,99 cm), e massa gorda medida por DXA (variação média em relação ao basal −2,22 kg vs −0,74 kg) ao invés da massa magra ou perda de volume. O tratamento com dapagliflozina mais metformina demonstrou uma redução numérica no tecido adiposo visceral quando comparado com tratamento do placebo mais metformina (variação média em relação ao basal: −322,6 cm3 vs −8,7 cm3) em um sub-estudo com MRI. Dados da semana 24 foram analisados utilizado a última observação avançada (LOCF) incluindo dados após o resgate.
Na semana 24, 2 pacientes (2,2%) do grupo placebo em combinação com metformina e nenhum paciente do grupo dapagliflozina 10 mg em combinação com metformina foram resgados por ausência de controle glicêmico.
Na semana 50 e semana 102, melhorias foram sustentados no grupo de dapagliflozina 10 mg adicionado a metformina em comparação com o grupo placebo em combinação àmetformina para o peso corporal (variação média ajustada do basal na semana 50: -4,39 kg vs. -2.03 kg; média ajustada da variação do basal na semana 102: -4,54 kg vs. -2,12 kg), a circunferência da cintura (ajustado com variação do basal na semana 50: -5,0 vs. -3,0 cm; variação média ajustada a partir de do basal na semana 102: -5,0 cm vs. -2,9 cm) e massa corporal de gordura medida pelo DXA na semana 102 (média da variação do basal: -2,80 kg vs. -1,46 kg) com base na análise longitudinal repetida de medidas, incluindo dados depois do resgate. Num sub-estudo de ressonância magnética nas semanas 50 e 102, o tratamento com dapagliflozina mais metformina demonstrou uma diminuição numérica no tecido adiposo visceral, comparado com o tratamento com placebo mais metformina (média ajustada da variação do basal na semana 50: 120,0 cm3 vs. 61,5 cm3; variação média ajustada do basal na semana 102: -214,9 cm3 vs. -22,3 cm3).
A proporção de pacientes na semana 50 (não ajustado para HbA1c basal) e na semana 102 (ajustado para HbA1c basal), que foram resgatados ou com tiveram o tratamento interrompido por falta de controle glicêmico foi maior no grupo de placebo mais metformina (6,6% e 33,2%, respectivamente) do que no grupo da dapagliflozina 10 mg mais metformina (2,2% e 13,5%, respectivamente).
Em uma extensão desse estudo até a Semana 50, não houve mudança na densidade mineral óssea (DMO) para a coluna lombar, colo do fêmur ou quadril observado em qualquer dos grupos de tratamento (variação média em relação ao basal para todas as regiões anatômicas <0,5%). Também não houve alteração na DMO em nenhum grupo de tratamento até a semana 102 (redução média da linha de base para todas as regiões anatômicas <1,0%). Não houve alterações clinicamente significativas nos marcadores da reabsorção óssea ou a formação de osso.
Estudo da metformina no UKPDS
O estudo prospectivo randomizado (UKPDS) estabeleceu o benefício de longo prazo do controle intensivo da glicemia na diabetes tipo 2.
A análise dos resultados para os pacientes em sobrepeso tratados com metformina após falha da dieta sozinha demonstrou:
- Uma redução significativa do risco absoluto de qualquer complicação relacionada a diabetes no grupo metformina (29,8 eventos/1000 pacientes-ano) versus dieta isolada (43,3 eventos/1000 paciente-anos), p=0,0023, e versus os grupos combinados de sulfonilureia e monoterapia com insulina (40,1 eventos/1000 paciente-anos), p=0,0034;
- Uma redução significativa no risco absoluto de qualquer mortalidade relacionada a diabetes: metformina 7,5 eventos/1000 paciente-anos, dieta isolada 12,7 eventos/1000 paciente-anos, p=0,017;
- Uma redução significativa do risco absoluto da mortalidade global: metformina 13,5 eventos/1000 paciente-anos versus dieta isolada 20,6 eventos/1000 paciente-anos, (p=0,011), e versus os grupos combinados de sulfonilureia e monoterapia com insulina 18,9 eventos/1000 paciente-anos (p=0,021);
- Uma redução significativa no risco absoluto de infarto do miocárdio: metformina 11 eventos/1000 paciente-anos, dieta isolada 18 eventos/1000 paciente-anos, (p=0,01).
Referências Bibliográficas
UK Prospective Diabetes Study (UKPDS) Group, Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34). Lancet. September 1998; 352 (9131): pp. 854-865.
Jabbour SA, Hardy E, Sugg J, Parikh S; for the Study 10 Group. Dapagliflozin Is Effective as Add-on Therapy to Sitagliptin With or Without Metformin: A 24-Week, Multicenter, Randomized, DoubleBlind, Placebo-Controlled Study. Diabetes Care. 2014;37(3):740-750.
Características Farmacológicas
Propriedades Farmacodinâmicas
Descrição
Os comprimidos de Dapagliflozina + Cloridrato de Metformina contêm dois medicamentos anti-hiperglicemiantes utilizados no tratamento da diabetes tipo 2: dapagliflozina e cloridrato de metformina.
Dapagliflozina
A dapagliflozina propanodiol é um inibidor potente, altamente seletivo e ativo por via oral, do cotransportador renal de sódio-glicose 2 humano (SGLT2), o principal transportador responsável pela reabsorção renal de glicose.
Cloridrato de Metformina
O cloridrato de metformina é uma biguanida com efeitos hipoglicemiantes.
Mecanismo de Ação
Dapagliflozina + Cloridrato de Metformina combina dois agentes anti-hiperglicemiantes com mecanismos de ação complementares para melhorar tanto a glicemia de jejum (FPG) quanto a glicemia pós-prandial (PPG) em pacientes com diabetes tipo 2: dapagliflozina, um inibidor do SGLT2, e cloridrato de metformina, um membro da classe das biguanidas.
Dapagliflozina
A dapagliflozina é um inibidor altamente potente, seletivo e reversível do cotransportador de sódio glicose 2 (SGLT2) que melhora o controle glicêmico em pacientes com diabetes tipo 2 ao reduzir a reabsorção da glicose renal levando à excreção urinária do excesso de glicose (glicurese). A dapagliflozina é disponível para uso oral e requer administração uma vez ao dia.
O SGLT2 se expressa seletivamente no rim sem expressão detectada em mais de 70 outros tecidos incluindo o fígado, músculo esquelético, tecido adiposo, mama, bexiga e cérebro. SGLT2 é o transportador predominante responsável pela reabsorção da glicose a partir do filtrado glomerular de volta à circulação. Apesar da presença da hiperglicemia na diabetes melito tipo 2, a reabsorção da glicose filtrada continua. A dapagliflozina reduz o transporte tuvular máximo de glicose para 55% e reduz a reabsorção renal de glicose tanto da glicose da urina quanto dos níveis de glicose plasmático. A dapagliflozina melhora tanto os níveis da glicemia de jejum quanto da glicemia pós-prandial através da redução da reabsorção renal de glicose levando à excreção urinária do excesso de glicose. Esta excreção da glicose (efeito glicurético) é observada após a primeira dose, é contínua ao longo do intervalo de administração de 24 horas, e se mantém durante o tratamento. A quantidade de glicose removida pelo rim através deste mecanismo é dependente da concentração de glicose no sangue e da taxa de filtração glomerular (TFG). Portanto, em voluntários sadios com glicose normal, dapagliflozina tem uma baixa propensão a causar hipoglicemia. A dapagliflozina não prejudica a produção endógena normal de glicose em resposta à hipoglicemia. A dapagliflozina age independentemente da secreção da insulina e da ação da insulina. Ao longo do tempo, a melhora na função da célula beta (HOMA-2) foi observada nos estudos clínicos com dapagliflozina.
A excreção urinária de glicose (glicurese) induzida pela dapagliflozina está associada com perda calórica e redução no peso. A maior parte da redução no peso foi perda de gordura corporal, incluindo a gordura visceral em detrimento da perda de tecido magro ou volume, como demonstrado por absortometria de raio-x de dupla energia (DXA) e imagem por ressonância magnética. A inibição do cotransporte de glicose e sódio pela dapagliflozina também está associado à diurese leve e natriurese temporária.
A dapagliflozina não inibe outros transportadores de glicose importantes para o transporte de glicose nos tecidos periféricos e é mais de 1400 vezes mais seletivo para o SGLT2 versus SGLT1, o principal transportador no intestino, responsável pela absorção da glicose.
Cloridrato de metformina
A metformina é um agente anti-hiperglicemiante que melhora a tolerância á glicose em pacientes com diabetes tipo 2, reduzindo tanto a glicose basal quanto a pós-prandial. A metformina diminui a produção hepática de glicose, diminui a absorção intestinal de glicose e melhora a sensibilidade à insulina através do aumento da captação e utilização periférica de glicose. Diferente das sulfonilureias, a metformina não produz hipoglicemia em sujeitos com diabetes tipo 2 ou normais (exceto em circunstâncias especiais, e não causa hiperinsulinemia. Com a terapia com metformina, a secreção de insulina se mantém inalterada, enquanto os níveis de insulina em jejum e a resposta à insulina no plasma ao longo do dia pode realmente diminuir.
Farmacodinâmica
Geral
Dapagliflozina
Em voluntários sadios e em pacientes com diabetes melittus tipo 2 foi observado aumento na quantidade da glicose excretada na urina após a administração de dapagliflozina (Figura 7). Aproximadamente 70 g de glicose foi excretada na urina por dia (correspondendo a 280 kcal/dia) em uma dose de dapagliflozina de 10 mg/dia em pacientes com diabetes melittus tipo 2 durante 12 semanas. Esta taxa de eliminação de glicose se aproximou da excreção máxima de glicose observada com a dose de 20 mg/dia de dapagliflozina. Evidência de excreção de glicose sustentada foi observada nos pacientes com diabetes melittus tipo 2 que receberam dapagliflozina 10 mg/dia até por 2 anos.
Esta excreção urinária de glicose com a dapagliflozina também resulta em diurese osmótica e aumentos no volume urinário. Os aumentos no volume de urina nos pacientes com diabetes melito tipo 2 tratados com dapagliflozina 10 mg foram sustentados em 12 semanas e a quantidade foi de aproximadamente 375 mL/dia. O aumento no volume urinário foi associado a um aumento pequeno e transitório na excreção urinária de sódio que não foi associada a alterações nas concentrações séricas de sódio.
A excreção urinária de ácido úrico também aumentou temporariamente (por 3-7 dias) e foi acompanhada por uma redução na concentração sérica do ácido úrico. Em 24 semanas, as reduções nas concentrações do ácido úrico sérico variaram de 0,33 mg/dL a 0,87 mg/dL.
Figura 7: Gráfico de Dispersão e Linha de Ajuste da Variação em Relação ao Basal na Quantidade de Glicose na Urina em 24 horas vs a Dose de dapagliflozina em Voluntários Sadios e Pacientes com T2DM (Dispersão Semi-Log)

Eletrofisiologia Cardíaca
A dapagliflozina não foi associada ao prolongamento clinicamente significante do intervalo QTc em doses diárias de até 150 mg (15 vezes a dose recomendada) em um estudo de voluntários sadios.
Além disso, nenhum efeito clinicamente significativo sobre o intervalo QTc foi observado após dose únicas de até 500 mg (50 vezes a dose recomendada) de dapagliflozina em voluntários sadios.
Propriedades Farmacocinéticas
Os comprimidos de Dapagliflozina + Cloridrato de Metformina são considerados bioequivalentes à coadministração das doses correspondentes de dapagliflozina e cloridrato de metformina XR administradas em conjunto como comprimidos individuais.
Interação com o alimento
A administração de Dapagliflozina + Cloridrato de Metformina em voluntários sadios após uma refeição padrão comparado com o estado de jejum resultou no mesmo grau de exposição tanto para dapagliflozina quanto para metformina XR. Comparado ao estado de jejum, a refeição padrão resultou em uma redução de 35% e um atraso de 1 a 2 horas no pico das concentrações plasmáticas da dapagliflozina. Este efeito da alimentação não é considerado clinicamente significativo.
Absorção
Dapagliflozina
A dapagliflozina é rapidamente e bem absorvida após a administração oral e pode ser administrada com ou sem alimentos. As concentrações plasmáticas máximas (Cmáx) da dapagliflozina foram normalmente atingidas no prazo de 2 horas após a administração em jejum. Os valores de Cmáx e AUC aumentaram proporcionalmente com o incremento na dose da dapagliflozina. A biodisponibilidade oral absoluta de dapagliflozina após a administração de uma dose de 10 mg é de 78%.
Cloridrato de Metformina XR
Após uma dose oral única de metformina de liberação prolongada, Cmáx foi atingida com um valor mediano de 7 horas e uma faixa de 4 a 8 horas. No estado de equilíbrio, AUC e Cmáx são menos que proporcionais à dose para metformina de liberação prolongada dentro da faixa de 500 a 2000 mg administrada uma vez ao dia. Os níveis do pico plasmático são aproximadamente 0,6; 1,1; 1,4 e 1,8 µg/mL para as doses de 500, 1000, 1500, e 2000 mg uma vez ao dia, respectivamente.
Distribuição
Dapagliflozina
Aproximadamente 91% da dapagliflozina é ligada à proteína. A ligação à proteína não foi alterada em diversos estados de doença (por exemplo, disfunção renal ou hepática).
Cloridrato de Metformina
Estudos de distribuição com a metformina de liberação prolongada não foram realizados; no entanto, o volume de distribuição aparente (V/F) da metformina após doses orais únicas de 850 mg da metformina de liberação imediata foi em média de 654 ± 358 L. A metformina se liga de forma insignificante às proteínas do plasma, diferente das sulfonilureias, que se ligam às proteínas em mais de 90%. As divisões da metformina nos eritrócitos ocorrem mais provavelmente em função do tempo.
Metabolismo
Dapagliflozina
A dapagliflozina é um glicosídeo ligado ao C, significando que o componente aglicona está ligado à glicose por uma ponte carbono-carbono, conferindo assim estabilidade contra as enzimas glicosidases. A média da meia-vida terminal no plasma (t1/2) para dapagliflozina foi de 12,9 horas após uma dose oral única de dapagliflozina 10 mg a voluntários sadios. A dapagliflozina é amplamente metabolizada principalmente para gerar a dapagliflozina 3-O-glicuronídeo, que é um metabólito inativo. A dapagliflozina 3-O-glicuronídeo foi responsável por 61% de uma dose de 50 mg de [14C]- dapagliflozina e foi o componente relacionado ao medicamento predominante no plasma humano, representando 42% (com base na AUC[0-12 h]) da radioatividade plasmática total, semelhante a contribuição de 39% pelo composto original. Com base na AUC, nenhum outro metabólito foi responsável por >5% da radioatividade total no plasma. A dapagliflozina 3-O-glicuronídeo ou outros metabólitos não contribuem para os efeitos de redução da glicose. A formação da dapagliflozina 3-O- glicuronídeo é mediada pela UGT1A9, uma enzima presente no fígado e rins, e o metabolismo mediado pela CYP foi uma via secundária de depuração em humanos.
Cloridrato de Metformina
Estudos de dose única intravenosa em voluntários normais demonstram que a metformina é excretada inalterada na urina e não sofre metabolismo hepático (nenhum metabólito foi identificado em humanos) ou excreção biliar.
Estudos do metabolismo com os comprimidos de liberação prolongada da metformina não foram realizados.
Eliminação
Dapagliflozina
A dapagliflozina e os metabólitos relacionados são eliminados principalmente através da excreção urinária, dos quais menos de 2% é dapagliflozina inalterada. Após a administração da dose de 50 mg de [14C]-dapagliflozina, 96% foi recuperado, 75% na urina e 21% nas fezes. Nas fezes, aproximadamente 15% da dose foi excretada como princípio ativo original.
Cloridrato de Metformina
A depuração renal é aproximadamente 3,5 vezes maior que a depuração da creatinina, indicando que a secreção tubular é a principal via de eliminação da metformina. Após administração oral, aproximadamente 90% do fármaco absorvido é eliminado através da via renal nas primeiras 24 horas, com uma meia-vida de eliminação do plasma de aproximadamente 6,2 horas. No sangue, a meia-vida de eliminação é de aproximadamente 17,6 horas, sugerindo que a massa de eritrócito pode ser um compartimento de distribuição.
Populações Específicas
Insuficiência renal
Dapagliflozina + Cloridrato de Metformina não deve ser usado em pacientes com disfunção renal moderada ou grave (CrCl <60 mL/min).
Dapagliflozina
Para as recomendações de administração em pacientes com disfunção renal moderada ou grave, consulte a seção "Como usar". No estado de equilíbrio (dapagliflozina na dose de 20 mg uma vez ao dia durante 7 dias), os pacientes com diabetes tipo 2 e disfunção renal leve, moderada ou grave (conforme determinado pela depuração de iohexol) apresentaram exposições sistêmicas médias da dapagliflozina que foram 32%, 60% e 87% maiores, respectivamente, que aquelas de pacientes com diabetes tipo 2 e função renal normal. Na dose de 20 mg de dapagliflozina uma vez ao dia, exposição sistêmica mais elevada a dapagliflozina em pacientes com diabetes melittus tipo 2 e disfunção renal não resultaram em maior depuração renal de glicose correspondente ou maior excreção de glicose nas 24 horas. A depuração renal de glicose e a excreção de glicose nas 24 horas foram menores nos pacientes com disfunção renal moderada ou grave quando comparado aos pacientes com função renal normal e disfunção renal leve. A excreção urinária de glicose nas 24 horas, no estado de equilíbrio, foi altamente dependente da função renal e 85, 52, 18, e 11 g de glicose/dia foi excretada pelos pacientes com diabetes melittus tipo 2 e função renal normal, ou disfunção renal leve, moderada ou grave, respectivamente. Não houve diferenças na ligação da dapagliflozina às proteínas entre os grupos de disfunção renal ou em comparação aos voluntários sadios. O impacto da hemodiálise sobre a exposição à dapagliflozina não é conhecido.
Cloridrato de Metformina
Nos pacientes com função renal diminuída (tendo como base a depuração de creatinina medido), a meia-vida da metformina no plasma e sangue é prolongada e a depuração renal é diminuída em proporção à diminuição na depuração de creatinina.
Insuficiência Hepática
Dapagliflozina
Para as recomendações de dose em pacientes com disfunção hepática moderada ou grave, consulte a seção "Como usar." Foi realizado um estudo de farmacologia clínica com dose única (10 mg) de dapagliflozina em pacientes com disfunção hepática leve, moderada ou grave (classe A, B e C de Child-Pugh, respectivamente) e controles sadios pareados para comparar as características farmacocinéticas da dapagliflozina entre essas populações. Não houve diferenças na ligação proteica da dapagliflozina entre os grupos com disfunção hepática ou em comparação aos voluntários sadios. Nos pacientes com disfunção hepática leve ou moderada, a média da Cmáx e AUC da dapagliflozin foi até 12% e 36% maior, respectivamente, comparado aos voluntários controle sadios correspondentes. Essas diferenças não foram consideradas clinicamente significativas e nenhum ajuste de dose a partir da dose habitual proposta de 10 mg uma vez ao dia, para dapagliflozina foi proposto para essas populações. Nos pacientes com disfunção hepática grave (Child-Pugh classe C), a média da Cmáx e AUC da dapagliflozina foram até 40% e 67% maiores que a dos controles sadios correspondentes, respectivamente. Não é necessário ajuste de dose para os pacientes com disfunção hepática grave. No entanto, o risco-benefício para o uso da dapagliflozina em pacientes com disfunção hepática grave deve ser avaliado individualmente, pois a segurança e eficácia da dapagliflozina não foram especificamente estudadas nesta população.
Cloridrato de Metformina
Nenhum estudo de farmacocinética da metformina foi realizado em pacientes com disfunção hepática.
Idosos
Dapagliflozina
Não são recomendados ajustes de dose de dapagliflozina 10 mg uma vez ao dia com base na idade. O efeito da idade (jovem: ≥18 a <40 anos [n=105] e idosos: ≥65 anos [n=224]) foi avaliado como uma covariável em um modelo de farmacocinética na população e comparado a pacientes com ≥40 a <65 anos usando dados de voluntários sadios e nos estudos com pacientes). A exposição sistêmica média à dapagliflozina (AUC) em pacientes jovens foi estimada como sendo 10,4% menor que no grupo de referência (IC de 90%: 87,9, 92,2%) e 25% maior em pacientes idosos comparado ao grupo de referência (IC de 90%: 123, 129%). Essas diferenças na exposição sistêmica foram consideradas como não clinicamente significativas.
Cloridrato de Metformina
Dados limitados de estudos controlados da farmacocinética de metformina em voluntários idosos sadios sugerem que a depuração plasmática total da metformina é diminuída, a meia-vida é prolongada, e a Cmáx é aumentada, comparado a voluntários jovens sadios. A partir destes dados, parece que a alteração na farmacocinética da metformina com o envelhecimento ocorre principalmente por uma alteração na função renal.
Pediatria e adolescência
Dapagliflozina
A farmacocinética na população pediátrica e adolescente não foi estudada.
Cloridrato de Metformina
Após administração de uma dose oral única de metformina em comprimido de 500 mg com a refeição, a média geométrica da Cmáx e AUC da metformina diferiu menos que 5% entre pacientes pediátricos com diabetes tipo 2 (12-16 anos de idade) e adultos sadios pareados por gênero e peso (20-45 anos de idade), todos com função renal normal.
Gênero
Dapagliflozina
Não são recomendados ajustes na dose de dapagliflozina10 mg uma vez ao dia, com base no gênero. O gênero foi avaliado como uma covariável em um modelo de farmacocinética na população usando dados de voluntários sadios e estudos em pacientes. A média da AUCss de dapagliflozina em mulheres (n=619) foi estimada como sendo 22% maior que em homens (n=634), (IC 90%: 117,124).
Cloridrato de Metformina
Os parâmetros farmacocinéticos da metformina não diferiram significativamente entre voluntários normais e pacientes com diabetes tipo 2 quando analisados de acordo com o gênero (homens=19, mulheres=16). Da mesma forma, nos estudos clínicos controlados em pacientes com diabetes tipo 2, o efeito anti-hiperglicêmico da metformina foi comparável nos homens e mulheres.
Raça
Dapagliflozina
Não são recomendados ajustes na dose de dapagliflozina 10 mg uma vez ao dia com base na raça. A raça (branca, negra ou asiática) foi avaliada como uma covariável em um modelo de farmacocinética na população usando dados de voluntários sadios e estudos em pacientes. As diferenças nas exposições sistêmicas entre essas raças foram pequenas. Comparado aos brancos (n=1.147), os pacientes asiáticos (n=47) não apresentaram diferenças nas exposições sistêmicas médias estimadas à dapagliflozina (IC de 90% faixa 3,7% menor, 1% maior). Comparado aos brancos, os pacientes negros (n=43) apresentaram exposições sistêmicas médias estimadas 4,9% menores à dapagliflozina [IC 90%, faixa 7,7% menor; 3,7% maior).
Cloridrato de Metformina
Nenhum estudo dos parâmetros farmacocinéticos da metformina de acordo com a raça foi realizado. Nos estudos clínicos controlados de metformina em pacientes com diabetes tipo 2, o efeito anti- hiperglicêmico foi comparável em brancos (n=249), negros (n=51), e hispânicos (n=24).
Peso Corporal
Não são recomendados ajustes na dose proposta de dapagliflozina 10 mg uma vez ao dia com base no peso.
Em uma análise da farmacocinética na população usando dados de voluntários sadios e estudos em pacientes, as exposições sistêmicas em pacientes com peso corporal elevado (≥120 kg, n=91) foram estimadas como sendo 78,3% (IC 90%: 78,2; 83,2%) daquelas de sujeitos de referência com peso corporal entre 75 e 100 kg. Esta diferença é considerada pequena, portanto, nenhum ajuste de dose a partir da dose proposta de 10 mg de dapagliflozina, uma vez ao dia, em pacientes com diabetes melittus tipo 2 com peso corporal elevado (≥120 kg) é recomendado.
Indivíduos com peso corporal baixo (<50 kg) não foram bem representados nos estudos de voluntários sadios e pacientes usados na análise da farmacocinética na população. Desta forma, as exposições sistêmicas à dapagliflozina foram simuladas com um grande número de pacientes. As exposições sistêmicas médias simuladas de dapagliflozina em pacientes com baixo peso corporal foram estimadas como sendo 29% maior que nos indivíduos com peso corporal de referência. Esta diferença é considerada como sendo pequena, e com base nesses achados, nenhum ajuste na dose a partir da dose proposta de 10 mg de dapagliflozina, uma vez ao dia, em pacientes com diabetes melittus tipo 2 com baixo peso corporal (<50 kg) é recomendado.
Dados de segurança pré-clínica
Carcinogênese, Mutagênese e Comprometimento da Fertilidade
Dapagliflozina
A dapagliflozina não induziu tumores em camundongos ou ratos em qualquer das doses avaliadas nos estudos de carcinogenicidade de dois anos. As doses orais nos camundongos consistiram de 5, 15, e 40 mg/kg/dia nos machos e 2, 10, e 20 mg/kg/dia nas fêmeas, e as doses orais nos ratos foram de 0,5; 2 e 10 mg/kg/dia para machos e fêmeas. As maiores doses avaliadas nos camundongos foram equivalentes à AUC de exposições múltiplas de aproximadamente 72× (machos) e 105× (fêmeas) a AUC humana na MRHD de 10 mg/dia. Nos ratos, as exposições da AUC foram aproximadamente 131× (machos) e 186× (fêmeas) a AUC humana na MRHD.
A dapagliflozina foi negativa no ensaio de mutagenicidade de Ames e foi positiva em um ensaio de clastogenicidade in vitro, mas somente na presença de ativação de S9 e em concentrações ≥ 100 μg/mL. Cabe ressaltar que a dapagliflozina foi negativa para clastogenicidade in vivo em uma série de estudos que avaliou os micronúcleos ou reparação do DNA nos ratos em exposições múltiplas >2100× a exposição humana na MRHD. Esses estudos, junto com a ausência de achados tumorais nos estudos de carcinogenicidade no rato e camundongo, sustentam que a dapagliflozina não representa um risco genotóxico para humanos.
Alterações na transcrição de genes relacionadas à dapagliflozina foram avaliadas no rim, fígado, tecido adiposo, e músculo esquelético de ratos Zucker Diabetic Fatty (ZDF) tratados diariamente, durante 5 semanas, com dapagliflozina. Esses órgãos foram selecionados especificamente uma vez que representam órgãos alvo no tratamento do diabetes. Não houve nenhuma evidência de que a dapagliflozina provocou alterações na transcrição de genes preditivos de promotores de tumores.
A dapagliflozina e seu principal metabólito humano (3-O-glucuronido) não aumentou o crescimento in vitro de seis linhas celulares de carcinomas humanos de células transicionais (TCC) de bexiga urinária em concentrações ≥100 × Cmáx humana no MRHD. Em um estudo com ratos com xenoenxertos, a dapagliflozina administrada diariamente para ratos nudes masculinos e femininos implantados com tumores TCC humano não aumentou significativamente o tamanho dos tumores em exposições de até 75 × e de até 0,9 × de exposição clínica no MRHD para dapagliflozina e seu metabolito 3-O-glicuronídeo, respectivamente. Estes estudos fornecem evidências de que a dapagliflozina e seu metabolito primário humano não aumenta o crescimento do tumor de bexiga.
Em um estudo de fenotipagem de 15 meses, não houve evidência de qualquer diferença na sobrevivência, no peso corporal, nos parâmetros de patologia clínica ou achados histopatológicos entre ratos SGLT2 KO e seu homólogo de tipo selvagem (WT). Camundongos SGLT2 KO tiveram glicosúria, ao contrário dos camundongos WT. Apesar de uma vida inteira de glicosúria, não houve nenhuma evidência de alteração da função renal ou mudanças proliferativas observadas nos rins ou bexiga urinária de camundongos SGLT2 KO. Estes dados sugerem fortemente que altos níveis de glicose urinária não provocam tumores do trato urinário ou aceleram a patologia do trato urinário relacionada com a idade.
Em um estudo de fertilidade e desenvolvimento embrionário em ratos, doses de 15, 75, ou 300/210 mg/kg/dia de dapagliflozina foram administradas nos machos (a dose de 300 mg/kg/dia foi reduzida para 210 mg/kg/dia depois de 4 dias); e as doses de 3, 15, ou 75 mg/kg/dia foram administradas às fêmeas. A dapagliflozina não teve efeitos no acasalamento, fertilidade, ou desenvolvimento embrionário inicial nos machos ou fêmeas tratadas em qualquer dose testada (em exposições múltiplas ≤1708× e 998× a MRHD em machos e fêmeas, respectivamente). No entanto, com a dose de 300/210 mg/kg/dia, os pesos da vesícula seminal e epidídimo estavam reduzidos; a motilidade do esperma e a contagem de espermatozoides estavam reduzidas; e havia números baixos de espermatozoides morfologicamente anormais.
Cloridrato de metformina
Estudos de carcinogenicidade de longo prazo foram realizados em ratos (duração da administração de 104 semanas) e camundongos (duração da administração de 91 semanas) em doses de até e inclusive 900 mg/kg/dia e 1500 mg/kg/dia, respectivamente. Essas doses são ambas, aproximadamente 4 vezes a dose máxima diária recomendada em humanos de 2000 mg com base em comparações da área de superfície corporal. Nenhuma evidência de carcinogenicidade com metformina foi encontrada em camundongos machos ou fêmeas. Da mesma forma, não houve potencial tumorigênico observado com a metformina nos ratos machos. Houve, no entanto, uma incidência aumentada de pólipos uterinos estromais benignos nas ratas fêmeas tratadas com 900 mg/kg/dia.
Não houve evidência de um potencial mutagênico da metformina nos seguintes testes in vitro: teste deAmes (S. typhimurium), teste de mutação genética (células de linfoma de camundongo), ou testes de aberrações cromossômicas (linfócitos humanos). Os resultados no teste de micronúcleo de camundongo in vivo também foram negativos.
A fertilidade de ratos machos ou fêmeas não foi afetada pela metformina quando administrada em doses tão altas quanto 600 mg/kg/dia, que é aproximadamente 3 vezes a dose diária máxima recomendada em humanos com base nas comparações da área de superfície corporal.
Teratogenicidade e prejuízo do desenvolvimento inicial
Dapagliflozina
A administração direta da dapagliflozina a ratos jovens em desmame, e exposição indireta durante a fase final da gestação e lactação (períodos de tempo correspondendo ao segundo e terceiro trimestres da gravidez em relação à maturação renal em humanos), está cada uma delas associada com maior incidência e/ou gravidade de dilatações da pelve renal e tubular na prole.
Em um estudo de toxicidade em ratos jovens, quando a dapagliflozina foi administrada diretamente a ratos jovens desde o dia pós-natal (PND) 21 até PND 90 nas doses de 1, 15, ou 75 mg/kg/dia, dilatações da pelve renal e tubular foram relatadas em todos os níveis de dose; as exposições dos filhotes na menor dose testada foram ≥15× a MRHD. Esses achados foram associados com aumentos relacionados à dose no peso do rim e aumento macroscópico do rim observados em todas as doses. As dilatações da pelve renal e túbulos observados nos animais jovens não reverteram totalmente no prazo aproximado para o período de recuperação de um mês.
Em um estudo separado de desenvolvimento pré-natal e pós-natal, as ratas prenhes receberam a partir do dia 6 da gestação (GD) 6 até o PND 21 (também nas doses de 1, 15, ou 75 mg/kg/dia), e os filhotes foram indiretamente expostos in útero e durante a lactação (um estudo satélite foi conduzido para avaliar as exposições da dapagliflozina no leite e filhotes). Incidência ou gravidade maior da dilatação da pelve renal foi novamente observada em filhotes adultos de fêmeas tratadas, ainda que apenas na dose de 75 mg/kg/dia (as exposições materna e dos filhotes à dapagliflozina foram 1415× e 137×, respectivamente, os valores humanos na MRHD). A toxicidade adicional no desenvolvimento foi limitada às reduções relacionadas à dose no peso corporal dos filhotes, e observadas apenas em doses ≥15 mg/kg/dia (associada a exposições da prole que são ≤ 29× os valores humanos na MRHD). A toxicidade materna foi evidente apenas com 75 mg/kg/dia, e reduções limitada a transitórias no peso corporal e consumo de alimentos no início da dose. O nível sem efeito adverso (NOAEL) para toxicidade no desenvolvimento, 1 mg/kg/dia, foi associada com uma exposição sistêmica materna múltipla que é aproximadamente 19x o valor humano na MRHD.
Nos estudos adicionais de desenvolvimento embriofetal em ratos e coelhos, dapagliflozina foi administrada por intervalos coincidentes com os principais períodos de organogênese em cada espécie. Não foram observadas toxicidades maternas ou no desenvolvimento nos coelhos em qualquer uma das doses testadas (20, 60, ou 180 mg/kg/dia); a dose de 180 mg/kg/dia é associada com uma exposição sistêmica múltipla de aproximadamente 1191× a MRHD. Nos ratos, dapagliflozina não foi embrioletal nem teratogênico em doses até 75 mg/kg/dia (1441× a MRHD).
Doses ≤ 150 mg/kg/dia (≥ 2344× os valores humanos na MRHD) foram associadas com ambas toxicidade maternal e no desenvolvimento. A toxicidade materna incluiu mortalidade, sinais clínicos adversos, e diminuições no peso corporal e consumo de alimentos. A toxicidade no desenvolvimento consistiu de maior letalidade embriofetal, maiores incidências de malformações fetais e alterações no esqueleto, e pesos corporais reduzidos nos fetos. As malformações incluíram uma baixa incidência de malformações dos grandes vasos, costelas fundidas e centros vertebrais, e duplicação do manúbrio e centro do esterno. As alterações foram principalmente ossificações reduzidas.
Cloridrato de Metformina
A metformina não foi teratogênica em ratos e coelhos em doses de até 600 mg/kg/dia. Isto representa uma exposição de cerca de 2 e 6 vezes a dose máxima diária recomendada para humanos de 2000 mg com base nas comparações da superfície corporal para ratos e coelhos, respectivamente. A determinação das concentrações fetais demonstrou uma barreira placentária parcial para a metformina.
Toxicologia Animal
Um estudo de 3 meses em ratos foi realizado com a combinação de Dapagliflozina + Cloridrato de Metformina. Nenhuma toxicidade foi observada na AUC das exposições 52 e 1,4 vezes a MRHD para Dapagliflozina + Cloridrato de Metformina, respectivamente.
Dapagliflozina
A maioria dos efeitos observados nos principais estudos de toxicidade de dose repetida em ratos e cães foi considerada secundária aos aumentos mediados farmacologicamente na glicose urinária e incluiu reduções no peso corporal e/ou ganho de peso corporal, aumento do consumo de alimentos, e aumento nos volumes de urina devido à diurese osmótica. A dapagliflozina foi bem tolerada quando administrada por via oral a ratos por até 6 meses em doses de ≤25 mg/kg/dia (≥346×as exposições humanas na MRHD) e em cães por até 12 meses em doses ≤120 mg/kg/dia (≥3200× as exposições humanas na MRHD). Ainda, os estudos de dose única com dapagliflozina indicaram que o metabólito dapagliflozina 3-O-glicuronídeo teria sido formado tanto nos estudos de toxicidade no rato quanto em cães em níveis de exposição (AUCs) que são maiores que, ou aproximadamente iguais, às exposições humanas antecipadas a dapagliflozina 3-O-glicuronídeo após a administração de dapagliflozina na MRHD. Nos ratos, o aumento de osso trabecular e a mineralização tecidual (associada com aumentos no cálcio sérico) -os principais achados de toxicidade não clínica digna de nota - somente foi observado em múltiplos de alta exposição (≥2100× baseado nas exposições humanas na MRHD). Apesar de atingir múltiplos de exposição de ≥3200× a exposição humana na MRHD, não ocorreram toxicidades limitadas pela dose ou em órgão alvo identificadas no estudo de 12 meses em cães.
Como devo armazenar o Xigduo XR?
Conservar o produto em temperatura ambiente (entre 15ºC e 30ºC).
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características físicas e organolépticas
- Xigduo XR 10 mg/500 mg comprimidos revestidos oblongos, biconvexos, rosa, com a gravação "1072" e "10/500" em um dos lados e liso do outro.
- Xigduo XR 10 mg/1000 mg comprimidos revestidos ovais, biconvexos, amarelo a amarelo escuro, com a gravação "1073" e "10/1000" em um dos lados e liso do outro.
- Xigduo XR 5 mg/1000 mg comprimidos revestidos ovais, biconvexos, rosa a rosa escuro, com a gravação "1071" e "5/1000" em um dos lados e liso do outro.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Dizeres Legais do Xigduo XR
MS - 1.1618.0262
Farm. Resp.:
Mauricio Rivas Marante
CRF-SP nº 28.847
Fabricado por:
Bristol-Myers Squibb Manufacturing Company
Humacao – Porto Rico
Ou
AstraZeneca Pharmaceuticals LP
Mount Vernon – Indiana – EUA
Embalado por:
AstraZeneca Pharmaceuticals LP -
Mount Vernon – Indiana – EUA
Ou
AstraZeneca Pharmaceuticals LP
Newark – Delaware - EUA
Importado por:
AstraZeneca do Brasil Ltda.
Rod. Raposo Tavares, km 26,9
Cotia – SP
CEP 06707-000
CNPJ 60.318.797/0001-00
Venda sob prescrição médica.
Todas as marcas nesta embalagem são propriedade do grupo de empresas AstraZeneca.
Especificações sobre o Xigduo XR
Caracteristicas Principais
| Fabricante: | Astrazeneca |
| Necessita de Receita: | Branca Comum (Venda Sob Prescrição Médica) |
| Princípio Ativo: | Dapagliflozina + Cloridrato de Metformina |
| Categoria do Medicamento: | Diabetes |
| Especialidades: | Endocrinologia |
| Doenças Relacionadas: | Diabetes, Diabetes Mellitus, Diabetes Mellitus Tipo 2 |
| Bula do Paciente: | Bula do Xigduo XR |
| Bula do Profissional: | Bula do Profissional do Xigduo XR |
| Tipo do Medicamento: | Novo |
| Registro no Ministério da Saúde: | 1018004070052 |
| Código de Barras: | 5000456028387 |
| Temperatura de Armazenamento: | Temperatura ambiente |
| Produto Refrigerado: | Este produto não precisa ser refrigerado |
| Modo de Uso: | Uso oral |
| Pode partir: | Esta apresentação pode ser partida |
Ofertas deste produto
.webp)
 Xigduo XR 10mg + 1000mg, com 30 comprimidos revestidos de liberação prolongada
Xigduo XR 10mg + 1000mg, com 30 comprimidos revestidos de liberação prolongada


