Zevuxa 100mg, caixa com 100 comprimidos revestidos
- DoseQuantidade de princípio ativo por unidade, como 50mg por comprimido.
- Quantidade na embalagemNúmero de unidades do produto por embalagem.
- Dasatinibe
Branca Comum (Venda Sob Prescrição Médica)
Temperatura ambiente
Não pode ser partido
Bula do Zevuxa
Zevuxa, para o que é indicado e para o que serve?
Dasatinibe é indicado para o tratamento de adultos com leucemia mieloide crônica¹ cromossomo Philadelphia-positivo (LMC Ph+) na fase crônica recém-diagnosticada.
Dasatinibe é indicado para o tratamento de adultos com leucemia mieloide crônica1 cromossomo Philadelphia-positivo (LMC Ph+) nas fases crônica, acelerada ou blástica mieloide /linfoide com resistência ou intolerância à terapia anterior incluindo imatinibe.
Dasatinibe também é indicado para o tratamento de adultos com leucemia linfoblástica aguda² cromossomo Philadelphia-positivo (LLA Ph+) com resistência ou intolerância à terapia anterior.
¹ CID C92.1 – Leucemia mieloide crônica.
² CID C91.0 – Leucemia linfoblástica aguda.
Quais as contraindicações do Zevuxa?
Dasatinibe é contraindicado em pacientes com hipersensibilidade ao Dasatinibe ou a qualquer outro componente da formulação.
Como usar o Zevuxa?
A dose inicial recomendada de Dasatinibe para Leucemia Mieloide Crônica Cromossomo Philadelphia-positivo (LMC Ph+) na fase crônica é 100 mg administrada oralmente uma vez ao dia. A dose inicial recomendada de Dasatinibe para Leucemia Mieloide Crônica Cromossomo Philadelphia-positivo (LMC Ph+) na fase acelerada, blástica mieloide /linfoide, ou para Leucemia Linfoblástica Aguda Cromossomo Philadelphia-positivo (LLA Ph+) é de 140 mg administrada oralmente uma vez ao dia. Os comprimidos não devem ser esmagados ou cortados. Eles devem ser ingeridos inteiros. Dasatinibe pode ser administrado junto ou não com a alimentação, pela manhã ou à noite.
Em estudos clínicos, o tratamento com Dasatinibe foi continuado até a progressão da doença ou até que o paciente não tolerasse mais o medicamento. O efeito da suspensão do tratamento na evolução da doença a longo prazo após atingir-se uma resposta citogenética (incluindo resposta citogenética completa [RCC]) ou resposta molecular maior (RMM) não foi investigado.
Modificação da dose
O aumento ou redução da dose é recomendado baseado na resposta e tolerabilidade individual do paciente.
Concomitantemente com fortes indutores da CYP3A4
O uso concomitante de um forte indutor da CYP3A4 pode diminuir as concentrações plasmáticas de Dasatinibe e deve ser evitado (exemplo: dexametasona, fenitoína, carbamazepina, rifampina, rifabutina, fenobarbital). Erva de São João pode diminuir as concentrações plasmáticas de Dasatinibe de maneira imprevisível e deve ser evitada. Se fortes indutores da CYP3A4 devem ser co-administrados aos pacientes, baseado nos estudos farmacocinéticos, um aumento na dose de Dasatinibe deve ser considerado. Se a dose de Dasatinibe for aumentada, o paciente deve ser cuidadosamente monitorado para a toxicidade.
Concomitantemente com fortes inibidores da CYP3A4
Inibidores da CYP3A4 (exemplo: cetoconazol, itraconazol, claritromicina, atazanavir, indinavir, nefazodona, nelfinavir, ritonavir, saquinavir, telitromicina, e voriconazol) podem aumentar a concentração plasmática de Dasatinibe. Suco de toranja (grapefruit) também pode aumentar a concentração plasmática de Dasatinibe e deve ser evitado.
A escolha de medicação concomitante alternativa com mínimo ou nenhum potencial para inibição enzimática, se possível, é recomendada. Se Dasatinibe precisar ser administrado com um inibidor potente da CYP3A4, um decréscimo da dose deve ser considerado. Baseado em estudos farmacocinéticos, um decréscimo para 20 mg diários deve ser considerado para pacientes tomando 100 mg por dia de Dasatinibe. Para pacientes tomando 140 mg por dia de Dasatinibe, um decréscimo para 40 mg por dia deve ser considerado.
Essas reduções na dose de Dasatinibe são previstas para ajustar a área sob a curva (AUC) para a faixa observada sem inibidores de CYP3A4. No entanto, não existem dados clínicos com esses ajustes de dose em pacientes recebendo fortes inibidores de CYP3A4. Se Dasatinibe não é tolerado após a redução da dose, ou o forte inibidor de CYP3A4 deve ser descontinuado, ou o tratamento com Dasatinibe deve ser interrompido até que o tratamento com o inibidor seja terminado. Quando o forte inibidor é descontinuado, um período de eliminação (washout) de aproximadamente uma semana deve ser considerado antes que a dose de Dasatinibe seja aumentada.
Escalonamento da dose
Em estudos clínicos realizados com pacientes adultos com LMC Ph+ e LLA Ph+, o escalonamento da dose para 140 mg uma vez ao dia (LMC Ph+ fase crônica) ou 180 mg uma vez ao dia (LMC Ph+ fase avançada e LLA Ph+) foi permitido para os pacientes que não atingiram uma resposta hematológica ou citogenética na dose inicial recomendada.
Ajuste da dose para reações adversas
Mielossupressão
Em estudos clínicos, a mielossupressão foi tratada com a interrupção da dose, redução da dose ou suspensão da terapia em estudo. O fator de crescimento hematopoiético tem sido utilizado em pacientes com mielossupressão resistente. Transfusão de plaquetas e transfusão de hemácias foram utilizadas conforme apropriado. As diretrizes para modificação de dose estão resumidas na tabela abaixo.
Tabela 7: Ajustes da Dose para Neutropenia e Trombocitopenia:
| LMC Ph+ Fase crônica (dose inicial 100 mg uma vez ao dia) | CNA* < 0,5 × 109/L ou Plaquetas < 50 109/L | 1. Suspender Dasatinibe até CNA ≥1,0 × 109/L e plaquetas ≥ 50 × 109/L. |
| 2. Recomeçar o tratamento com Dasatinibe na dose original inicial se houver recuperação em ≤ 7 dias. | ||
| 3. Se as plaquetas < 25 × 109/L ou recorrência de CNA < 0,5× 109/L por > 7 dias, repetir a Etapa 1 e reiniciar o Dasatinibe em dose reduzida de 80 mg uma vez ao dia (segundo episódio) ou descontinuá-lo (terceiro episódio). | ||
| LMC Ph+ Fase Acelerada, LMC Ph+ Fase Blástica e LLA Ph+ (dose inicial 140 mg uma vez ao dia) | CNA* < 0,5 × 109/L ou Plaquetas < 10 × 109/L |
1. Verificar se a citopenia está relacionada com a leucemia (aspirado ou biópsia de medula óssea). |
| 2. Se a citopenia não estiver relacionada com a leucemia, suspender Dasatinibe até CNA ≥ 1,0 × 109/L e plaquetas ≥ 20 × 109/L e reiniciar na dose original inicial. | ||
| 3. No caso de recorrência da citopenia, repetir Etapa 1 e reiniciar Dasatinibe na dose reduzida de 100 mg uma vez ao dia (segundo episódio) ou 80 mg uma vez ao dia (terceiro episódio). | ||
| 4. Se a citopenia estiver relacionada com a leucemia, considere o escalonamento da dose para 180 mg uma vez ao dia. |
*CNA: Contagem de neutrófilos absolutos.
Reações adversas não-hematológicas
Caso haja o desenvolvimento de reações adversas não-hematológicas graves com o uso do Dasatinibe, o tratamento deve ser suspenso até a resolução ou melhora do evento. Então o tratamento pode ser reiniciado conforme adequado em uma dose reduzida dependendo da gravidade inicial e da recorrência do evento.
Se uma reação adversa não-hematológica moderada, Grau 2, se desenvolver com Dasatinibe, interromper o tratamento até a resolução do evento ou retorno à linha basal. Retomar com a mesma dose se for primeira ocorrência e com uma dose reduzida se for um evento recorrente.
Se uma reação adversa não-hematológica severa, Grau 3 ou 4, se desenvolver com Dasatinibe, o tratamento deve ser suspenso até a resolução do evento. Depois da resolução, o tratamento pode ser retomado conforme apropriado com uma dose reduzida dependendo da severidade inicial do evento. Para pacientes com LMC na fase crônica que receberam 100 mg uma vez ao dia, é recomendada a redução da dose para 80 mg uma vez ao dia com uma redução maior de 80 mg uma vez ao dia para 50 mg uma vez ao dia, se necessário. Para pacientes com LMC em fase avançada ou LLA Ph+ que receberam 140 mg uma vez ao dia, é recomendada a redução de dose para 100 mg uma vez ao dia com uma redução maior de 100 mg uma vez ao dia para 50 mg uma vez ao dia, se necessário.
Derrame pleural
Se um derrame pleural é diagnosticado, interromper Dasatinibe até o paciente estar assintomático ou tiver retornado à linha basal. Se o episódio não melhorar dentro de aproximadamente uma semana, considerar o uso de diuréticos ou corticosteroides ou ambos concomitantemente. Depois da resolução do primeiro episódio, considerar a reintrodução do Dasatinibe na mesma dose. Depois da resolução de um episódio recorrente, reintroduzir o Dasatinibe em uma dose reduzida. Depois da resolução de um episódio severo (Grau 3 ou 4), o tratamento pode ser retomado com uma dose reduzida apropriada dependendo da severidade do evento.
Manuseio e Descarte
Procedimentos para o manuseio correto e descarte de medicamentos contra o câncer devem ser considerados. Foram publicadas diversas diretrizes sobre o assunto.
Dasatinibe comprimidos consiste de um comprimido central (contendo a substância ativa), revestido por uma camada de filme para impedir a exposição dos profissionais de saúde à substância ativa.
Os produtos não utilizados ou os resíduos devem ser eliminados de acordo com as exigências locais.
Mulheres grávidas devem evitar a exposição aos comprimidos amassados ou quebrados.
Risco de uso por via de administração não recomendada
Para segurança e eficácia desta apresentação, Dasatinibe não deve ser administrado por vias não recomendadas. A administração deve ser somente pela via oral.
Este medicamento não deve ser partido, aberto ou mastigado.
Quais cuidados devo ter ao usar o Zevuxa?
Mielossupressão
O tratamento com Dasatinibe está associado com trombocitopenia, neutropenia e anemia graves (graus 3 e 4), que ocorrem mais cedo e mais frequentemente em pacientes com LMC na fase avançada ou LLA Ph+ do que em pacientes com LMC na fase crônica.
Em pacientes com LMC de fase crônica, hemogramas completos devem ser realizados a cada 2 semanas por 12 semanas e depois disso a cada 3 meses ou quando indicado clinicamente. Em pacientes com LMC de fase avançada ou LLA Ph+, hemogramas completos devem ser realizados semanalmente durante os 2 primeiros meses, e depois mensalmente, ou quando indicado clinicamente.
A mielossupressão é geralmente reversível e tratada suspendendo-se temporariamente o Dasatinibe ou reduzindo-se a dose.
Eventos Relacionados com Sangramento
Em pacientes com LMC fase crônica, hemorragia severa ocorreu em 5 pacientes (1%) tomando Dasatinibe na dose recomendada (n=548).
Além de causar trombocitopenia em humanos, o Dasatinibe causou disfunção plaquetária in vitro. Em todos os estudos clínicos de LMC ou LLA Ph+, hemorragias graves do SNC (sistema nervoso central), incluindo casos fatais, ocorreram em 1% dos pacientes tomando Dasatinibe. Hemorragia gastrintestinal grave ocorreu em 6% dos pacientes e geralmente exigiu interrupções do tratamento e transfusões. Outros casos de hemorragia grave ocorreram em 2% dos pacientes.
A maioria dos eventos relacionados com sangramento nos estudos clínicos foi tipicamente associada com trombocitopenia grave. Em pacientes com LMC em fase crônica recém-diagnosticados tratados com Dasatinibe, dos 6 pacientes que apresentaram eventos de sagramento Grau 3 ou 4, 2 apresentaram evento de sangramento dentro de 3 dias do relato de trombocitopenia severa (Grau 3 ou 4). Estes eventos com contagem de plaquetas associada foram hemorragia GI baixa no dia antes a contagem de plaqueta Grau 4 e hemorragia GI no mesmo dia da contagem de plaqueta Grau 3.
Os pacientes tomando medicamentos que inibem a função plaquetária ou anticoagulantes foram excluídos da participação em estudos clínicos iniciais com Dasatinibe. Em estudos posteriores, o uso de anticoagulantes, aspirina, e antiinflamatórios não esteroidais (AINEs) foi permitido concomitantemente com Dasatinibe se a contagem de plaquetas fosse > 50000-75000 mm³. Deve-se ter cautela se os pacientes necessitarem tomar medicamentos que inibem a função plaquetária ou anticoagulantes.
Retenção de Líquidos
Dasatinibe está associado com a retenção de líquidos. Após 5 anos de acompanhamento do estudo Fase 3 de LMC em fase crônica recém-diagnosticada (n=258), retenção de líquidos grave foi relatada em 13 pacientes (5%) tomando Dasatinibe comparado com 2 pacientes (1%) tomando imatinibe (n=258). O evento adverso relacionado com retenção de líquidos mais comumente relatado foi derrame pleural (28,3%) no grupo com Dasatinibe.
O tempo mediano para a primeira ocorrência de derrame pleural Grau 1 ou 2 relacionado ao medicamento foi 114 semanas (faixa entre 4 - 299 semanas). Em pacientes com derrame pleural ≥ Grau 3 relacionado ao medicamento, o tempo até a primeira ocorrência foi 175 semanas ( faixa entre 114 a 274 semanas). Pacientes com derrame pleural relacionados ao medicamento foram manejados com uma ou mais das opções seguintes: interrupção da dose (61,6%); redução da dose (41,1%); diuréticos (46,6%); corticosteroides (31,5%); combinação de diuréticos e corticosteroides (27,4%); e toracocentese terapêutica (12,3%).
Em todos os pacientes com LMC na fase crônica recém-diagnosticados ou resistentes ou intolerantes ao imatinibe (n=548), a retenção de líquidos grave ocorreu em 32 (6%) dos pacientes tratados com Dasatinibe na dose recomendada (n=548). Em pacientes com LMC ou LLA Ph+ tratados com Dasatinibe na dose recomendada (n=304), retenção de líquido grave foi relatada em 8% dos pacientes, incluindo derrame pleural e do pericárdio grave relatados em 7% e 1% dos pacientes, respectivamente. Eventos de edema pulmonar grave e hipertensão pulmonar grave foram relatados, cada um, em 1% dos pacientes.
Os pacientes que desenvolverem sintomas sugestivos de derrame pleural ou outra retenção de líquido, como dispneia nova ou piorada durante esforço ou em repouso, dor pleurítica ou tosse seca devem ser avaliados imediatamente por radiografia de tórax ou exame de imagem adicional conforme apropriado. Derrame pleural grave pode necessitar toracentese e terapia com oxigênio. Modificação da dose deve ser considerada. Eventos de retenção de líquidos foram tipicamente tratados com medidas de suporte, que pode incluir diuréticos ou administrações de esteróides por períodos curtos.
Prolongamento do intervalo QT
Dados in vitro sugerem que o Dasatinibe tem potencial para prolongar a repolarização ventricular cardíaca (intervalo QT).
Após 5 anos de acompanhamento do estudo clínico Fase 3 de LMC em fase crônica recém-diagnosticada, 1 paciente (<1%) em cada grupo de tratamento com Dasatinibe (n=258) e com imatinibe (n=258) teve prolongamento do intervalo QTc reportado com reação adversa. As alterações médias no QTcF foram 3,0 mseg em pacientes tratados com Dasatinibe comparado com 8,2 mseg em pacientes tratados com imatinibe. Um paciente (<1%) em cada grupo apresentou um QTcF>500 mseg.
Em 865 pacientes com leucemia tratados com Dasatinibe em estudos de Fase II, as alterações médias em QTcF da linha de base, usando o método de Fridericia (QTcF) foram de 4–6 mseg, os intervalos de confiança (ICs) superiores a 95% para todas as alterações médias da linha de base foram <7 mseg. Dos 2182 pacientes com resistência ou intolerância a terapia prévia com imatinibe que tratados com Dasatinibe em estudos clínicos, 15 (1%) pacientes apresentaram prolongamento do intervalo QTc relatado como reação adversa. Vinte e um pacientes (1%) apresentaram um QTcF > 500 mseg.
Dasatinibe deve ser administrado com cuidado em pacientes que apresentam ou que podem apresentar prolongamento do intervalo QTc. Estes incluem pacientes com hipocalemia ou hipomagnesemia, pacientes com síndrome congênita de QT longo, pacientes tomando medicamentos antiarrítmicos ou outros medicamentos que possam levar ao prolongamento do intervalo QT e terapia cumulativa com altas doses de antraciclina. Hipocalemia ou hipomagnesemia devem ser corrigidas anteriormente à administração de Dasatinibe.
Reações adversas cardíacas
Dasatinibe foi estudado em um estudo clínico randomizado de 519 pacientes com LCM na fase crônica recém-diagnosticados que incluíam pacientes com doença cardíaca prévia. As reações adversas cardíacas de falência cardíaca congestiva/ disfunção cardíaca, derrame do pericárdio, arritmias, palpitações, prolongamento do intervalo QT e infarto do miocárdio (incluindo fatal) foram reportadas em pacientes tomando Dasatinibe. Eventos adversos cardíacos foram mais frequentes em pacientes com fatores de risco ou com histórica médica prévia de doença cardíaca.
Pacientes com fatores de risco (como hipertensão, hiperlipidemia, ou diabetes) ou história de doença cardíaca (como intervenção coronária percutânea prévia ou doença arterial coronariana) devem ser monitorados cuidadosamente para sinais e sintomas consistentes com disfunção cardíaca como dor no peito, falta de ar e diaforese. Se estes sinais e sintomas clínicos ocorrerem, aconselha-se a interrupção da administração de Dasatinibe. Após a resolução, uma avaliação funcional deve ser realizada antes da retomada do tratamento com Dasatinibe.
O tratamento com Dasatinibe pode ser retomado nas doses originais se os eventos forem leves ou moderados (≤ Grau 2) ou retomado com redução de dose se o evento for severo (≥ Grau 3). Pacientes com doença cardiovascular significante ou descontrolada não foram incluídos nos estudos clínicos.
Reações Dermatológicas Graves
Casos individuais de reações dermatológicas mucocutâneas graves, incluindo síndrome de Stevens-Johnson e eritema multiforme, foram reportadas com o uso de Dasatinibe.
Dasatinibe deve ser descontinuado permanentemente em pacientes com experiência de reação mucocutânea grave durante o tratamento se nenhuma outra etiologia for identificada.
Hipertensão Arterial Pulmonar
Hipertensão arterial pulmonar (HAP), confirmada por cateterização cardíaca direita, foi relatada em associação ao tratamento com Dasatinibe. Nestes casos, a HAP foi relatada após o início da terapia de Dasatinibe, incluindo manifestações depois de mais de um ano de tratamento. Muitas vezes, os pacientes com HAP relatada durante o tratamento com Dasatinibe estavam tomando medicações concomitantes ou tinham comorbidades em complemento à malignidade subjacente.
Pacientes devem ser avaliados quanto à presença de sinais e sintomas de doença cardiopulmonar subjacente antes de iniciar a terapia com Dasatinibe. Pacientes que desenvolvem dispnéia e fadiga após o início da terapia devem ser avaliados quanto às etiologias mais comuns, incluindo derrame pleural, edema pulmonar, anemia, ou infiltração no pulmão. Durante esta avaliação, as diretrizes para o controle de reações adversas não-hematológicas devem ser seguidas. Caso a reação adversa seja grave, o tratamento deverá ser suspenso até que o evento tenha evoluído para a resolução ou melhorado.
Caso não seja encontrado diagnóstico alternativo, o diagnóstico de HAP deverá ser considerado. Caso a HAP seja confirmada, Dasatinibe deve ser permanentemente descontinuado. Acompanhamento deve ser realizado de acordo com as diretrizes de prática padrão. Melhoras nos parâmetros clínicos e hemodinâmicos foram observadas em pacientes tratados com Dasatinibe com HAP após a interrupção da terapia de Dasatinibe.
Lactose
O Dasatinibe contém 135 mg de lactose monoidratada em uma dose de 100 mg ao dia e 189 mg de lactose monoidratada em uma dose de 140 mg ao dia.
Uso Pediátrico
A segurança e eficácia do Dasatinibe em pacientes com menos de 18 anos de idade não foram estabelecidas.
Uso Geriátrico
Nenhuma diferença na RCC e RMM confirmadas foram observadas entre pacientes jovens e idosos. Dos 2712 pacientes nos estudos clínicos de Dasatinibe, 617 (23%) tinham 65 anos de idade ou mais e 123 (5%) tinham 75 anos ou mais.
Enquanto o perfil de segurança de Dasatinibe na população geriátrica foi similar à população mais jovem, pacientes com 65 anos de idade ou mais foram mais propensos a apresentar as reações adversas mais comumente relatadas: fadiga, derrame pleural, dispneia, tosse, hemorragia gastronintestinal baixa, e distúrbio de apetite, e são mais prováveis de experienciar as reações adversas menos frequentemente reportadas: distenção abdominal, tontura, efusão do pericárido, insuficiência cardíaca congestiva e perda de peso, e devem ser cuidadosamente monitorados.
Insuficiência hepática
O efeito da insuficiência hepática na farmacocinética do Dasatinibe foi avaliado em voluntários saudáveis com função normal do fígado e pacientes com moderada (Child-Pugh Classe B) e grave (Child-Pugh Classe C) insuficiência hepática. Comparado aos voluntários saudáveis com função hepática normal, os parâmetros farmacocinéticos de normalização da dose foram diminuídos nos pacientes com insuficiência hepática.
Nenhum ajuste de dose é necessário em pacientes com insuficiência hepática. Recomenda-se cuidado ao administrar Dasatinibe a pacientes com insuficiência hepática.
Insuficiência Renal
No momento não existem estudos clínicos com Dasatinibe em pacientes com insuficiência renal. Menos de 4% do Dasatinibe e seus metabólitos são excretados pelos rins.
Carcinogênese
Em um estudo de carcinogenicidade de 2 anos, foram administradas a ratos doses orais de Dasatinibe de 0,3; 1 e 3 mg/kg/dia. A maior dose resultou em níveis de exposição plasmática da droga (AUC) de aproximadamente 60% da exposição humana com 100 mg uma vez ao dia.
Foi observado um aumento estatiscamente significativo na incidência combinada de carcinoma de células escamosas e papilomas no útero e colo de doses elevadas em fêmeas e de adenoma de próstata de baixas doses em machos. A relevância desses achados do estudo de carcinogenicidade em ratos para humanos não é conhecida.
Mutagênese
O Dasatinibe foi clastogênico quando testado in vitro em células de ovário de hamster chinês, com ou sem ativação metabólica. O Dasatinibe não foi mutagênico quando testado em um ensaio de células bacterianas in vitro (teste de Ames) e não foi genotóxico em um estudo em células de micronúcleo de ratos in vivo.
Comprometimento da Fertilidade
O Dasatinibe não afetou a fertilidade masculina ou feminina em um estudo de fertilidade convencional e de desenvolvimento embrionário inicial em ratos, mas induziu a letalidade embrionária em exposição à droga plasmática (AUC) similar às exposições em humanos na dose de 100 mg uma vez ao dia.
Em estudos de desenvolvimento embriofetal, o Dasatinibe também induziu a letalidade embrionária com diminuições associadas no tamanho das ninhadas em ratos, bem como alterações esqueléticas fetais em ratos e coelhos. Estes efeitos ocorreram em doses que não produziram toxicidade materna, indicando que o Dasatinibe é uma substância tóxica seletiva para reprodução a partir da implantação até a conclusão da organogênese.
Em um estudo exploratório de desenvolvimento pré e pós natal, a exposição indireta de filhotes de ratos ao Dasatinibe (no útero ou durante o aleitamento) iniciando a partir do final da organogênese até o início da lactação era incompatível com a sobrevivência dos filhotes, mesmo com exposições maternas que são subterapêutica.
Os efeitos potenciais de Dasatinibe no esperma foram avaliados em um estudo oral de fertilidade e desenvolvimento embrionário inicial em ratos. O Dasatinibe não é uma substancia tóxica para a reprodução em ratos machos em exposições clinicamente relevantes. No entanto, os dados da avaliação da toxicidade reprodutiva em pacientes do sexo masculino em tratamento com Dasatinibe são limitados.
Homens e mulheres com vida sexual ativa e em idade fértil devem usar meios de contracepção adequados durante a terapia com Dasatinibe.
Gravidez
O uso de Dasatinibe não é recomendado em mulheres grávidas ou que planejam engravidar. Se Dasatinibe for usado durante a gestação ou caso a paciente engravide durante a terapia com Dasatinibe, a paciente deve ser informada sobre o risco potencial ao feto. Deve-se aconselhar as mulheres com potencial reprodutivo a evitar a gravidez, o que pode incluir o uso de contracepção, durante o tratamento com Dasatinibe.
O Dasatinibe pode causar danos ao feto quando administrado a mulheres grávidas. Desfechos adversos fetais e infantis foram relatados em mulheres que tomaram Dasatinibe durante a gravidez.
Nos estudos de reprodução em animais, foram observadas toxicidades embrio-fetal, incluindo malformações ósseas, em ratos e coelhos em concentrações plasmáticas abaixo daquelas em humanos recebendo doses terapêuticas de Dasatinibe. Houveram relatos pós-comercialização de aborto espontâneo e anomalias fetais e infantis de mulheres que utilizaram Dasatinibe durante a gravidez.
Em estudos pré-clínicos, em concentrações plasmáticas abaixo daquelas observadas em humanos recebendo doses terapêuticas de Dasatinibe, foi observada toxicidade fetal em ratos e coelhos. Morte dos fetos foi observada em ratos.
Categoria D.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica. Informe imediatamente seu médico em caso de suspeita de gravidez.
Lactação
Não se sabe se Dasatinibe é excretado no leite humano. Dado que muitas drogas são excretadas no leite humano e dado o potencial de reações adversas sérias de Dasatinibe em lactentes, deve-se decidir em descontinuar a amamentação ou descontinuar a droga, levando em consideração a importância da droga para a mãe. Mulheres que estão tomando Dasatinibe não devem amamentar.
Capacidade de dirigir veículos e operar máquinas
Nenhum estudo sobre o efeito na capacidade de dirigir e operar máquinas foi realizado. Pacientes devem ser advertidos sobre a possibilidade de apresentar eventos adversos com tontura ou visão borrada durante o tratamento com Dasatinibe. Portanto, recomenda-se cautela na condução de veículos ou operação de máquinas.
Quais as reações adversas e os efeitos colaterais do Zevuxa?
As seguintes reações adversas estão discutidas com mais detalhes em outros itens da bula
- Mielossupressão;
- Eventos relacionados a sangramentos;
- Retenção de líquidos;
- Prolongamento do intervalo QT;
- Reações adversas cardíacas;
- Reações Dermatológicas Graves;
- Hipertensão Pulmonar Arterial.
Pelo fato dos estudos clínicos serem conduzidos sob condições amplamente variadas, as taxas de reações adversas observadas nos estudos clínicos de uma droga não podem ser comparadas diretamente às taxas nos estudos clínicos de uma outra droga e podem não refletir as taxas observadas na prática.
Os dados descritos a seguir demonstram a exposição do Dasatinibe em todas as doses em 324 pacientes com LMC em fase crônica recém-diagnosticada e em 2388 pacientes com LMC ou LLA Ph+ em fase crônica ou avançada intolerantes ou resistentes ao imatinibe nos estudos clínicos, sendo que 1618 pacientes com um mínimo de 2 anos de acompanhamento e 662 pacientes com LMC em fase crônica com acompanhamento mínimo de 84 meses (dose inicial 100 mg uma vez ao dia, 140 mg uma vez ao dia, 50 mg duas vezes ao dia ou 70 mg duas vezes ao dia). A duração média do tratamento em 2712 pacientes tratados com Dasatinibe foi de 19,2 meses (variando entre 0-93,2 meses).
No estudo de Fase 3 de LMC fase crônica recém-diagnosticada, a duração média do tratamento foi de aproximadamente 60 meses tanto para Dasatinibe (variando entre 0,03-72,7 meses) quanto para imatinibe (variando entre 0,3-74,6 meses). A duração média do tratamento em 1618 pacientes com LMC fase crônica foi de 29 meses (variando entre 0-92,9 meses). Em 1094 pacientes com LCM em fase avançada ou LLA Ph+, a duração média do tratamento dos pacientes foi de 6,2 meses (variando entre 0-93,2 meses).
A maioria dos pacientes tratados com Dasatinibe apresentou algum tipo de reação adversa em algum momento. Na população total de 2712 pacientes tratados com Dasatinibe, 520 (19%) tiveram reações adversas que levaram à descontinuação do medicamento.
No estudo Fase 3 de LMC fase crônica recém-diagnosticada, o tratamento foi descontinuado por reações adversas em 14% dos pacientes recebendo Dasatinibe e 7% dos pacientes recebendo imatinibe com acompanhamento mínimo de 60 meses. Entre os 1618 pacientes com LMC fase crônica tratados com Dasatinibe, reações adversas que levaram a descontinuação foram reportadas em 329 (20,3%) dos pacientes, e entre os 1094 pacientes com a doença em fase avançada tratados com Dasatinibe, reações adversas que levaram a descontinuação foram reportadas em 191 (17,5%) pacientes.
Reações adversas reportadas em ≥10% dos pacientes, e outras reações de interesse, em um estudo Fase 3 de LMC fase crônica recém-diagnosticada com acompanhamento mínimo de 60 meses estão apresentados na próxima tabela. Neste estudo, derrame pleural foi reportado em 73 pacientes (28%) tratados com Dasatinibe. O tempo médio para início do derrame pleural Graus 1 e 2 foram 114 semanas (variando entre 4-299 semanas). Menos de 3% dos eventos de derrame pleural foram Grau 3 ou 4. Com cuidado médico apropriado, 58 pacientes (80% daqueles com derrame pleural) puderam continuar com Dasatinibe.
Leucemia Mielóide Crônica recém-diagnosticada
Tebala 8: Reações Adversas Reportadas em ≥10% dos Pacientes em estudo fase 3 (LMC em fase crônica recém-diagnosticada, mínimo de 60 meses de acompanhamento):


a Inclui insuficiência cardíaca aguda, insuficiência cardíaca congestiva, cardiomiopatia, disfunção diastólica, decréscimo da fração de ejeção e disfunção ventricular esquerda.
b Inclui eritema, eritema multiforme, rash, rash generalizado, rash macular, rash papular, esfoliação da pele e rash vesicular.
c Reação adversa de interesse especial com <10% de frequência.
d Inclui hemorragia conjuntival, hemorragia auricular, equimose, epistaxe, hemorragia ocular, sangramento gengival, hematoma, hematúria, hemoptise, hematoma intra-abdominal, petéquia, hemorragia escleral, hemorragia uterina e hemorragia vaginal.
Leucemia Mieloide Crônica resistentes ou intolerantes ao imatinibe
Os eventos adversos graves foram relatados em 26,1% dos pacientes tratados na dose recomendada de 100 mg uma vez ao dia em um estudo clínico Fase 3 com pacientes com LMC na fase crônica resistentes ou intolerantes à terapia anterior com imatinibe. O único evento adverso grave reportado em ≥5% dos pacientes foi derrame pleural (10%).
No estudo clínico de Fase 3 de otimização da dose a duração média do tratamento para pacientes com LMC na fase crônica que receberem 100 mg uma vez ao dia foi de 37 meses (faixa de 1 91 meses). A duração média do tratamento para pacientes com LMC na fase avançada que receberam 140 mg uma vez ao dia foi de 14 meses (faixa de ˂ 1 36 meses) para LMC na fase acelerada, 3 meses (faixa de ˂ 1 32 meses) para LMC na fase mieloide blástica, e 4 meses (faixa de ˂ 1 22 meses) para LMC na fase linfoide blástica.
As reações adversas (excluindo anormalidades laboratoriais) que foram reportadas em pelo menos 10% dos pacientes com LMC que receberam as doses iniciais recomendadas de Dasatinibe estão demonstradas por fase da doença na tabela abaixo.
Tabela 10: Reações Adversas relatadas em ≥ 10% dos pacientes em Estudos Clínicos do Dasatinibe em LMC:
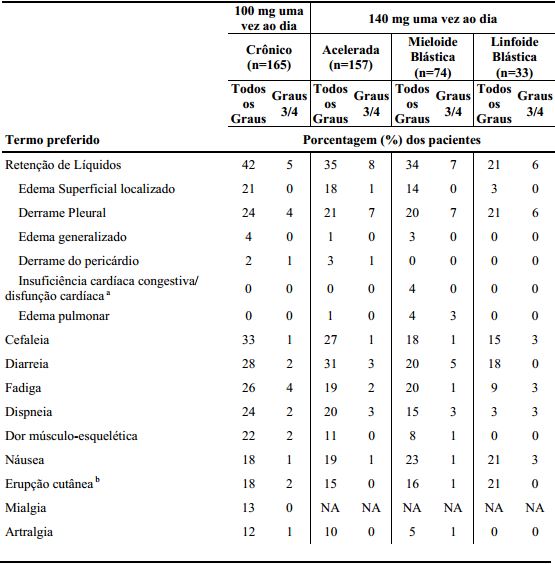
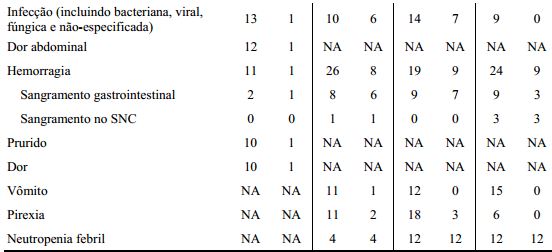
a Inclui disfunção ventricular, insuficiência cardíaca congestiva, cardiomiopatia, cardiomiopatia congestiva, disfunção diastólica, decréscimo da fração de ejeção e insuficiência ventricular.
b Inclui erupção da droga, eritema, eritema multiforme, eritrose, erupção cutânea exfoliativa, eritema generalizado, erupção cutânea genital, erupção cutânea de calor, milia, erupção cutânea, erupção cutânea eritematosa, erupção cutânea folicular, erupção cutânea generalizada, erupção cutânea macular, erupção maculopapular, erupção cutânea papular, erupção pruriginosa, erupção cutânea pustular, esfoliação da pele, irritação da pele, urticária vesiculosa, e erupção cutânea vesicular.
As taxas cumulativas de reações adversas selecionadas que foram relatadas ao longo do tempo em pacientes tratados com a dose de início recomendada de 100 mg uma vez ao dia em um estudo clínico de Fase 3 com pacientes com LMC de fase crônica resistentes ou intolerantes ao imatinibe são apresentadas na tabela a seguir.
Tabela 11: Reações adversas Selecionadas Reportadas em Estudo Clínico Fase 3 de Otimização de Dose (LMC em Fase Crônica Resistente ou Intolerante ao imatinibe)ª:

a Resultados do Estudo Clínico Fase 3 de otimização de dose relatados com a população de dose inicial recomendada de 100 mg uma vez ao dia.
Anormalidades Laboratoriais
A mielossupressão foi comumente relatada em todas as populações de pacientes. Na LMC fase crônica recémdiagnosticada, mielossupressão foi menos frequentemente reportada do que em pacientes com LMC fase crônica resistentes ou intolerantes à terapia prévia com imatinibe. A frequência de neutropenia, trombocitopenia e anemia de Graus 3 ou 4 foi mais alta em pacientes com LMC na fase avançada ou LLA Ph+ do que em pacientes com LMC na fase crônica (Tabela 13). Mielossupressão foi relatada em pacientes com valores laboratoriais basais normais bem como em pacientes que já apresentavam anormalidades laboratoriais.
Em pacientes que apresentaram mielossupressão grave, a recuperação ocorreu geralmente após interrupção ou redução das doses, e a descontinuação permanente do tratamento ocorreu em 2% dos pacientes no estudo de Fase 3 com LMC fase crônica recém-diagnosticados e em 5% dos pacientes no estudo de Fase 3 resistentes ou intolerantes à terapia prévia com imatinibe.
Elevações de Grau 3 ou 4 da transaminase ou bilirrubina e hipocalcemia, hipocalemia e hipofosfatemia de graus 3 e 4 foram relatadas em pacientes em todas as fases de LMC, porém foram relatadas com uma frequência aumentada em pacientes com LMC nas fases mieloide ou linfoide blásticas. Elevações na transaminase ou bilirrubina foram geralmente tratadas com redução ou interrupção da dose. Pacientes desenvolvendo hipocalcemia graus 3 ou 4 durante o tratamento com Dasatinibe frequentemente recuperaram-se com suplementação oral de cálcio.
A tabela abaixo mostra os achados laboratoriais de um estudo clínico com pacientes com LMC fase crônica recémdiagnosticados. Não houve descontinuação de Dasatinibe devido a parâmetros bioquímicos laboratoriais.
Tabela 12: Anormalidades Laboratoriais CTC Grau 3/4 em um Estudo Fase 3 de Pacientes com LMC em Fase Crônica Recém-diagnosticados:
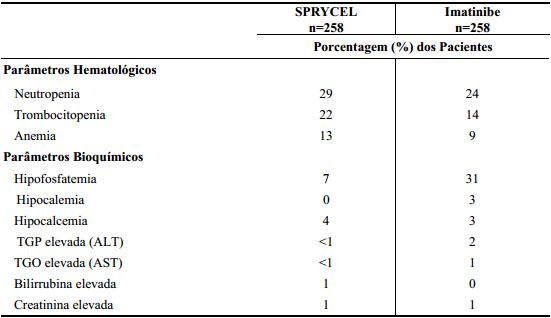
Graus CTC: neutropenia (Grau 3 ≥0.5–<1.0 × 109/L, Grau 4 <0.5 × 109/L); trombocitopenia (Grau 3 ≥25–<50 × 109/L, Grau 4 <25 × 109/L); anemia (hemoglobina Grau 3 ≥65–<80 g/L, Grau 4 <65 g/L); creatinina elevada (Grau 3 >3–6 × limite superior do intervalo normal (ULN), Grade 4 >6 × ULN); bilirrubina elevada (Grau 3 >3– 10 × ULN, Grau 4 >10 × ULN); elevadas TGO ou TGP (Grau 3 >5–20 × ULN, Grau 4 >20 × ULN); hipocalcemia (Grau 3 <7.0–6.0 mg/dL, Grau 4 <6.0 mg/dL); hipofosfatemia (Grau 3 <2.0–1.0 mg/dL, Grau 4 <1.0 mg/dL); hipocalemia (Grau 3 <3.0–2.5 mmol/L, Grau 4 <2.5 mmol/L).
Anormalidades laboratoriais relatadas em pacientes com LMC que receberam as doses iniciais recomendadas de Dasatinibe estão demonstradas, por fase da doença, na tabela a seguir.
Tabela 13: Anormalidades Laboratoriais CTC Grau 3/4 em Estudos Clínicos em LMC:

Graus de CTC: neutropenia (Grau 3 ≥ 0.5 - < 1.0 × 109/L, Grau 4 < 0,5 × 109/L), trombocitopenia (Grau 3 ≥ 25 - < 50 × 109/L, Grau 4 < 25 × 109/L), anemia (hemoglobina Grau 3 ≥ 65 - < 80 g/L, Grau 4 < 65 g/L), elevação de creatinina (Grau 3 > 3 - 6 × o limite superior do intervalo normal (ULN), Grau 4 > 6 × ULN); bilirrubina elevada (Grau 3 > 3 -10 × ULN, grau 4 > 10 x ULN); elevadas TGO ou TGP (Grau 3 > 5 -20 × ULN, grau 4> 20 x LSN), hipocalcemia (Grau 3 < 7,0 - 6,0 mg/dL, Grau 4 < 6,0 mg/dL); hipofosfatemia (Grau 3 < 2,0 -1,0 mg/dL, Grau 4 < 1,0 mg/dL), hipocalemia (Grau 3 < 3,0 – 2,5 mmol/L, Grau 4 < 2,5 mmol/L).
* Parâmetros hematológicos para dosagem de 100 mg uma vez ao dia em pacientes com LMC em fase crônica reflete mínimo de 60 meses de acompanhamento.
Entre os pacientes com LMC em fase crônica, a taxa cumulativa de citopenias grau 3 ou 4 foram semelhantes aos 2 e 5 anos, incluindo: neutropenia (36% vs 36%), trombocitopenia (23% vs 24%) e anemia (13% vs 13%).
Leucemia Linfoblástica Aguda Cromossomo Philadelphia-positivo (LLA Ph+)
Um total de 135 pacientes com LLA Ph+ foram tratados com Dasatinibe em estudos clínicos. A duração média do tratamento foi de 3 meses (faixa de ˂ 1 29 meses). O perfil de segurança de pacientes com LLA Ph+ foi similar ao daqueles com LMC na fase blástica/linfoide. As reações adversas mais frequentemente reportadas incluíram eventos de retenção de líquidos como derrame pleural (24%) e edema superficial (19%), e desordens gastrointestinais como diarreia (31%), náusea (24%), e vômito (16%). Hemorragia (19%), pirexia (17%), erupção cutânea (16%), e dispneia (16%) também foram frequentemente reportados. As reações adversas graves mais frequentemente reportadas incluíram derrame pleural (11%), sangramento gastrointestinal (7%), neutropenia febril (6%), infecção (5%), pirexia (4%), pneumonia (3%), diarreia (3%), náusea (2%), vômito (2%), e colite (2%).
Dados Adicionais de Estudos Clínicos
Os seguintes eventos adversos foram relatados em pacientes nos estudos clínicos de LMC e LLA Ph+ com Dasatinibe em uma frequência muito comum (≥ 10%), comum (1% < 10% ), incomum (0,1% < 1% ) ou raro (< 0,1%). Estes eventos são incluídos com base na relevância clínica.
Tabela 14: Resumo Tabulado das Reações Adversas:
| Classe de sistema de órgãos | Categoria de frequência | Reações adversas |
| Distúrbios gastrointestinais | Muito comum | Diarreia, náusea, vômito, dor abdominal. |
| Comum | Sangramento gastrointestinal, inflamação das mucosas (incluindo mucosite/estomatite), dispepsia, distenção abdominal, constipação, gastrite, colite (incluindo colite neutropênica), patologias dos tecidos moles da via oral. | |
| Incomum | Ascite, disfagia, fissura anal, úlcera gastrointestinal superior, esofagite, pancreatite, doença do refluxo gastroesofágico. | |
| Raro | Aastroenteropatia perdedora de proteínas, íleo paralítico, pancreatite aguda, fístula anal. | |
| Distúrbios gerais e condições no local de administração | Muito comum | Fadiga, pirexia, edema periférico, edema facial. |
| Comum | Astenia, dor, dor no peito, edema generalizado, arrepios. | |
| Incomum | Mal-estar, outro edema superficial. | |
| Raro | Alteração de marcha. | |
| Distúrbios da pele e tecidos subcutâneos | Muito comum | Rash cutâneo. |
| Comum | Prurido, alopécia, acne, pele seca, hiper-hidrose, urticária, dermatite (incluindo eczema). | |
| Incomum | Distúrbio de pigmentação, úlcera da pele, condições bolhosas, reação de fotossensibilidade, distúrbio nas unhas, dermatose neutrofílica, paniculite, síndrome de eritrodisestesia palmo-plantar, alteração capilar. | |
| Raro | Vasculite leucocitoclástica, fibrose cutânea. | |
| Desconhecido | Síndrome de Stevens-Johnsonb. | |
| Distúrbios respiratórios, torácicos e do mediastino | Muito comum | Derrame pleural, dispneia. |
| Comum | Edema pulmonar, infiltração pulmonar, pneumonite, hipertensão pulmonar, tosse. | |
| Incomum | Asma, broncoespasmo, disfonia, hipertensão arterial pulmonar. | |
| Raro | Síndrome da angústia respiratória aguda, embolismo pulmonar. | |
| Desconhecido | Doença pulmonar intersticial. | |
| Distúrbios do sistema nervoso | Muito comum | Cefaleia. |
| Comum | Neuropatia (incluindo neuropatia periférica), tontura, disgeusia, sonolência. | |
| Incomum | Sangramento no sistema nervoso central, amnésia, tremor, síncope, distúrbio de equilíbrio. | |
| Raro | Convulsões, acidente vascular cerebral, ataque isquêmico transitório, neurite óptica, paralisia do 7º nervo, demência, ataxia. | |
| Distúrbios do sangue e sistema linfático | Muito comum | Mielosupressão (incluindo anemia, neutropenia e trombocitopenia). |
| Comum | Neutropenia febril. | |
| Incomum | Linfoadenopatia, linfopenia. | |
| Raro | Aplasia pura de células vermelhas. | |
| Distúrbios músculo esqueléticos e do tecido conjuntivo | Muito comum | Dor músculo-esquelética. |
| Comum | Artralgia, mialgia, fraqueza muscular, rigidez muscular esquelética, espasmo muscular. | |
| Incomum | Rabdomiólise, tendinite, inflamação muscular, osteonecrose, artrite. | |
| Investigações | Comum | Aumento do peso, diminuição do peso. |
| Incomum | Creatino-fosfoquinase sanguínea aumentada, aumento da gama-glutamiltransferase. | |
| Infecções e infestações | Muito comum | Infecção (incluindo bacteriana, viral,fúngica e não específica). |
| Comum | Pneumonia (incluindo bacteriana, viral e fúngica), infecções/ inflamação do trato respiratório superior, infecção pelo vírus do herpes, infecção enterocolite; septicemia (incluindo relatos incomuns de resultados fatais). | |
| Desconhecido | Reativação da hepatite B. | |
| Distúrbios do metabolismo e nutrição | Comum | Distúrbios do apetite, hiperuricemia. |
| Incomum | Hipoalbuminemia, síndrome da lise tumoral, desidratação, hipercolesterolemia. | |
| Raro | Diabetes mellitus. | |
| Distúrbios cardíacos | Comum | Derrame pericárdico, insuficiência cardíaca congestiva/ disfunção cardíaca, arritmias (incluindo taquicardia), palpitações. |
| Incomum | Angina pectoris, cardiomegalia, pericardite, arritmia ventricular (incluindo taquicardia ventricular), infarto do miocárdio (incluindo resultados fatais), prolongamento do intervalo QT, eletrocardiograma da onda T anormal, aumento da troponina. | |
| Raro | Cor pulmonale, miocardite, síndrome coronariana aguda, parada cardíaca, prolongamento do intervalo PR do letrocardiograma, doença arterial coronariana, pleuropericardite. | |
| Desconhecido | Fibrilação atrial / flutter atrial a. | |
| Distúrbios oculares | Comum |
Distúrbio visual (incluindo perturbação visual, visão obscurecida, e acuidade visual reduzida), vista seca. |
| Incomum | Conjuntivite, deficiência visual, fotofobia, aumento do lacrimejamento. | |
| Distúrbios vasculares | Muito comum | Hemorragia. |
| Comum | Rubores, hipertensão. | |
| Incomum | Hipotensão, tromboflebite. | |
| Raro | Livedo reticulares, trombose venosa profunda, embolismo. | |
| Distúrbios psiquiátricos | Comum | Insônia, depressão. |
| Incomum | Ansiedade, instabilidade emocional, confusão, redução da libido. | |
| Gravidez, Puerpério e Condições pré-natais | Raro | Aborto. |
| Distúrbios do sistema reprodutivo e mamas | Incomum | Ginecomastia, desordem menstrual. |
| Lesões, intoxicações e complicações do procedimento | Comum | Contusão. |
| Distúrbios do ouvido e labirinto | Comum | Tinitus. |
| Incomum | Vertigem, perda da audição. | |
| Distúrbios hepatobiliares | Incomum | Colestase, colecistite, hepatite. |
| Distúrbios renais e urinários | Incomum | Frequência urinária, insuficiência renal, proteinúria. |
| Raro | Falência renal. | |
| Desconhecido | Síndrome nefrítica. | |
| Distúrbios imunológicos | Incomum | Hipersensibilidade (incluindo eritema nodoso). |
| Distúrbios endócrinos | Incomum | Hipotireoidismo. |
| Raro | Hipertireoidismo, tireoidite. |
a Tipicamente reportado em pacientes idosos ou em pacientes com fatores de confusão, incluindo significantes distúrbios cardiovasculares ou cardíacos simultâneos ou subjacentes, ou outras comorbidades significantes (por exemplo.: infecção grave / sepse, anormalidades eletrolíticas).
b No período pós-comercialização foram relatados casos individuais de síndrome de Stevens-Johnson. Não foi possível determinar se estas reações mucocutâneas adversas estavam diretamente relacionadas a Dasatinibe ou a medicações concomitantes.
Atenção: este produto é um medicamento que possui nova indicação terapêutica e nova concentração no país e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos imprevisíveis ou desconhecidos. Neste caso, notifique os eventos adversos pelo Sistema de Notificações em Vigilância Sanitária NOTIVISA ou para a Vigilância Sanitária Estadual ou Municipal.
Interação medicamentosa: quais os efeitos de tomar Zevuxa com outros remédios?
Drogas que podem aumentar a concentração plasmática do Dasatinibe
Inibidores da CYP3A4
O Dasatinibe é um substrato da CYP3A4. Em um estudo com 18 pacientes com tumores sólidos, 20 mg de Dasatinibe administrado uma vez ao dia, juntamente com 200 mg de cetoconazol duas vezes ao dia aumentaram a Cmáx e AUC do Dasatinibe em quatro e cinco vezes, respectivamente. O uso concomitante de Dasatinibe e drogas que inibem a CYP3A4 (exemplo: cetoconazol, itraconazol, eritromicina, claritromicina, ritonavir, atazanavir, indinavir, nelfinavir, nefazodona, saquinavir, telitromicina e voriconazol) podem aumentar a exposição ao Dasatinibe e devem ser evitadas. A escolha de medicação concomitante alternativa com mínimo ou nenhum potencial para inibição de CYP3A4 é recomendada. Se a administração sistêmica de um potente inibidor de CYP3A4 não puder ser evitada, o paciente deve ser monitorado de perto para a toxicidade.
Drogas que podem diminuir a concentração plasmática do Dasatinibe
Indutores da CYP3A4
Medicamentos que induzem a atividade da CYP3A4 podem reduzir a exposição ao Dasatinibe. Quando uma dose matinal de Dasatinibe foi administrada após 8 dias de administração contínua pela noite de 600mg de rifampicina, um potente indutor da CYP3A4, a Cmáx média e AUC de Dasatinibe diminuíram em 81% e 82%, respectivamente. Agentes alternativos com nenhum ou mínimo potencial de indução da enzima devem ser considerados. Se Dasatinibe deve ser administrado com um indutor de CYP3A4 (exemplo: dexametasona, fenitoína, carbamazepina, rifampina, rifabutina, fenobarbital), um aumento de dose de Dasatinibe deve ser considerado. Não é recomendado o uso de potentes indutores da CYP3A4 concomitantemente com Dasatinibe.
Antiácidos
Dados pré-clínicos demonstraram que a solubilidade do Dasatinibe é dependente do pH. Em um estudo com 24 indivíduos saudáveis, a administração de 30 mL de hidróxido de alumínio/ hidróxido de magnésio 2 horas antes de uma dose única de 50mg de Dasatinibe não foi associada com mudanças relevantes na AUC de Dasatinibe; entretanto, a Cmáx de Dasatinibe aumentou 26%.
Quando 30 mL de hidróxido de alumínio/ hidróxido de magnésio foi administrado aos mesmos indivíduos concomitantemente com uma dose de 50mg de Dasatinibe, uma redução de 55% na AUC de Dasatinibe e uma redução de 58% na Cmáx foram observadas. Administração simultânea de Dasatinibe com antiácidos deve ser evitada. Se uma terapia antiácida for necessária, o antiácido deve ser administrado pelo menos 2 horas antes ou 2 horas depois da dose de Dasatinibe.
Antagonistas de H2/ inibidores da bomba de prótons
Supressão da secreção gástrica por antagonistas de H2 ou inibidores de bomba de prótons (exemplo: famotidina e omeprazol), por longos períodos, poderá reduzir a exposição do Dasatinibe. Em um estudo com 24 indivíduos saudáveis, administração de uma dose única de 50 mg de Dasatinibe 10 horas após famotidina reduziu a AUC e a Cmáx de Dasatinibe em 61% e 63%, respectivamente. O uso concomitante de antagonistas de H2 ou inibidores da bomba de prótons com Dasatinibe não é recomendado. O uso de antiácidos deve ser considerado no lugar de antagonistas de H2 ou inibidores da bomba de prótons em pacientes recebendo Dasatinibe.
Drogas que podem ter suas concentrações plasmáticas alteradas pelo Dasatinibe
Substratos da CYP3A4
Dados de um estudo de dose única realizado com 54 indivíduos sadios indicam que a Cmáx média e AUC da sinvastatina, um substrato da CYP3A4, foram aumentadas em 37% e 20%, respectivamente, quando a sinvastatina foi administrada em combinação com uma dose única de 100 mg de Dasatinibe.O uso concomitante de Dasatinibe com o substrato da CYP3A4 pode aumentar a exposição do substrato da CYP3A4. Desta maneira, substratos da CYP3A4 conhecidos por ter baixo índice terapêutico como, alfentanil, astemizil, terfenadina, cisaprida, ciclosporina, fentanil, pimozida, quinidina, sirolimus, tacrolimus e alcalóides de ergot (ergotamina, diidroergotamina) devem ser administrados com cautela em pacientes recebendo Dasatinibe.
Especificações sobre o Zevuxa
Caracteristicas Principais
| Fabricante | EMS | |
| Tipo do Medicamento | Similar | |
| Necessita de Receita | Branca Comum (Venda Sob Prescrição Médica) | |
| Princípio Ativo | Dasatinibe | |
| Categoria do Medicamento | Câncer | |
| Classe Terapêutica | Ação Inibidores Preoteína Kinase Antineoplásicos, BCR-ABL | |
| Especialidades | Oncologia | |
| Registro no Ministério da Saúde | 1023514120066 | |
| Código de Barras | 7896004781563 | |
| Temperatura de Armazenamento | Temperatura ambiente | |
| Produto Refrigerado | Este produto não precisa ser refrigerado | |
| Modo de Uso | Uso oral | |
| Pode partir | Esta apresentação não pode ser partida | |
Sobre a EMS
Fundada há mais de 50 anos, a EMS é líder no segmento farmacêutico há mais de uma década. A sua consolidação no panorama nacional é resultado de muito investimento em pesquisa e desenvolvimento.
A liderança de mercado no Brasil também se deu pela agilidade e o caráter pioneiro, que construíram uma relação de confiabilidade com a classe médica. Com diversos produtos no segmento farmacêutico, a EMS continua investindo e crescendo para um futuro ainda mais promissor.
Isso tudo com o mesmos valores que trouxeram a empresa até a posição que ela ocupa hoje: responsabilidade, ousadia, simplicidade, excelência e valorização de pessoas, promovendo assim saúde e bem-estar.
Que tal conferir outros itens? Temos outras opções que podem te interessar!

