Invega
- DoseQuantidade de princípio ativo por unidade, como 50mg por comprimido.
- Quantidade na embalagemNúmero de unidades do produto por embalagem.
- Paliperidona
C1 Branca 2 vias (Venda Sob Prescrição Médica - Este medicamento pode causar Dependência Física ou Psíquica)
Temperatura ambiente
Não pode ser partido
Bula do Invega
Invega, para o que é indicado e para o que serve?
Adultos
Invega® (paliperidona) é indicado para o tratamento de:
- Esquizofrenia, incluindo tratamento agudo e prevenção de recorrência.
- Transtorno esquizoafetivo em monoterapia e em combinação com antidepressivos e/ou estabilizadores do humor.
Adolescentes
Invega® (paliperidona) é indicado para o tratamento da esquizofrenia em adolescentes de 12 a 17 anos de idade.
Como o Invega funciona?
A paliperidona é um antagonista dopaminérgico D2 de ação central com atividade antagonista 5-HT2A serotoninérgica predominante. A paliperidona também é ativa como antagonista nos receptores alfa1 e alfa-2-adrenérgicos e nos receptores histaminérgicos H1. A paliperidona não apresenta afinidade pelos receptores colinérgicos muscarínicos ou beta-1 e beta-2-adrenérgicos. A atividade farmacológica dos enantiômeros (+)- e (-)- da paliperidona é quali e quantitativamente semelhantes. Foi proposto que a atividade terapêutica do medicamento em esquizofrenia é mediada por uma combinação de antagonismo de receptor dopaminérgico do tipo 2 (D2) e serotoninérgico do tipo 2 (5HT2A). O antagonismo em receptores diferentes do D2 e do 5HT2A pode explicar parte dos outros efeitos da paliperidona.
O tempo médio estimado para o início da ação terapêutica do medicamento é de 4 a 8 dias.
Quais as contraindicações do Invega?
Não utilize Invega® se você tiver hipersensibilidade (alergia) a paliperidona ou aos excipientes da fórmula. A paliperidona corresponde a um metabólito ativo da risperidona, portanto, o uso de Invega® também é contraindicado se você apresentar hipersensibilidade à risperidona.
Como usar o Invega?
Invega® deve ser tomado por via oral, acompanhado ou não pela ingestão de alimentos. Os comprimidos de Invega® devem ser tomados inteiros, com um pouco de líquido e não devem ser mastigados, partidos ou esmagados.
Invega® deve ser tomado toda manhã com ou sem café da manhã, porém da mesma maneira todos os dias.
Não alterne tomando Invega® sem café da manhã em um dia e com café da manhã no dia seguinte. A medicação está contida em um comprimido planejado para liberar a paliperidona de forma prolongada. O revestimento do comprimido, em conjunto com os componentes insolúveis, é eliminado do organismo. Não há motivo para preocupação se, ocasionalmente, você notar algo parecido com um comprimido nas fezes.
Dosagem
Adultos (idade acima de 18 anos)
Esquizofrenia
A dose recomendada de Invega® para o tratamento de esquizofrenia em adultos é de 6 mg, uma vez ao dia, administrada pela manhã. Não é necessária a titulação inicial de dose. Alguns pacientes podem se beneficiar de doses mais baixas ou mais altas dentro da faixa de dose recomendada de 3 a 12 mg uma vez ao dia. O ajuste de dose, se indicado, deve ocorrer somente após reavaliação clínica. Quando aumentos de dose forem indicados, recomenda-se incrementos de 3 mg/dia e geralmente estes devem ocorrer em intervalos maiores do que 5 dias.
Transtorno esquizoafetivo
A dose recomendada de Invega® para o tratamento do transtorno esquizoafetivo em adultos é de 6 mg uma vez ao dia, administrada pela manhã. Não é necessária a titulação da dose inicial. Alguns pacientes podem se beneficiar de doses mais baixas ou mais elevadas dentro de uma escala de dose recomendada, que varia de 3 a 12 mg uma vez ao dia. Foi observada uma tendência geral para maior eficácia com doses mais altas. O ajuste de dose, se indicado, deve ocorrer somente após a reavaliação clínica. Quando os aumentos de dose são indicados, são recomendados os aumentos de 3 mg/dia e geralmente deve ocorrer em intervalos de mais de 4 dias.
Adolescentes (idade entre 12 e 17 anos)
Esquizofrenia
A dose recomendada de Invega® para o tratamento de esquizofrenia em adolescentes de 12 a 17 anos de idade é de 3 mg, uma vez ao dia, administrado pela manhã. Não é necessária a titulação inicial de dose. Alguns pacientes podem se beneficiar de uma dose mais alta, de 6 a 12 mg/dia. Aumentos de dose devem ser realizados somente após reavaliação clínica e devem ocorrer em incrementos de 3 mg/dia em intervalos maiores do que 5 dias.
Populações especiais
Pacientes com insuficiência hepática
Não é necessário ajustar a dose em pacientes com insuficiência hepática leve a moderada. Invega® não foi estudado em pacientes com insuficiência hepática grave.
Pacientes com insuficiência renal
Para pacientes com insuficiência renal leve, a dose inicial recomendada é de 3 mg uma vez ao dia. A dose deve ser aumentada para 6 mg uma vez ao dia baseada na tolerabilidade e resposta clínica.
Para pacientes com insuficiência renal moderada a grave, a dose recomendada é 3 mg uma vez ao dia. Como Invega® não foi estudado em pacientes com depuração de creatinina < 10 mL/min, não se recomenda o uso nestes pacientes.
Pacientes idosos
As recomendações posológicas para pacientes idosos com função renal normal são as mesmas que para adultos com função renal normal. No entanto, como os pacientes idosos podem ter função renal diminuída, o médico poderá ajustar a dose de acordo com o estado da função renal.
Adolescentes e crianças
A segurança e a eficácia de Invega® para o tratamento da esquizofrenia em pacientes com idade inferior a 12 anos não foram estabelecidas.
Outras populações especiais
Não há recomendação para ajuste da dose de Invega® em função do sexo, raça ou se você é fumante ou não.
Troca por outros agentes antipsicóticos
Não existem dados sistematicamente coletados que se referem à troca de Invega® por outros agentes antipsicóticos. Devido às diferenças entre as propriedades farmacodinâmicas e farmacocinéticas de tais medicamentos, é necessária a orientação de um médico, no caso de troca por outros agentes antipsicóticos.
Invega® está na forma de comprimidos de liberação prolongada para que a liberação de seu princípio ativo, a paliperidona, ocorra por 24 horas de uma maneira controlada.
A paliperidona in vivo é liberada a uma taxa razoavelmente constante:
1-2% da quantidade administrada por hora.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento.
Não interrompa o tratamento sem o conhecimento de seu médico.
Esse medicamento não deve ser partido, aberto ou mastigado.
O que devo fazer quando me esquecer de usar o Invega?
Se você se esquecer de usar Invega®, não tome uma dose dupla para suprir a dose esquecida. Se você se esquecer de uma dose, tome sua próxima dose no dia seguinte ao esquecimento da dose. Se você se esquecer de duas doses ou mais, fale com o seu médico.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Quais cuidados devo ter ao usar o Invega?
Síndrome neuroléptica maligna
O uso da paliperidona, assim como o uso de outros medicamentos com propriedades semelhantes, tem sido associado ao aparecimento de um quadro grave denominado síndrome neuroléptica maligna, caracterizado por febre, rigidez dos músculos, sonolência e exames alterados, como níveis elevados de creatina fosfoquinase (tipo de exame de sangue) e perda aguda da função dos rins. Se você apresentar esses sintomas, procure o mais rápido possível o seu médico, pois será necessário interromper o tratamento com Invega®, além de outras medidas complementares.
Discinesia tardia/Sintomas extrapiramidais
O uso de paliperidona, assim como o uso de outros medicamentos com propriedades semelhantes, tem sido associado ao aparecimento de movimentos involuntários rítmicos, predominantemente da língua e/ou face. Se você apresentar esse sintoma, procure o médico, pois pode ser necessário interromper o tratamento com Invega®.
Sintomas extrapiramidais e psicoestimulantes
É necessário ter precaução com pacientes que recebam simultaneamente psicoestimulantes (por exemplo, metilfenidato) e paliperidona, uma vez que podem surgir sintomas extrapiramidais quando se ajusta um ou ambos os medicamentos. A retirada gradual de um ou ambos os tratamentos deve ser considerada.
Intervalo QT
Assim como outros antipsicóticos, deve-se ter cautela quando Invega® é prescrito a pacientes com histórico de arritmias cardíacas, em pacientes com síndrome congênita do prolongamento do intervalo QT e em uso concomitante com medicamentos que conhecidamente prolongam o intervalo QT.
Hiperglicemia e diabetes mellitus
Informe ao médico se você é diabético ou se tem fatores de risco para diabetes, para que ele possa monitorar o seu nível de glicose durante o tratamento com Invega®.
Ganho de peso
Foi observado ganho de peso com o uso de antipsicóticos atípicos, como Invega®. Seu médico poderá monitorar seu peso durante o tratamento com Invega®.
Hipotensão ortostática
A paliperidona pode causar queda da pressão arterial ao se levantar (hipotensão ortostática). Invega® deve ser usado com cuidado se você apresenta doença do coração, [como por exemplo insuficiência cardíaca, infarto ou isquemia do músculo do coração (miocárdio), anormalidades da condução], doença vascular cerebral ou condições que predispõem a pressão arterial baixa (como por exemplo, desidratação, redução da quantidade de sangue no corpo e tratamento com medicamentos antihipertensivos).
Convulsões
Invega® deve ser usado com cautela em pacientes com história de convulsões. Assim, informe ao médico se você tiver epilepsia.
Potencial para obstrução gastrintestinal
Uma vez que o comprimido de Invega® não se deforma e não altera consideravelmente sua forma no trato gastrintestinal (estômago e intestino), você não deve tomar Invega® se tiver estreitamento gastrintestinal grave pré-existente ou dificuldade para engolir o comprimido inteiro.
Pacientes idosos com demência
Invega® não foi estudado em pacientes idosos com demência.
Mortalidade geral:
Em uma revisão de 17 estudos clínicos, pacientes idosos com demência tratados com outros fármacos antipsicóticos atípicos, incluindo a risperidona, tiveram um risco aumentado de mortalidade em comparação ao placebo. Dentre os pacientes tratados com risperidona, a mortalidade foi de 4% comparada com 3,1% para o grupo placebo.
Eventos adversos vasculares cerebrais
Em estudos clínicos controlados com placebo em pacientes idosos com demência, tratados com medicamentos antipsicóticos atípicos, incluindo a risperidona, houve uma incidência maior de eventos adversos relacionados a irrigação do cérebro (derrame e episódios passageiros de circulação inadequada de sangue), incluindo mortes, em comparação ao placebo.
Leucopenia, neutropenia e agranulocitose
Eventos de leucopenia, neutropenia e agranulocitose foram relatados com agentes antipsicóticos, incluindo Invega®. Agranulocitose foi relatada muito raramente (< 1/10.000 pacientes) durante a vigilância pós-comercialização.
Durante os primeiros meses de tratamento, seu médico deve monitorar sua contagem de células brancas se você tiver um histórico de baixa contagem de células brancas do sangue (CBS) ou leucopenia/neutropenia induzida por medicamento, e ele deve considerar a descontinuação de Invega® ao primeiro sinal de queda clinicamente significativa nas CBS na ausência de outros fatores causadores.
Se você tiver neutropenia clinicamente significativa, seu médico deve monitorar cuidadosamente para febre ou outros sintomas ou sinais de infecção e tratá-los imediatamente se tais sintomas ou sinais ocorrerem. Pacientes com neutropenia grave (contagem absoluta de neutrófilos < 1 X 109/L) devem descontinuar Invega® e ter suas contagens de células brancas (CBS) acompanhadas até sua recuperação.
Tromboembolismo venoso
Casos de tromboembolismo venoso (TEV) foram relatados com medicamentos antipsicóticos. Seu médico deverá identificar, antes e durante o tratamento com Invega®, se você possui fatores de risco adquiridos para TEV e, se necessário, tomar medidas preventivas.
Doença de Parkinson e demência com corpos de Lewy
Informe ao médico se você tem doença de Parkinson ou demência (com corpos de Lewy). Ele decidirá se você pode tomar Invega®, pois na presença dessas doenças você tem maior risco de apresentar um quadro denominado síndrome neuroléptica maligna, caracterizado por febre, rigidez muscular, sonolência e exames alterados como níveis elevados de creatina fosfoquinase (tipo de exame de sangue), além de ter maior sensibilidade aos medicamentos antipsicóticos. A sensibilidade aumentada manifesta-se por confusão, dificuldade para se manter em pé com quedas frequentes, além de sintomas denominados extrapiramidais, tais como movimentos involuntários e rigidez dos músculos.
Priapismo (ereção persistente do pênis)
Tem sido relatado que fármacos com efeitos parecidos com os da paliperidona induzem a ereção persistente do pênis, casos de priapismo foram relatados com paliperidona durante o período de pós-comercialização.
Controle da temperatura corporal
A interrupção da capacidade do corpo de reduzir a temperatura corporal tem sido atribuída a agentes antipsicóticos. Assim, se você estiver tomando Invega®, recomenda-se cuidado ao se expor a condições que possam contribuir para o aumento da temperatura corporal, como por exemplo, exercício exagerado, exposição ao calor extremo, uso conjunto de remédios com efeito chamado anticolinérgico ou em situações de desidratação.
Controle de náuseas e vômitos
Um maior controle de náuseas e vômitos foi observado em estudos pré-clínicos com a paliperidona.
Esse efeito, se ocorrer em seres humanos, pode mascarar os sinais e sintomas de dose excessiva com certos medicamentos ou de condições tais como obstrução intestinal, síndrome de Reye e tumor cerebral.
Síndrome da Íris Flácida Intraoperatória
Durante uma operação nos olhos por turvação do cristalino (catarata), a pupila (círculo preto no meio do olho) pode não aumentar de tamanho conforme necessário. Além disso, durante a cirurgia, a íris (parte colorida do olho) pode se tornar flácida, provocando danos nos olhos. Informe seu médico que você está fazendo o uso deste medicamento, caso esteja planejando uma operação nos olhos.
Efeito sobre a capacidade de dirigir veículos e utilizar máquinas
Invega® pode interferir com as atividades que requerem atenção e concentração e pode ocasionar efeitos visuais.
Durante o tratamento, você não deve dirigir veículos ou operar máquinas, pois sua habilidade e atenção podem estar prejudicadas.
Gravidez e Amamentação
A segurança da paliperidona para uso em mulheres grávidas não foi estabelecida. Invega® só deve ser usado durante a gestação se os benefícios superarem os riscos. O efeito de Invega® sobre o trabalho de parto e o parto em seres humanos é desconhecido.
Recém-nascidos expostos a medicamentos antipsicóticos (incluindo paliperidona) durante o terceiro trimestre de gravidez correm o risco de apresentar sintomas extrapiramidais e/ou de retirada, que podem variar em gravidade após o parto. Estes sintomas em recém-nascidos podem incluir agitação, aumento da rigidez muscular, diminuição da rigidez muscular, tremor, sonolência, dificuldade respiratória ou transtornos alimentares.
Em estudos em animais com a paliperidona e em estudos em seres humanos com a risperidona, a paliperidona foi excretada no leite. Portanto, as mulheres não devem amamentar crianças durante o tratamento com Invega®.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
A segurança e a eficácia de Invega® para o tratamento da esquizofrenia em pacientes com idade inferior a 12 anos não foram estabelecidas.
Quais as reações adversas e os efeitos colaterais do Invega?
As reações adversas a Invega® relatadas por pacientes adultos com esquizofrenia tratados com 6 mg de Invega® em estudos clínicos são:
Dor de cabeça (12%), tontura (5%), sintomas extrapiramidais (2%), sonolência (3%), inquietação (3%), tremor (3%), aumento da rigidez muscular (1%), espasmos musculares (1%), sedação (5%), parkinsonismo (< 1%), taquicardia sinusal (4%), batimentos cardíacos acelerados (7%), bloqueio de ramo (1%), arritmia sinusal (1%), vômito (3%), diminuição da pressão sanguínea ao mudar de posição (1%), boca seca (3%), dor abdominal alta (3%), aumento da secreção da saliva (<1%), fraqueza muscular (<1%), fadiga (1%), crise oculógira e bloqueio atrioventricular de 1o grau.
As reações adversas a Invega® relatadas por pacientes adolescentes com esquizofrenia, com idade de 12 a 17 anos, tratados com Invega® em estudos clínicos são:
Nasofaringite (4%), insônia (7%), ansiedade (2%), sonolência (13%), inquietação (11%), dor de cabeça (4%), tremor (7%), espasmos musculares (4%), tontura (2%), movimentos involuntários (2%), sedação (2%), sonolência excessiva (4%), crise oculógira (4%), batimentos cardíacos acelerados (7%), taquicardia sinusal (2%), sangramento nasal (2%), vômito (11%), náusea (2%), aumento da secreção da saliva (2%), dor abdominal alta (2%), rigidez muscular (2%), torcicolo (2%), produção de leite em homens ou fora do período pós-parto ou de lactação (4%), fadiga (2%), fraqueza muscular (2%), aumento de peso (2%), rigidez em roda denteada, sintomas extrapiramidais, letargia, contrações musculares involuntárias, paralisia da língua, visão turva, boca seca, inchaço da língua, contração muscular, ausência de menstruação, inchaço mamário.
As reações adversas a Invega® relatadas por ≥ 2% dos pacientes com transtorno esquizoafetivo tratados com Invega® em estudos clínicos são:
Nasofaringite (3%), aumento do apetite (2%), tremor (8%), inquietação (5%), sedação (5%), sonolência (5%), aumento da rigidez muscular (5%), salivação (2%), dificuldade em articular a fala (2%), náusea (6%), dificuldade na digestão dos alimentos (5%), prisão de ventre (4%), dor muscular (2%) e aumento de peso (4%).
As reações adversas relatadas com paliperidona e/ou risperidona por ≥ 2% de pacientes tratados com Invega® nos estudos clínicos de esquizofrenia e transtorno esquizoafetivo são:
Infecção no trato respiratório superior, insônia, acatisia (sentimento de inquietação interna), distonia (espasmos musculares involuntários), parkinsonismo, desconforto abdominal, diarreia, dor musculoesquelética.
As reações adversas relatadas com paliperidona e/ou risperidona por <2% de pacientes tratados com Invega® nos estudos clínicos de esquizofrenia e transtorno esquizoafetivo são:
Acarodermite (erupção cutânea causada por ácaros), bronquite, celulite (erupção bacteriana no tecido subcutâneo), cistite, infecção de ouvido, gripe, onicomicose (infecção nas unhas causada por fungos), pneumonia, infecção do trato respiratório, sinusite, tonsilite, infecção no trato urinário, anemia, diminuição do hematócrito (porcentagem ocupada pelos glóbulos vermelhos no volume total de sangue), neutropenia (redução do número de neutrófilos circulantes), contagem reduzida de células brancas do sangue, reação alérgica grave, reação alérgica, excesso de produção de prolactina (hormônio responsável pela produção do leite), anorexia, aumento do colesterol sanguíneo, aumento dos triglicérides sanguíneo, diminuição do apetite, hiperglicemia, diminuição do peso, anorgasmia (dificuldade de atingir o orgasmo), depressão, diminuição da libido, pesadelos, transtornos do sono, acidente vascular cerebral, convulsão, distúrbios de atenção, tontura postural, discinesia (movimentos involuntários anormais), hipoestesia (diminuição da sensibilidade), perda da consciência, parestesia (sensações cutâneas subjetivas), hiperatividade psicomotora, síncope (desmaio), discinesia tardia, conjuntivite, olhos secos, aumento do lacrimejamento, fotobia, dor de ouvido, zumbido, vertigem, bloqueio atrioventricular, diminuição da frequência cardíaca, transtorno de condução, eletrocardiograma anormal, eletrocardiograma com QT prolongado, palpitações, rubor, falta de suprimento sanguíneo para um tecido orgânico (isquemia), aumento da pressão sanguínea (hipertensão), diminuição da pressão sanguínea, tosse, dispneia (falta de ar), hiperventilação, congestão nasal, dor na faringe e laringe, chiado, queilite (inflamação nos lábios), disfagia (dificuldade de deglutição), incontinência fecal, flatulência, gastroenterite, obstrução intestinal, inchaço na língua, dor de dente, aumento da enzima gama-glutamiltransferase, aumento das enzimas do fígado, aumento das enzimas transaminases, acne, pele seca, eczema (infecção da pele), eritema, coceira, erupção cutânea, dermatite seborreica, descoloração da pele, dor nas articulações, dor nas costas, aumento da enzima creatinofosfoquinase sanguínea, rigidez nas articulações, inchaço nas articulações, contração involuntária nos músculos, fraqueza muscular, dor no pescoço, disúria (dificuldade para urinar), polaciúria (aumento da frequência urinária), incontinência urinária, saída de secreção das mamas, desconforto nas mamas, engurgitamento das mamas, transtorno da ejaculação, disfunção erétil, aumento das mamas em homens, transtornos menstruais, disfunção sexual, secreção vaginal, aumento da temperatura corpórea, desconforto no peito, calafrios, edema de face, marcha anormal, edema, pirexia (elevação da temperatura do corpo), sede, queda.
As reações adversas relatadas com paliperidona e/ou risperidona em outros estudos clínicos de esquizofrenia e transtorno esquizoafetivo, mas não relatadas por pacientes tratados com Invega®, são:
Infecção nos olhos, contagem aumentada de eosinófilos, glicose presente na urina, hiperinsulinemia, polidipsia (sede em demasia), embotamento afetivo, estado de confusão, transtorno de equilíbrio, transtorno vascular cerebral, coordenação anormal, nível reduzido de consciência, coma diabético, instabilidade da cabeça, síndrome neuroléptica maligna, ausência de resposta a estímulos, transtorno do movimento dos olhos, crise oculógira, glaucoma, hiperemia ocular (aumento do sangue circulante nos olhos), síndrome de taquicardia postural ortostática, disfonia (alteração da voz), pneumonia por aspiração, congestão pulmonar, estertores (pequenos ruídos durante a inspiração), congestão do trato respiratório, fecaloma (endurecimento das fezes), erupção medicamentosa, hiperqueratose (endurecimento da pele devido ao excesso de queratina), urticária, postura anormal, rabdomiólise (destruição muscular), aumento das mamas, atraso na menstruação, diminuição da temperatura corpórea, síndrome de retirada do medicamento, endurecimento, mal-estar.
Além das reações adversas relatadas durante os estudos clínicos e listadas anteriormente, foram relatadas as seguintes reações adversas durante a experiência de pós-comercialização com a paliperidona e/ou a risperidona:
Reação rara (ocorre entre 0,01% e 0,1% dos pacientes que utilizam este medicamento):
Angioedema.
Reação muito rara (ocorre em menos de 0,01% dos pacientes que utilizam este medicamento):
Agranulocitose (ausência ou redução de granulócitos), trombocitopenia (redução do número de plaquetas), diabetes mellitus, cetoacidose diabética, hipoglicemia, catatonia, mania, sonambulismo, disgeusia (alteração do paladar), fibrilação atrial, trombose venosa profunda, embolia pulmonar, síndrome da apneia do sono, pancreatite, falta de movimentos da musculatura intestinal, ocasionando obstrução, alopecia (redução ou perda de pelos e cabelos), retenção urinária, síndrome neonatal de retirada do medicamento, priapismo (ereção prolongada e dolorosa), hipotermia.
Reação de frequência desconhecida:
Secreção inapropriada de hormônio antidiurético, intoxicação por água, icterícia, transtorno alimentar relacionado ao sono, Síndrome de Íris Flácida Intraoperatória (IFIS) (uma condição que pode ocorrer durante a cirurgia de catarata em pacientes que utilizam ou já utilizaram Invega®). Caso necessite passar por cirurgia de catarata, informe seu oftalmologista caso utilize ou já tenha utilizado Invega®. Síndrome de Stevens-Johnson ou necrólise epidérmica tóxica (erupção cutânea grave ou que pode levar a risco de morte, com bolhas e descamação da pele, que pode começar na região da boca, nariz, olhos e órgãos genitais e se espalhar para outras áreas do corpo).
Informe ao seu médico, cirurgião-dentista ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento. Informe também à empresa através do seu serviço de atendimento.
Apresentações do Invega
Comprimidos revestidos de liberação prolongada de 3, 6 ou 9 mg em embalagens com 28 comprimidos.
Uso oral.
Uso adulto e pediátrico acima de 12 anos.
Qual a composição do Invega?
Cada comprimido revestido branco contém:
3 mg de paliperidona.
Excipientes: acetato de celulose, ácido esteárico, butil-hidroxitolueno, cera de carnaúba, cloreto de sódio, hietelose, macrogol, dióxido de titânio, hipromelose, lactose monoidratada, triacetina, óxido de ferro amarelo, óxido de ferro vermelho, povidona.
Cada comprimido revestido bege contém:
6 mg de paliperidona.
Excipientes: acetato de celulose, ácido esteárico, butil-hidroxitolueno, cera de carnaúba, cloreto de sódio, hietelose, macrogol, dióxido de titânio, hipromelose, óxido de ferro amarelo, óxido de ferro vermelho, povidona.
Cada comprimido revestido cor de rosa contém:
9 mg de paliperidona.
Excipientes: acetato de celulose, ácido esteárico, butil-hidroxitolueno, cera de carnaúba, cloreto de sódio, hietelose, macrogol, dióxido de titânio, hipromelose, óxido de ferro vermelho, óxido de ferro preto, povidona.
Superdose: o que acontece se tomar uma dose do Invega maior do que a recomendada?
Se você ingeriu acidentalmente uma quantidade maior de Invega®, procure o médico imediatamente.
Os possíveis sinais de uma dose excessiva são:
Sonolência, sedação, batimento rápido do coração, pressão arterial baixa, alterações no exame de eletrocardiograma e sintomas extrapiramidais (tais como movimentos involuntários). Torsade de pointes e fibrilação ventricular foram relatados na ocorrência de superdosagem com paliperidona oral.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Interação medicamentosa: quais os efeitos de tomar Invega com outros remédios?
Recomenda-se cautela ao prescrever Invega® com medicamentos conhecidos por prolongar o intervalo QT. O intervalo QT é uma medida da condutividade elétrica do coração. Medicamentos antipsicóticos podem causar anormalidades no intervalo QT. Evite tomar Invega® com outros medicamentos que também apresentem interação com o intervalo QT. Converse com seu médico para obter uma lista de medicamentos a serem evitados.
Potencial de Invega® afetar outros fármacos
Invega® deve ser usado com cautela junto a outros medicamentos que apresentam efeito no cérebro e com bebidas alcoólicas. A paliperidona pode prejudicar o efeito de medicamentos para tratamento da Doença de Parkinson como levodopa ou medicamentos com efeito chamado agonista dopaminérgico.
Quando usado com outros medicamentos que podem levar à queda de pressão arterial, o uso de Invega® pode potencialmente aumentar este efeito.
Potencial para outros fármacos afetarem Invega®
A dose de Invega® deve ser reavaliada e aumentada se necessário, após a introdução de carbamazepina.
De modo inverso, após a descontinuação da carbamazepina, a dose de Invega® deve ser reavaliada e diminuída caso necessário.
Uso concomitante de Invega® com risperidona
O uso concomitante de Invega® com risperidona não foi estudado. Como a paliperidona é o metabólito ativo da risperidona, uma exposição adicional a paliperidona deve ser considerada se a risperidona for coadministrada com Invega®. Não é recomendada a utilização concomitante de Invega® com risperidona oral, uma vez que a paliperidona é um metabólito ativo da risperidona e a combinação dos dois pode conduzir a uma exposição adicional de paliperidona.
Uso concomitante de Invega® com psicoestimulantes
O uso combinado de psicoestimulantes (por exemplo, metilfenidato) com paliperidona pode levar ao surgimento de sintomas extrapiramidais após a mudança de um ou ambos os tratamentos.
Uso de Invega® com alimentos
Invega® deve ser tomado toda manhã com ou sem café da manhã, porém da mesma maneira todos os dias.
Uso de Invega® com álcool
Invega® deve ser usado com cautela junto a bebidas alcoólicas.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
Interação Alimentícia: posso usar o Invega com alimentos?
Paliperidona deve ser tomado toda manhã com ou sem café da manhã, porém da mesma maneira todos os dias.
Embora a presença ou ausência de alimentos no tempo de administração de Paliperidona possam aumentar ou diminuir a exposição à paliperidona, estas alterações não foram consideradas clinicamente relevantes. Os estudos clínicos que estabeleceram a eficácia e a segurança de Paliperidona foram realizados sem relação com o tempo das refeições.
Qual a ação da substância do Invega?
Resultados de eficácia
Esquizofrenia Adultos
A eficácia de Paliperidona foi estabelecida em 3 estudos clínicos controlados com placebo e com ativo (olanzapina), duplo-cegos, de 6 semanas de duração em pacientes que preenchiam os critérios estipulados pelo “Manual de Transtornos Mentais publicados pela “American Psychiatric Association (DSM-IV-TR)” para esquizofrenia.
O controle ativo foi incluído para fins de sensibilidade do teste. As doses de Paliperidona, que variaram entre os 3 estudos, foram de 3 a 15 mg uma vez ao dia.
A eficácia foi avaliada usando a Escala de Síndrome Positiva e Negativa (PANSS); o desfecho primário foi a redução nos escores totais da PANSS. Uma análise dos subgrupos populacionais não revelou qualquer evidência de resposta diferenciada em relação à idade, raça ou gênero.
Desfechos secundários também foram avaliados, incluindo a escala de Desempenho Pessoal e Social (Personal and Social Performance PSP) e escala de Impressão Clínica Global Gravidade (Clinical Global Impression – Severity: CGI-S). A escala PSP corresponde a um instrumento de avaliação clínica validado que mede quatro áreas de funcionamento pessoal e social (atividades sociais úteis incluindo trabalho, estudo, relacionamentos pessoais e sociais, cuidados pessoais, comportamento perturbado e agressivo).
A escala CGI-S corresponde a uma avaliação global de impressão clínica do investigador em relação à gravidade da doença. Em uma análise com dados agrupados (“pooled data”) destes três estudos, cada dose de Paliperidona apresentou-se de forma superior, ao ser comparado com o placebo em relação ao PSP e CGI-S. Em adição, o efeito em PSP mostrou-se distinto da melhora nos sintomas medidos como desfecho primário (PANSS total).
Em análise posterior da fase aberta de extensão destes três estudos, foi revelado que a dose flexível de Paliperidona (3 a 15 mg, dose diária), por mais de 52 semanas, estava associada com uma contínua melhora na escala PSP.
Em estudo de longo prazo, delineado para avaliar a manutenção de efeito, Paliperidona apresentou-se de maneira significativamente mais eficaz que o placebo para a manutenção do controle dos sintomas e retardando a recorrência da esquizofrenia.
Neste estudo, adultos que preencheram os critérios estabelecidos pela DSM-IV para esquizofrenia e que permaneceram clinicamente estáveis por meio de doses determinadas de Paliperidona, durante um período de 8 semanas de tratamento aberto (doses entre 3 e 15 mg uma vez ao dia), depois de receberem um tratamento para um episódio agudo para as 06 semanas prévias com Paliperidona (doses entre 3 a15 mg uma vez ao dia), foram então aleatoriamente alocados de forma duplo-cega para continuar com Paliperidona, em dose estável, ou placebo, até que fossem observados sintomas de recorrência da esquizofrenia.
O estudo foi interrompido precocemente por motivos de eficácia, quando se atingiram critérios pré-definidos.
Com base em uma análise interna foi demonstrado um tempo significativamente maior para a recorrência em pacientes tratados com Paliperidona, comparados ao placebo (p=0,0053). Baseado em uma análise final e considerando os pacientes incluídos após o ponto de corte utilizado para análise interina, a taxa de eventos recorrentes foi de 22,1% no grupo de Paliperidona, comparada à taxa de 51,5% apresentada pelo grupo placebo.
Uma significativa melhora nos sintomas foi alcançada ao final da fase aberta em estabilização (decréscimo em valores totais em PANSS de 38 pontos, com desvio padrão de ± 16,03); entretanto, após a alocação aleatória para tratamento duplo-cego, os pacientes recebendo placebo deterioraram significativamente mais que pacientes recebendo Paliperidona (p<0,001). Paliperidona também foi significativamente mais efetivo que o placebo na manutenção de desempenho pessoal e social. Durante a fase duplo-cega deste estudo, de acordo com a medida da escala CGI-S, houve uma piora da gravidade total da psicose no grupo placebo, enquanto pacientes tratados com Paliperidona permaneceram clinicamente estáveis.
A redução do risco absoluto (RRA) e número necessário para tratar (NNT), necessários para promover melhora ≥30% no escore total da escala PANSS em 03 estudos clínicos fase III comparativos com placebo (SCH-303 / SCH-304 / SCH-305) são apresentados na tabela abaixo:
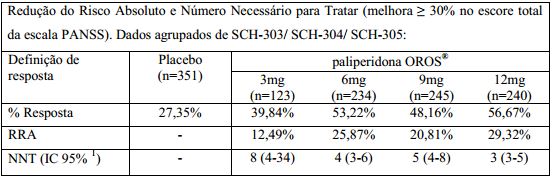 % Resposta: porcentagem de pacientes com melhora de ≥30% no escore total da escala PANSS, da linha de base ao ponto final.
% Resposta: porcentagem de pacientes com melhora de ≥30% no escore total da escala PANSS, da linha de base ao ponto final.
RRA: Redução do Risco Absoluto diferença entre a proporção de pacientes respondendo à paliperidona de liberação prolongada e placebo.
NNT: Número Necessário para Tratar: 1/RRA número de pacientes que necessitariam ser tratados para obter um desfecho positivo adicional que não ocorreria caso o paciente tivesse recebido placebo.
IC: Intervalo de Confiança.
Em resumo, a eficácia e a segurança de Paliperidona foram demonstradas em 03 estudos de fase III, com 06 semanas de duração.
A eficácia de PaliperidonaM na manutenção da estabilidade clínica foi comprovada por um período de até 11 meses. Isto foi demonstrado em um estudo para avaliar a recorrência de sintomas em pacientes com esquizofrenia clinicamente estáveis por um período de 08 semanas.
Esquizofrenia Adolescentes
A eficácia de Paliperidona em pacientes adolescentes com esquizofrenia foi estabelecida em um ensaio clínico randomizado, duplo-cego, em grupos paralelos, controlado por placebo, com duração de 6 semanas e desenho de grupo de tratamento com dose fixa baseado no peso corporal, na faixa de dose de 1,5 a 12 mg/dia.
Os pacientes tinham de 12 a 17 anos de idade e preenchiam os critérios estipulados pelo “Manual de Transtornos Mentais publicados pela “American Psychiatric Association (DSM-IV-TR)” para esquizofrenia, com confirmação do diagnóstico utilizando o questionário “Kiddie Schedule for Affective Disorders and Schizophrenia Present and Lifetime Version (K-SADS-PL)”.
Pacientes elegíveis foram aleatoriamente alocados para 1 dos 4 grupos de tratamento
Um grupo placebo ou grupos de dose baixa, média ou alta de Paliperidona. As doses foram administradas baseando-se no peso corporal para minimizar o risco de exposição de adolescentes com menor peso a doses mais elevadas de Paliperidona.
Pacientes com peso entre 29 kg e 51 kg na linha de base da visita foram aleatoriamente alocados para receber placebo ou 1,5 mg (dose baixa), 3 mg (dose média), ou 6 mg (dose alta) de Paliperidona diariamente, e os pacientes pesando pelo menos 51 kg na linha de base da visita foram aleatoriamente alocados para receber placebo ou 1,5 mg (dose baixa), 6 mg (dose média), ou 12 mg (dose alta) de Paliperidona diariamente.
A dose foi administrada pela manhã, independentemente das refeições.
A eficácia foi avaliada usando PANSS. Este estudo demonstrou a eficácia de Paliperidona em pacientes adolescentes com esquizofrenia, quando administrado em doses diárias de 3, 6 e 12 mg em grupos de tratamento baseados no peso corporal.
A dose mínima efetiva para Paliperidona nesta população foi de 3 mg/dia.
Transtorno esquizoafetivo
A eficácia de Paliperidona (3 mg a 12 mg uma vez ao dia) no tratamento de transtorno esquizoafetivo foi estabelecida em 2 estudos controlados por placebo com duração de 6 semanas em pacientes não-idosos que preencheram os critérios DSM-IV para o transtorno esquizoafetivo, confirmado pela Entrevista Clínica Estruturada paraTranstornos do DSM-IV.
Em um destes estudos, a eficácia foi avaliada em 203 pacientes que foram atribuídos a um dos dois níveis de dose de Paliperidona
6 mg com a opção de reduzir para 3 mg (n = 105) ou 12 mg com a opção de reduzir para 9 mg (n = 98) uma vez ao dia. No outro estudo, a eficácia foi avaliada em 211 pacientes que receberam doses flexíveis de Paliperidona (3 – 12 uma vez ao dia).
Ambos os estudos incluíram pacientes que receberam Paliperidona em monoterapia ou em combinação com antidepressivos e/ou estabilizadores de humor.
A dose foi administrada pela manhã, independentemente das refeições. Os estudos foram realizados nos Estados Unidos, Europa Oriental, Rússia e Ásia.
A eficácia foi avaliada utilizando a Escala da Síndrome Positiva e Negativa (PANSS), um inventário validado de múltiplos itens composto por 5 fatores para avaliar os sintomas positivos, sintomas negativos, pensamentos desorganizados, hostilidade descontrolada / excitação e ansiedade / depressão.
O grupo de doses elevadas de Paliperidona em estudo de 2 níveis de dose (12 mg/dia com opção de reduzir para 9 mg/dia) e o grupo Paliperidona em estudo de dose flexível (doses entre 3 e 12 mg/dia, dose média modal de 8,6 mg/dia) cada um era superior ao placebo no PANSS.
No grupo de dose mais baixa do estudo de 2 níveis de dose (6 mg/dia com opção de reduzir para 3 mg/dia), Paliperidona não era significativamente diferente do placebo como avaliado pela PANSS.
Avaliando os resultados de ambos os estudos em conjunto, Paliperidona melhorou os sintomas do transtorno esquizoafetivo na avaliação final em relação ao placebo quando administrado em monoterapia ou em combinação com antidepressivos e/ou estabilizadores de humor.
Uma análise dos subgrupos da população não revelou nenhuma evidência de sensibilidade diferencial com base no sexo, idade ou região geográfica. Não havia dados suficientes para explorar os efeitos diferenciais baseados na raça.
Características farmacológicas
Propriedades Farmacodinâmicas
Mecanismo de ação
A paliperidona é um antagonista de ação central de receptores D2 da dopamina, com atividade antagonista serotonérgica 5-HT2A predominante. A paliperidona também é ativa como um antagonista em receptores adrenérgicos alfa-1 e alfa-2 e histaminérgicos H1.
A paliperidona não tem afinidade para receptores colinérgicos muscarínicos ou adrenérgicos beta-1 e beta-2. A atividade farmacológica dos enantiômeros (+) e (-) da paliperidona é similar, tanto qualitativamente como quantitativamente.
O mecanismo de ação da paliperidona, como outros fármacos eficazes em esquizofrenia, é desconhecido. No entanto, foi proposto que a atividade terapêutica do fármaco em esquizofrenia é mediada através da combinação de antagonismo em receptores tipo 2 (5HT2A) de serotonina e tipo 2 (D2) de dopamina.
O antagonismo em outros receptores além do D2 e 5HT2A pode explicar alguns dos outros efeitos da paliperidona.
O tempo médio estimado para o início da ação terapêutica do medicamento é de 4 a 8 dias.
Polisonografia
Medicamentos com ação central através de seu mecanismo de ação, perfil de liberação e/ou tempo da administração da dose podem afetar o sono. Para avaliar o impacto da dose matinal de Paliperidona sobre a arquitetura e a continuidade do sono, foi conduzido um estudo controlado com placebo em 36 pacientes com esquizofrenia onde 9 mg de Paliperidona ou placebo foram administrados uma vez ao dia por 14 dias.
As seguintes observações foram feitas (dados médios em comparação ao placebo) redução de 41,0 (EP 18,70) minutos na latência para sono persistente, diminuição de 35,2 (EP 14,99) minutos na latência para início do sono, redução de 7,0 (EP 3,88) eventos no número de vezes de despertar após o início do sono, aumento do tempo total de sono em 52,8 (SE 24,01) minutos, aumento do período de sono em 41,7 (SE 18,75) minutos e aumento do índice de eficiência do sono em 11,0% (SE 5,00).
Houve também uma redução estatisticamente significativa (em relação ao placebo) no estágio 1 do sono de 11,9 (SE 4,44) minutos e aumento no estágio 2 do sono de 50,7 (SE 17,67) minutos. Não foi observado efeito clinicamente relevante sobre o sono REM.
Efeito no intervalo QT/QTc e na eletrofisiologia cardíaca
Os efeitos da paliperidona sobre o intervalo QT foram avaliados em dois estudos de fase I, randomizados, duplocegos e multicêntricos, em adultos com esquizofrenia e transtorno esquizoafetivo e em 3 estudos de eficácia, de dose fixa, controlados com placebo e com controle ativo de 6 semanas de duração em adultos com esquizofrenia.
No primeiro estudo de fase I (n=141), pacientes foram randomizados para receber igualmente 7 dias de paliperidona oral de liberação imediata uma vez ao dia (com titulação de 4 a 8 mg) ou uma dose única de moxifloxacino (400mg).
A dose de 8 mg uma vez ao dia de paliperidona oral de liberação imediata (n=44) atingiu uma concentração plasmática média no estado de equilíbrio mais de 2 vezes maior que a exposição observada com dose máxima recomendada de 12 mg de Paliperidona (Cmáx ss= 113 e 45 ng/mL, respectivamente).
No modelo de correção “linear-derived QT correction” (QTcLD), houve um aumento médio de 5,5 mseg (90% IC: 3,66; 7,25) no grupo de tratamento com Paliperidona (n=44).
No segundo estudo de fase I (n=109), os pacientes foram randomizados para receber igualmente placebo, ou a dose máxima recomendada de Paliperidona (12 mg uma vez ao dia), subsequentemente titulado a uma dose acima da faixa recomendada (18 mg uma vez ao dia), ou um controle ativo da mesma classe farmacológica de medicamento (400 mg de quetiapina 2 vezes ao dia).
A comparação primária neste estudo de não inferioridade de 10 dias foi entre Paliperidona 12 mg e quetiapina. A média dos mínimos quadrados da condição basal QTcLD a cada um dos tmáx individuais observados foi estimada para ser 5,1 ms menor para Paliperidona 12 mg (Cmáx média 34 ng/mL) comparado com 400 mg de quetiapina 2 vezes ao dia (Cmáx média 1183 ng/mL) (IC 90%: -9,2; -0,9), encontrando o critério de não inferioridade pré-especificado de 10 ms.
A alteração média da condição basal em QTcLD para cada um dos tmáx individuais observados foi estimada para ser 2,3 ms menor para Paliperidona 18 mg (Cmáx média 53 ng/mL) comparado com 400 mg de quetiapina 2 vezes ao dia (Cmáx média 1183 ng/mL) (IC 90%: -6,8; 2,3).
A alteração média da condição basal em QTcLD para cada tmáx individual observado foi estimada para 1,5 ms maior (IC 90%: -3,3; 6,2) para Paliperidona 12 mg e 8,0 ms maior (IC 90%: 3,1; 12,9) para 400 mg de quetiapina 2 vezes ao dia comparado com alteração média da condição basal em QTcLD em um tmáx mediano observado (da droga ativa na comparação) no braço placebo concorrente.
A alteração média da condição basal em QTcLD para cada tmáx individual observado foi estimada para ser 4,9 ms maior (IC 90%: -0,05; 10,3) para paliperidona de liberação prolongada 18 mg e 7,5 ms maior (IC 90%: 2,5; 12,5) para quetiapina 400 mg duas vezes ao dia comparado com a alteração média da condição basal em QTcLD no tmáx mediano observado (da droga ativa na comparação) no braço placebo concorrente.
Nenhum dos pacientes tiveram mudanças da condição basal excedendo 60 mseg ou um QTcLD excedendo 500 mseg durante o tempo de duração de qualquer destes estudos.
Para os 3 estudos de eficácia de dose fixa, medidas eletrocardiográficas extensas foram coletadas em 15 tempos de avaliação em dias determinados (incluindo os tempos de Cmáx esperada), usando metodologia padronizada.
O aumento médio do QTcLD não excedeu 5 mseg em nenhum grupo de tratamento em nenhum tempo de avaliação, com base nos dados agrupados de 836 pacientes tratados com Paliperidona, 357 pacientes tratados com olanzapina e 350 pacientes tratados com placebo.
Um paciente no grupo Paliperidona 12 mg e um paciente no grupo olanzapina tiveram uma mudança que excedeu 60 mseg em um tempo de análise durante esses estudos (aumentos de 62 mseg e 110 mseg, respectivamente).
Propriedades Farmacocinéticas
As informações farmacocinéticas apresentadas a seguir são baseadas em dados de estudos em adultos, com exceção dos casos especificados.
A farmacocinética da paliperidona após a administração de Paliperidona, cuja forma farmacêutica corresponde à de comprimido revestido de liberação prolongada (OROS Push-Pull, tecnologia desenvolvida pela Alza Corporation) é proporcional à dose dentro do intervalo recomendado (3 a 12 mg).
Absorção
Após uma dose única de Paliperidona, as concentrações plasmáticas de paliperidona sobem constantemente até atingir o pico de concentração plasmática (Cmáx) em aproximadamente 24 horas após a administração. Com a administração de Paliperidona uma vez ao dia, as concentrações do estado de equilíbrio da paliperidona são atingidas em 4-5 dias na maioria dos indivíduos.
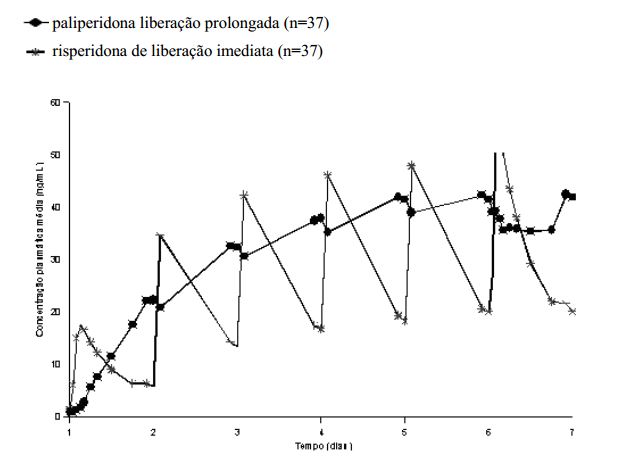
As características de liberação de Paliperidona resultam em flutuações mínimas do pico e de vale em comparação àquelas observadas com a risperidona de liberação imediata.
Em um estudo comparando a farmacocinética no estado de equilíbrio após a administração de 12 mg de paliperidona (comprimidos de liberação prolongada), uma vez ao dia, com 4 mg de risperidona de liberação imediata em pacientes com esquizofrenia, os índices de flutuação foram 38% para a paliperidona de liberação prolongada em comparação a 125% para a risperidona de liberação imediata.
Figura 1: Perfil de concentração no estado de equilíbrio após a administração de 12 mg de paliperidona (6 comprimidos de liberação prolongada de 2 mg, uma vez ao dia) por 6 dias (as concentrações de paliperidona estão representadas) em comparação a risperidona de liberação imediata administrada como 2 mg uma vez ao dia no Dia 1 e 4 mg uma vez ao dia nos Dias 2 a 6 (as concentrações de paliperidona+risperidona estão representadas):
Após a administração de Paliperidona os enantiômeros (+) e (-) da paliperidona se interconvertem, alcançando uma razão de AUC (+) para (-) de aproximadamente 1,6 no estado de equilíbrio. A biodisponibilidade oral absoluta da paliperidona após a administração de Paliperidona é 28%.
Após a administração de um único comprimido de liberação prolongada de paliperidona a voluntários sadios, confinados ao leito por 36 horas, com refeição padrão com alto teor calórico/de gordura, a Cmáx e a AUC aumentaram em 42% e 46%, respectivamente, em comparação com a administração em condição de jejum.
Em outro estudo envolvendo voluntários sadios, após administração de um único comprimido de 12 mg em conjunto com uma refeição padronizada contendo elevado conteúdo de gordura e calorias, foram observados aumentos de 60% e 54% de Cmáx e AUC de paliperidona, respectivamente, comparados à administração em condições de jejum. Embora a presença ou ausência de alimentos no tempo de administração de Paliperidona possam aumentar ou diminuir a exposição à paliperidona, estas alterações não foram consideradas clinicamente relevantes.
Os estudos clínicos que estabeleceram a eficácia e a segurança de Paliperidona foram realizados sem relação com o tempo das refeições.
Distribuição
A paliperidona é rapidamente distribuída. O volume aparente de distribuição é 478 L. A ligação da paliperidona às proteínas plasmáticas é de 74%. Ela liga-se, principalmente, à glicoproteína alfa-1 ácida e à albumina.
Em condições in vitro, concentrações terapêuticas altas de diazepam (3 mcg/mL), sulfametazina (100 mcg/mL), varfarina (10 mcg/mL) e carbamazepina (10 mcg/mL) causaram um pequeno aumento na fração livre de paliperidona em 50 ng/mL. Não é esperado que essas mudanças tenham significância clínica.
Metabolismo e eliminação
Uma semana após a administração de uma dose oral única de 1 mg de 14C-paliperidona de liberação imediata, 59% da dose foi excretada inalterada na urina, indicando que a paliperidona não é extensivamente metabolizada no fígado. Aproximadamente 80% da radioatividade administrada foi recuperada na urina e 11% nas fezes.
Quatro vias metabólicas foram identificadas in vivo, nenhuma das quais representou mais de 6,5% da dose: desalquilação, hidroxilação, desidrogenação e cisão de benzisoxazol. Embora estudos in vivo tenham sugerido um papel para a CYP2D6 e a CYP3A4 no metabolismo da paliperidona, não há evidência in vivo de que essas isoenzimas representem um papel significativo no metabolismo da paliperidona.
Apesar da ampla variação na população em geral com relação à capacidade de metabolizar substratos de CYP2D6, as análises da farmacocinética da população não indicaram diferença perceptível na depuração aparente de paliperidona após a administração de Paliperidona entre metabolizadores rápidos e lentos de substratos de CYP2D6.
Estudos in vitro usando preparados de microssomas de sistemas heterólogos indicam que as CYP1A2, CYP2A6, CYP2C9, CYP2C19 e CYP3A5 não estão envolvidas no metabolismo da paliperidona. A meia-vida terminal de eliminação da paliperidona é cerca de 23 horas.
Insuficiência hepática
A paliperidona não é extensivamente metabolizada pelo fígado. Em um estudo em pacientes com insuficiência hepática moderada (Child-Pugh classe B), as concentrações plasmáticas da paliperidona livre foram similares àquelas em indivíduos sadios. A paliperidona não foi estudada em pacientes com insuficiência hepática grave.
Insuficiência renal
A dose deve ser reduzida em pacientes com insuficiência renal moderada e grave. A disposição da paliperidona foi estudada em pacientes com graus variáveis de insuficiência renal. A eliminação da paliperidona diminuiu com a diminuição da depuração da creatinina (DC).
A depuração total da paliperidona foi reduzida em pacientes com insuficiência renal
em 32% nos casos leves (DC = 50 a < 80 mL/min), 64% nos casos moderados (DC = 30 a < 50 mL/min) e 71% nos casos graves (DC = 10 a < 30 mL/min). A meia-vida de eliminação terminal da paliperidona foi 24, 40 e 51 horas em pacientes com insuficiência renal leve, moderada e grave, respectivamente, em comparação a 23 horas em indivíduos com a função renal normal (DC ≥ 80 mL/min).
Adolescentes
A exposição sistêmica à paliperidona em pacientes adolescentes foi comparável à exposição em adultos.
Em adolescentes com peso < 51 kg foi observada uma exposição 23% maior do que em adolescentes com peso ≥ 51 kg; este aumento não foi considerado clinicamente significativo. A idade, por si só, não influenciou na exposição à paliperidona.
Idosos
Os dados de um estudo de farmacocinética em indivíduos idosos (≥65 anos de idade, n=26) indicaram que a depuração aparente da paliperidona, no estado de equilíbrio após a administração de Paliperidona, foi 20% menor em comparação a indivíduos adultos (18-45 anos de idade, n=28).
No entanto, não houve efeito perceptível da idade na análise da farmacocinética da população envolvendo pacientes com esquizofrenia após a correção das reduções na depuração da creatinina relacionadas à idade.
Raça
Não é recomendado ajuste de dose com base na raça. A análise farmacocinética populacional não revelou evidências de diferenças relacionadas à raça na farmacocinética da paliperidona seguindo a administração de Paliperidona.
Em um estudo farmacocinético conduzido em japoneses e caucasianos não foram observadas diferenças na farmacocinética.
Sexo
A depuração aparente da paliperidona após a administração de Paliperidona é aproximadamente 19% menor em mulheres que em homens.
Essa diferença é amplamente explicada pelas diferenças na massa muscular corporal e na depuração da creatinina entre homens e mulheres, pois uma avaliação da farmacocinética da população não revelou evidência de diferenças clinicamente significativas relacionadas ao sexo na farmacocinética da paliperidona após a administração de Paliperidona, após correção para a massa muscular e a depuração de creatinina.
Tabagismo
Com base nos estudos in vitro utilizando enzimas hepáticas humanas, a paliperidona não é um substrato para a CYP1A2, portanto, o tabagismo, não deve afetar a farmacocinética da paliperidona.
Uma análise farmacocinética da população demonstrou haver uma exposição à paliperidona ligeiramente menor em fumantes do que em não-fumantes. No entanto, é improvável que esta diferença possua relevância clínica.
Dados de segurança pré-clinica
Toxicologia
Da mesma forma que outros fármacos antagonistas de receptores dopamina D2, a paliperidona elevou os níveis de prolactina sérica em estudos de toxicidade de dose repetida.
Em um estudo de toxicidade juvenil com 7 semanas de duração e doses orais de paliperdona de 0,16; 0,63 e 2,5 mg/dia, que correspondem, respectivamente, a 0,12; 0,5 e 1,8 vezes a dose máxima humana (12 mg/dia) recomendada para adolescentes em mg/m2, não foram observados efeitos no crescimento, maturidade sexual e desempenho reprodutivo.
Doses de até 2,5 mg/kg/dia não prejudicaram o desenvolvimento neurocomportamental em machos e fêmeas, exceto pelo efeito sobre a aprendizagem e memória em ratas fêmeas tratadas com 2,5 mg/kg/dia. Este efeito não foi observado após a descontinuação do tratamento.
Em um estudo com duração de 40 semanas em cães jovens tratados com ripseridona oral (que é extensivamente convertida a paliperidona) em doses de 0,31, 1,25, e 5 mg/kg/dia, a maturidade sexual não foi adversamente afetada com 0,31 e 1,25 mg/kg/dia. O crescimento de ossos longos não foi afetado com 0,31 mg/kg/dia; efeitos foram observados com 1,25 e 5 mg/kg/dia.
Carcinogenicidade
O potencial carcinogênico da paliperidona foi avaliado com base em estudos com a risperidona conduzidos em camundongos e ratos, uma vez que a paliperidona corresponde a um metabólito ativo da risperidona. A risperidona foi administrada em doses de até 10 mg/kg/dia por 18 meses em camundongos e 25 meses em ratos.
Houve aumentos estatisticamente significativos de adenomas de hipófise, adenomas de pâncreas endócrino e adenocarcinomas de glândulas mamárias. Um aumento de tumores mamários, hipofisários e de pâncreas endócrino foi encontrado em roedores após a administração crônica de outros antipsicóticos e é considerado como sendo mediado pelo antagonismo prolongado de dopamina D2. A relevância desses achados de tumores em roedores é desconhecida, em termos de risco para os seres humanos.
Mutagenicidade
Não foi encontrada evidência de potencial mutagênico para a paliperidona no teste de mutação reversa de Ames, no teste de linfoma de camundongo ou no teste de micronúcleo de rato.
Prejuízo da fertilidade
Embora o tratamento com a paliperidona tenha resultado em efeitos mediados pela prolactina e pelo sistema nervoso central, a fertilidade de ratos machos e fêmeas não foi afetada. Em uma dose materna tóxica, as fêmeas de ratos apresentaram um número ligeiramente menor de embriões vivos.
Como devo armazenar o Invega?
Você deve conservar Invega® comprimidos em temperatura ambiente (entre 15°C e 30°C), protegido da umidade.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Aspecto Físico
Existem 3 concentrações de Invega® que podem ser identificadas pela cor do comprimido:
3 mg - comprimido branco, 6 mg – comprimido bege e 9 mg – comprimido cor de rosa.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Dizeres Legais do Invega
MS- 1.1236.3388
Farm. Resp.: Erika Diago Rufino
CRF/SP n° 57.310
Registrado por:
Janssen-Cilag Farmacêutica Ltda.
Avenida Presidente Juscelino Kubitschek, 2041, São Paulo – SP
CNPJ 51.780.468/0001-87
Fabricado por:
Janssen Cilag Manufacturing LLC
Gurabo, Porto Rico
Embalado por:
Janssen-Cilag SpA.
Latina - Itália
Importado por:
Janssen-Cilag Farmacêutica Ltda.
Rod. Presidente Dutra, km 154
São José dos Campos - SP
CNPJ 51.780.468/0002-68
® Marca Registrada.
Venda sob prescrição médica.
Só pode ser vendido com retenção da receita.
Especificações sobre o Invega
Caracteristicas Principais
| Fabricante: | Janssen-Cilag |
| Necessita de Receita: | C1 Branca 2 vias (Venda Sob Prescrição Médica - Este medicamento pode causar Dependência Física ou Psíquica) |
| Princípio Ativo: | Paliperidona |
| Categoria do Medicamento: | Antipsicótico |
| Especialidades: | Psicanálise, Psiquiatria, Psicologia |
| Doenças Relacionadas: | Esquizofrenia |
| Bula do Paciente: | Bula do Invega |
| Bula do Profissional: | Bula do Profissional do Invega |
| Tipo do Medicamento: | Novo |
| Registro no Ministério da Saúde: | 1123633880060 |
| Código de Barras: | 7896212425617 |
| Temperatura de Armazenamento: | Temperatura ambiente |
| Produto Refrigerado: | Este produto não precisa ser refrigerado |
| Modo de Uso: | Uso oral |
| Pode partir: | Esta apresentação pode ser partida |
Ofertas deste produto
.webp)
 Invega 3mg, caixa com 28 comprimidos revestidos de liberação prolongada
Invega 3mg, caixa com 28 comprimidos revestidos de liberação prolongada


