Bula do Paliperidona
Princípio Ativo:Paliperidona
Paliperidona, para o que é indicado e para o que serve?
Adultos
Paliperidona é indicado para o tratamento da esquizofrenia, incluindo tratamento agudo e prevenção de recorrência, e para o tratamento de transtorno esquizoafetivo em monoterapia e em combinação com antidepressivos e/ou estabilizadores do humor.
Adolescentes
Paliperidona é indicado para o tratamento da esquizofrenia em adolescentes de 12 a 17 anos de idade.
Quais as contraindicações do Paliperidona?
Paliperidona é contraindicado em pacientes com hipersensibilidade conhecida a paliperidona ou a qualquer componente da formulação.
Paliperidona é contraindicado em pacientes com conhecida hipersensibilidade à risperidona, uma vez que a paliperidona corresponde a um metabólito ativo da risperidona.
Como usar o Paliperidona?
Paliperidona deve ser administrado por via oral e pela manhã com ou sem alimentos.
Os comprimidos de Paliperidona devem ser deglutidos inteiros com um pouco de líquido e não devem ser mastigados, partidos ou esmagados.
Paliperidona deve ser tomado toda manhã com ou sem café da manhã, porém da mesma maneira todos os dias. Não alterne tomando Paliperidona sem café da manhã em um dia e com café da manhã no dia seguinte.
A medicação está contida em uma cápsula não absorvível, desenhada para liberar o fármaco de forma prolongada. O revestimento do comprimido, em conjunto com os componentes insolúveis, é eliminado do organismo; os pacientes não devem se preocupar se, ocasionalmente, notarem nas fezes algo parecido com um comprimido.
Posologia
Adultos (idade acima de 18 anos)
Esquizofrenia
A dose recomendada de Paliperidona para o tratamento de esquizofrenia em adultos é de 6 mg, uma vez ao dia, administrado pela manhã. Não é necessária a titulação inicial de dose. Alguns pacientes podem se beneficiar de doses mais baixas ou mais altas dentro da faixa de dose recomendada de 3 a 12 mg uma vez ao dia.
O ajuste de dose, se indicado, deve ocorrer somente após reavaliação clínica. Quando aumentos de dose forem indicados, recomenda-se incrementos de 3 mg/dia e geralmente estes devem ocorrer em intervalos maiores do que 5 dias.
Transtorno esquizoafetivo
A dose recomendada de Paliperidona para o tratamento do transtorno esquizoafetivo em adultos é de 6 mg uma vez ao dia, administrada pela manhã. Não é necessária a titulação da dose inicial. Alguns pacientes podem se beneficiar de doses mais baixas ou mais elevadas dentro de uma escala de dose recomendada que varia de 3 a 12 mg uma vez ao dia.
Foi observada uma tendência geral para maior eficácia com doses mais altas. O ajuste de dose, se indicado, deve ocorrer somente após a reavaliação clínica. Quando os aumentos de dose são indicados, são recomendados os aumentos de 3 mg/dia e geralmente deve ocorrer em intervalos de mais de 4 dias.
Adolescentes (idade entre 12 e 17 anos)
Esquizofrenia
A dose recomendada de Paliperidona para o tratamento de esquizofrenia em adolescentes de 12 a 17 anos de idade é de 3 mg, uma vez ao dia, administrado pela manhã. Não é necessária a titulação inicial de dose.
Alguns pacientes podem se beneficiar de uma dose mais alta de 6 a 12 mg/dia. Aumentos de dose devem ser realizados somente após reavaliação clínica e devem ocorrer em incrementos de 3 mg/dia em intervalos maiores do que 5 dias.
Pacientes com insuficiência hepática
Não é necessário ajustar a dose em pacientes com insuficiência hepática leve à moderada. Paliperidona não foi estudado em pacientes com insuficiência hepática grave.
Pacientes com insuficiência renal
Para pacientes com insuficiência renal leve (depuração da creatinina ≥ 50 a < 80 mL/min), a dose inicial recomendada é 3 mg uma vez ao dia. A dose pode ser aumentada para 6 mg uma vez ao dia baseados na tolerabilidade e resposta clínica.
Para pacientes com insuficiência renal moderada a grave (depuração da creatinina ≥ 10 a < 50 mL/min), a dose recomendada é 3 mg uma vez ao dia. Como Paliperidona não foi estudado em pacientes com depuração de creatinina < 10 mL/min, não se recomenda o uso nestes pacientes.
Pacientes idosos
As recomendações posológicas para pacientes idosos com função renal normal (≥ 80 mL/min) são as mesmas que as para adultos com função renal normal. No entanto, como os pacientes idosos podem ter função renal diminuída, pode ser necessário ajustar a dose de acordo com o estado da função renal.
Adolescentes e crianças
A segurança e a eficácia de Paliperidona para o tratamento da esquizofrenia em pacientes com idade inferior a 12 anos não foram estabelecidas.
Outras populações especiais
Não há recomendação para ajuste da dose de Paliperidona em função do sexo, raça ou tabagismo.
Paliperidona está na forma de comprimidos de liberação prolongada para que a liberação de seu princípio ativo, a paliperidona, ocorra por 24 horas de uma maneira controlada. A paliperidona in vivo é liberada a uma taxa razoavelmente constante: 1-2% da quantidade administrada por hora.
Este medicamento não deve ser partido, aberto ou mastigado.
Quais cuidados devo ter ao usar o Paliperidona?
Síndrome neuroléptica maligna
A ocorrência de síndrome neuroléptica maligna caracterizada por hipertermia, rigidez muscular, instabilidade autonômica, alteração da consciência e níveis elevados de creatina fosfoquinase têm sido relatada com fármacos antipsicóticos, incluindo a paliperidona.
Sinais clínicos adicionais podem incluir mioglobinúria (rabdomiólise) e insuficiência renal aguda. Se o paciente desenvolver sinais ou sintomas indicativos de síndrome neuroléptica maligna, todos os antipsicóticos, incluindo Paliperidona, devem ser descontinuados.
Discinesia tardia
Fármacos com propriedades antagonistas de receptor dopaminérgico têm sido associados à indução de discinesia tardia caracterizada por movimentos involuntários, rítmicos, predominantemente da língua e/ou da face.
Se surgirem sinais ou sintomas de discinesia tardia, a descontinuação de todos os fármacos antipsicóticos, incluindo Paliperidona, deve ser considerada.
Intervalo QT
Assim como outros antipsicóticos, deve-se ter cautela quando Paliperidona é prescrito a pacientes com histórico de arritmias cardíacas, em pacientes com síndrome congênita do prolongamento do intervalo QT e em uso concomitante com medicamentos que conhecidamente prolongam o intervalo QT.
Hiperglicemia e diabetes mellitus
Hiperglicemia, diabetes mellitus e exacerbação da diabetes pré-existente foram relatadas durante o tratamento com Paliperidona. A avaliação da relação entre o uso de antipsicóticos atípicos e anormalidades da glicose é complicada pela possibilidade de um aumento do risco de diabetes mellitus em pacientes com esquizofrenia e a crescente incidência de diabetes mellitus na população geral.
Não se entende completamente a relação entre o uso de antipsicóticos atípicos e eventos adversos relacionados à hiperglicemia, dados os causadores dessa confusão.
Qualquer paciente tratado com antipsicóticos atípicos, incluindo Paliperidona, deve ser monitorado para os sintomas de hiperglicemia e diabetes mellitus.
Ganho de peso
Foi observado ganho de peso com o uso de antipsicóticos atípicos. Recomenda-se monitoramento do peso.
Hipotensão ortostática
A paliperidona pode induzir hipotensão ortostática em alguns pacientes em função de sua atividade de bloqueador alfa.
Paliperidona deve ser usado com cautela em pacientes com história de doença cardiovascular (como por exemplo, insuficiência cardíaca, infarto ou isquemia do miocárdio, anormalidades da condução), doença vascular cerebral ou condições que predisponham o paciente à hipotensão (como por exemplo, desidratação, hipovolemia e tratamento com medicamentos anti-hipertensivos).
Crises epilépticas
Da mesma forma que outros antipsicóticos, Paliperidona deve ser usado com cautela em pacientes com história de crises epilépticas ou outras condições que reduzem potencialmente o limiar convulsivo.
Potencial para obstrução gastrintestinal
Uma vez que o comprimido de Paliperidona não se deforma e não altera sua forma no trato gastrintestinal, Paliperidona não deve ser administrado a pacientes com estreitamento gastrintestinal grave pré-existente (patológico ou iatrogênico) ou em pacientes com disfagia ou dificuldade significativa para deglutir comprimidos.
Tem havido relatos raros de sintomas de obstrução em pacientes com história de estreitamento associado à ingestão de fármacos em formulações não deformáveis de liberação controlada. Devido ao desenho da forma farmacêutica de liberação prolongada, Paliperidona só deve ser usado em pacientes capazes de deglutir o comprimido inteiro.
Pacientes idosos com demência
Paliperidona não foi estudado nessa população de pacientes, desta forma o medicamento não é recomendado para pacientes idosos com demência.
Mortalidade geral
Em uma meta-análise de 17 estudos clínicos controlados, pacientes idosos com demência tratados com outros fármacos antipsicóticos atípicos, incluindo a risperidona, aripiprazol, olanzapina e quetiapina, tiveram um risco aumentado de mortalidade em comparação ao placebo. Dentre os pacientes tratados com risperidona, a mortalidade foi de 4% comparada com 3,1% para o grupo placebo.
Eventos adversos vascular cerebral
Em estudos clínicos controlados com placebo em pacientes idosos com demência, tratados com fármacos antipsicóticos atípicos, incluindo a risperidona, aripiprazol e olanzapina, houve uma incidência maior de eventos adversos vascular cerebral (acidente vascular cerebral e episódios de isquemia transitória), incluindo casos fatais, em comparação ao placebo.
Leucopenia, neutropenia e agranulocitose
Eventos de leucopenia, neutropenia e agranulocitose foram relatados com agentes antipsicóticos, incluindo Paliperidona. Agranulocitose foi relatada muito raramente ( < 1/10.000 pacientes) durante a vigilância pós-comercialização.
Pacientes com histórico de baixa contagem de células brancas do sangue (CBS) clinicamente significativa ou leucopenia/neutropenia induzida por medicamento devem ser monitorados durante os primeiros meses de tratamento e deve-se considerar a descontinuação de Paliperidona ao primeiro sinal de queda clinicamente significativa nas CBS na ausência de outros fatores causadores.
Pacientes com neutropenia clinicamente significativa devem ser cuidadosamente monitorados para febre ou outros sintomas ou sinais de infecção e tratados imediatamente se tais sintomas ou sinais ocorrerem. Pacientes com neutropenia grave (contagem absoluta de neutrófilos < 1 x 109/L) devem descontinuar Paliperidona e ter suas contagens de células brancas (CBS) acompanhadas até sua recuperação.
Tromboembolismo venoso
Casos de tromboembolismo venoso (TEV) foram relatados com medicamentos antipsicóticos. Já que pacientes tratados com antipsicóticos frequentemente apresentam fatores de risco adquiridos para TEV, todos os possíveis fatores de risco para TEV devem ser identificados antes e durante o tratamento com Paliperidona e medidas preventivas devem ser tomadas.
Doença de Parkinson e demência com corpos de Lewy
O médico deve pesar os riscos em relação aos benefícios ao prescrever antipsicóticos, incluindo Paliperidona, para pacientes com doença de Parkinson ou demência com corpos de Lewy, uma vez que ambos os grupos podem estar sob risco aumentado de desenvolver síndrome neuroléptica maligna, assim como de ter uma sensibilidade aumentada a medicamentos antipsicóticos.
A manifestação dessa sensibilidade aumentada pode incluir confusão, embotamento, instabilidade postural com quedas frequentes, além dos sintomas extrapiramidais.
Priapismo
Tem sido relatado que fármacos com efeitos de bloqueio alfa-adrenérgico induzem o priapismo.
Priapismo foi relatado com paliperidona durante o período de pós-comercialização.
Controle da temperatura corporal
A interrupção da capacidade do organismo de reduzir a temperatura corporal foi atribuída a agentes antipsicóticos. Recomenda-se cuidado apropriado ao prescrever Paliperidona para pacientes que irão se expor a condições que possam contribuir para o aumento da temperatura corporal, como por exemplo exercício extenuante, exposição ao calor extremo, uso de medicação concomitante com atividade anticolinérgica, ou sujeito a desidratação.
Efeito antiemético
Um efeito antiemético foi observado em estudos pré-clínicos com a paliperidona. Esse efeito, se ocorrer em seres humanos, pode mascarar os sinais e sintomas de dose excessiva com certos fármacos ou de condições tais como obstrução intestinal, síndrome de Reye e tumor cerebral.
Síndrome de Íris Flácida Intraoperatória
Síndrome de Íris Flácida Intraoperatória (IFIS) tem sido observada durante cirurgia de catarata em pacientes tratados com medicamentos com efeitos antagonistas alfa 1a-adrenérgicos, como o Paliperidona.
A IFIS pode aumentar o risco de complicações oftálmicas durante e após a operação. O cirurgião oftalmologista deve ser informado, previamente à cirurgia, sobre o uso atual ou anterior de medicamentos com efeitos antagonistas alfa 1a-adrenérgicos. Os benefícios potenciais da interrupção do tratamento de bloqueio de receptores alfa 1 previamente à cirurgia de catarata, não foram estabelecidos e devem ser considerados contra o risco de interromper o tratamento antipisicótico.
Efeito sobre a capacidade de dirigir veículos e utilizar máquinas
Paliperidona pode interferir com as atividades que requerem alerta mental e pode ocasionar efeitos visuais.
Durante o tratamento, o paciente não deve dirigir veículos ou operar máquinas, pois sua habilidade e atenção podem estar prejudicadas.
Gravidez (Categoria C) e Lactação
A segurança da paliperidona para uso em mulheres grávidas não foi estabelecida.
Nenhum efeito teratogênico foi observado em estudo com animais. Animais de laboratório tratados com dose alta de paliperidona mostraram um pequeno aumento da mortalidade fetal.
Essa dose alta foi tóxica para as mães. A ninhada não foi afetada em exposições 20 a 34 vezes maiores que a exposição máxima em seres humanos. Paliperidona só deve ser usado durante a gestação se os benefícios superarem os riscos. O efeito de Paliperidona sobre o parto em seres humanos é desconhecido.
Recém-nascidos expostos a medicamentos antipsicóticos (incluindo paliperidona) durante o terceiro trimestre de gravidez correm o risco de apresentar sintomas extrapiramidais e/ou de retirada, que podem variar em gravidade após o parto.
Estes sintomas em recém-nascidos podem incluir agitação, hipertonia, hipotonia, tremor, sonolência, dificuldade respiratória ou transtornos alimentares.
Em estudos em animais com a paliperidona e em estudos em seres humanos com a risperidona, a paliperidona foi excretada no leite. Portanto, as mulheres não devem amamentar durante o tratamento com Paliperidona.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Pacientes idosos
As recomendações posológicas para pacientes idosos com função renal normal (≥ 80 mL/min) são as mesmas que para adultos com função renal normal. No entanto, como os pacientes idosos podem ter função renal diminuída, pode ser necessário ajustar a dose de acordo com o estado da função renal.
Pacientes idosos com demência
Paliperidona não foi estudado nessa população de pacientes.
Adolescentes e crianças
A segurança e a eficácia de Paliperidona para o tratamento da esquizofrenia em pacientes com idade inferior a 12 anos não foram estabelecidas.
Pacientes com insuficiência hepática
Não é necessário ajustar a dose em pacientes com insuficiência hepática leve à moderada. Paliperidona não foi estudado em pacientes com insuficiência hepática grave.
Pacientes com insuficiência renal
Para pacientes com insuficiência renal leve (depuração da creatinina ≥ 50 a < 80 mL/min), a dose inicial recomendada é 3 mg uma vez ao dia. Para pacientes com insuficiência renal moderada a grave (depuração da creatinina ≥ 10 a < 50 mL/min), a dose recomendada é 3 mg uma vez ao dia.
Como Paliperidona não foi estudado em pacientes com depuração de creatinina < 10 mL/min, não se recomenda o uso nestes pacientes.
Quais as reações adversas e os efeitos colaterais do Paliperidona?
Ao longo deste item são apresentadas as reações adversas. Reações adversas são eventos adversos considerados como sendo razoavelmente associados ao uso de paliperidona com base na avaliação abrangente da informação de eventos adversos disponíveis. Uma relação causal com a paliperidona não pode ser estabelecida de forma confiável em casos individuais.
Além disso, uma vez que os estudos clínicos são conduzidos em condições muito variadas, as taxas de reações adversas observadas nos estudos clínicos de um medicamento não podem ser diretamente comparadas às taxas nos estudos clínicos de outro medicamento e podem não refletir as taxas observadas na prática clínica.
Dados de estudos clínicos
A segurança de Paliperidona no tratamento de esquizofrenia foi avaliada em 1205 pacientes adultos com esquizofrenia que participaram de 3 estudos, duplo-cegos, controlados por placebo com duração de 6 semanas, dos quais 850 pacientes receberam Paliperidona em faixas de doses fixas de 3 mg à 12 mg uma vez ao dia.
A segurança de Paliperidona foi avaliada em 314 pacientes adolescentes com idade de 12 a 17 anos com esquizofrenia que receberam Paliperidona na faixa de dose de 1,5 mg a 12 mg/dia em 2 estudos de fase 3, incluindo 201 indivíduos em um estudo com duração de 6 semanas, duplo-cego, controlado por placebo e indivíduos tratados por até 2 anos em um estudo de segurança aberto, de braço-único.
A segurança de Paliperidona foi avaliada em 622 pacientes adultos com transtorno esquizoafetivo que participaram em 2 estudos duplo-cegos controlados por placebo com duração de 6 semanas.
Em um destes estudos, 206 pacientes foram incluídos em uma das duas doses de Paliperidona
6 mg com a opção de reduzir para 3 mg (n = 108) ou 12 mg com a opção de reduzir para 9 mg (n = 98) uma vez ao dia.
No outro estudo, 214 pacientes receberem doses flexíveis de Paliperidona (3 – 12 mg uma vez ao dia). Ambos os estudos incluíram pacientes que receberam Paliperidona em monoterapia ou em combinação com antidepressivos e/ou estabilizadores de humor.
As informações deste item provêm de dados agrupados.
A maioria das reações adversas medicamentosas foi de gravidade leve à moderada.
Esquizofrenia – dados de estudos duplo-cegos controlados por placebo Adultos
As reações adversas reportadas por ≥ 2% dos pacientes tratados com Paliperidona para esquizofrenia em 3 estudos clínicos em adultos, de 6 semanas de duração com dose fixa, duplo-cegos e controlados por placebo, estão demonstradas na tabela 1.
Tabela 1: Reações adversas medicamentosas relatadas por ≥ 2% de pacientes com esquizofrenia tratados com Paliperidona em 3 estudos clínicos em adultos, de dose fixa, duplo-cegos, controlados por placebo, de 6 semanas de duração:


Esquizofrenia – dados de estudos duplo-cegos controlados por placebo Adolescentes
As reações adversas reportadas por ≥ 2% dos pacientes adolescentes com idade entre 12 e 17 anos, tratados com Paliperidona para esquizofrenia em um estudo clínico de dose fixa, controlado por placebo, estão demonstradas na tabela 2.
Tabela 2: Reações adversas medicamentosas relatadas por ≥ 2% de pacientes com esquizofrenia tratados com Paliperidona em um estudo clínico em crianças de dose fixa, controlado por placebo:



Transtorno esquizoafetivo – dados de estudos duplo-cegos controlados por placebo Adultos
As reações adversas relatadas por ≥ 2% dos pacientes com transtorno esquizoafetivo tratados com Paliperidona em 2 estudos clínicos em adultos estão demonstradas na tabela 3.
Tabela 3: Reações adversas medicamentosas relatadas por ≥ 2% de pacientes com transtorno esquizoafetivo tratados com Paliperidona em 2 estudos clínicos em adultos, duplo-cegos, controlados por placebo:
| Sistema ou classe de órgão | ||
| Reação Adversa | Paliperidona | |
| 3 12 mg (1 x dia) (N=420)* % | Placebo (N=202) % | |
| Infecções e Infestações | ||
| Nasofaringite | 3 | 1 |
| Transtornos Metabólicos e Nutricionais | ||
| Aumento do apetite | 2 | < 1 |
| Transtornos do Sistema Nervoso | ||
| Tremor | 8 | 3 |
| Acatisia | 5 | 4 |
| Sedação | 5 | 3 |
| Sonolência | 5 | 2 |
| Hipertonia | 5 | 2 |
| Salivação | 2 | 0 |
| Disartria | 2 | 0 |
| Transtornos Gastrintestinais | ||
| Náusea | 6 | 6 |
| Dispepsia | 5 | 2 |
| Constipação | 4 | 2 |
| Transtornos do Tecido Conectivo e Musculoesquelético | ||
| Mialgia | 2 | <1 |
| Investigações | ||
| Aumento de peso | 4 | 1 |
*Entre os 420 pacientes tratados com Paliperidona, 230 (55%) receberam Paliperidona em monoterapia e 190 (45%) receberam Paliperidona em combinação com antidepressivos e/ou estabilizadores de humor.
Monoterapia versus terapia combinada
Os desenhos dos 2 estudos duplo-cegos em adultos, controlados por placebo com duração de 6 semanas em pacientes com transtorno esquizoafetivo incluíram a opção para pacientes receberem antidepressivos (exceto inibidores da monoaminoxidase) e/ou estabilizadores de humor (lítio, valproato ou lamotrigina).
Nos pacientes da população avaliada para segurança, 230 (55%) pacientes receberam Paliperidona em monoterapia e 190 (45%) pacientes receberam Paliperidona em combinação com antidepressivos e/ou estabilizadores de humor. Quando se compara estas 2 subpopulações somente ocorre náusea com uma frequência maior (diferença > 3%) em pacientes que receberam Paliperidona em monoterapia.
Reações adversas relacionadas à dose
No estudo controlado por placebo, com doses altas e baixas, com duração de 6 semanas, em pacientes adultos com transtorno esquizoafetivo, distonia, disartria e nasofaringite ocorreram mais frequentemente (por exemplo: uma diferença de pelo menos 3%) em pacientes que receberam doses mais elevadas de Paliperidona comparado com pacientes que receberam doses mais baixas.
Ocorreu hipertonia mais frequentemente em pacientes que receberam doses mais baixas de Paliperidona comparado com pacientes que receberam doses mais elevadas.
Dados de outros estudos clínicos
Paliperidona é o metabólito ativo de risperidona, portanto os perfis das reações adversas destes componentes (incluindo formulações orais e injetáveis) são relevantes uns aos outros.
Reações adversas a medicamentos relatadas com paliperidona e/ou risperidona por ≥ 2% de pacientes tratados com Paliperidona em uma combinação de dados de 9 estudos clínicos duplo-cegos, controlados por placebo, de esquizofrenia e transtorno esquizoafetivo (8 em adultos e 1 em pacientes adolescentes) são mostradas na Tabela 4.
Tabela 4: Reações adversas medicamentosas relatadas com paliperidona e/ou risperidona por > 2% de pacientes tratados com Paliperidona em uma combinação de dados de 9 estudos clínicos, duplo-cegos, controlados por placebo de esquizofrenia e de transtorno esquizoafetivo (8 em adultos e 1 em pacientes adolescentes). Os termos de cada Sistema ou Classe de Órgão estão ordenados alfabeticamente:
| Sistema ou Classe de Órgão | Reação Adversa |
| Infecções e Infestações | Infecção do trato respiratório superior |
| Transtornos Psiquiátricos | Insônia* |
| Transtornos do Sistema Nervoso | Acatisia*, distonia*, parkinsonismo* |
| Transtornos Gastrintestinais | Desconforto abdominal, diarreia |
| Transtornos do Tecido Conectivo e Musculoesquelético | Dor musculoesquelética |
*Insônia inclui: insônia inicial, insônia média; Acatisia inclui: hipercinesia, síndrome das pernas inquietas, inquietação; Distonia inclui: blefaroespasmo, espasmo cervical, emprostótono, espasmo facial, hipertonia, laringoespasmo, contrações musculares involuntárias, miotonia, crise oculógira, opistótono, espasmo orofaríngeo, pleurotótono, riso sardônico, tetania, paralisia da língua, espasmo da língua, torcicolo, trismo; Parkinsonismo inclui: acinesia, bradicinesia, rigidez em roda denteada, hipersalivação, sintomas extrapiramidais, reflexo glabelar anormal, rigidez muscular, tensão muscular, rigidez musculoesquelética.
Reações adversas a medicamentos relatadas com paliperidona e/ou risperidona por < 2% de pacientes tratados com Paliperidona em uma combinação de dados de 9 estudos clínicos, duplo-cegos, controlados por placebo de esquizofrenia e de transtorno esquizoafetivo (8 em adultos e 1 em pacientes adolescentes) são mostradas na Tabela 5.
Tabela 5: Reações adversas medicamentosas relatadas com paliperidona e/ou risperidona por < 2% de pacientes tratados com Paliperidona em uma combinação de dados de 9 estudos clínicos, duplo-cegos, controlados por placebo de esquizofrenia e de transtorno esquizoafetivo (8 em adultos e 1 em pacientes adolescentes). Os termos de cada Sistema ou Classe de Órgão estão ordenadas alfabeticamente:
| Sistema ou classe de órgão | Reação Adversa |
| Infecções e Infestações | Acarodermatite, bronquite, celulite, cistite, infecção de ouvido, gripe, onicomicose, pneumonia, infecção no trato respiratório, sinusite, tonsilite, infecção no trato urinário. |
| Transtornos do Sistema Sanguíneo e Linfático | Anemia, diminuição do hematócrito, neutropenia, contagem reduzida de células brancas do sangue. |
| Transtornos do Sistema Imunológico | Reação anafilática, hipersensibilidade. |
| Transtornos do Sistema Endócrino | Hiperprolactinemia. |
| Transtornos Metabólicos e Nutricionais | Anorexia, aumento do colesterol sanguíneo, aumento do triglicérides sanguíneo, diminuição do apetite, hiperglicemia, diminuição do peso. |
| Transtornos Psiquiátricos | Anorgasmia, depressão, diminuição da libido, pesadelos, transtorno do sono. |
| Transtornos do Sistema Nervoso | Acidente vascular cerebral, convulsão*, distúrbios de atenção, tontura postural, discinesia*, hipoestesia, perda da consciência, parestesia, hiperatividade psicomotora, síncope, discinesia tardia. |
| Transtornos Oftalmológicos | Conjuntivite, olhos secos, aumento do lacrimejamento, fotofobia. |
| Transtornos de ouvido e labirinto | Dor de ouvido, zumbido, vertigem. |
| Transtornos Cardíacos | Bloqueio atrioventricular, bradicardia, transtorno de condução, eletrocardiograma anormal, eletrocardiograma com QT prolongado, palpitações. |
| Transtornos Vasculares | Rubor, hipertensão, hipotensão, isquemia. |
| Transtornos Respiratórios, Torácicos e do Mediastino | Tosse, dispneia, hiperventilação, congestão nasal, dor faringolaringeal, chiado. |
| Transtornos Gastrintestinais | Queilite, disfagia, incontinência fecal, flatulência, gastroenterite, obstrução intestinal, inchaço na língua, dor de dente. |
| Transtornos Hepatobiliares | Aumento da gama-glutamiltransferase, aumento das enzimas hepáticas, aumento das transaminases. |
| Transtornos da Pele e do Tecido Subcutâneo | Acne, pele seca, eczema, eritema, prurido, erupção cutânea, dermatite seborreica, descoloração da pele. |
| Transtornos do Tecido Conectivo e Musculoesquelético | Artralgia, dor nas costas, aumento da creatinafosfoquinase sanguínea, rigidez articular, inchaço das articulações, espasmos musculares, fraqueza muscular, dor no pescoço. |
| Transtornos Renais e Urinários | Disúria, polaciúria, incontinência urinária. |
| Transtornos do Sistema Reprodutivo e de Mamas | Secreção mamária, desconforto mamário, engurgitamento mamário, transtorno da ejaculação, disfunção erétil, ginecomastia, transtornos menstruais*, disfunção sexual, secreção vaginal. |
| Transtornos Gerais | Aumento da temperatura corpórea, desconforto no peito, calafrios, edema da face, marcha anormal, edema*, pirexia, sede. |
| Lesões, Envenenamento e Complicações Posturais | Queda. |
*Convulsão inclui: convulsão de grande mal; Discinesia inclui: atetose, coreia, coreoatetose, transtorno do movimento, contração muscular, mioclonia; Transtorno menstrual inclui: menstruação irregular, oligomenorreia: Edema inclui: edema generalizado, edema periférico, edema depressível.
Reações adversas a medicamentos relatadas com paliperidona e/ou risperidona em outros estudos clínicos, mas não relatadas por pacientes tratados com Paliperidona (3 – 12 mg) em uma combinação de dados de 9 estudos clínicos, duplo-cegos, controlados por placebo de esquizofrenia e de transtorno esquizoafetivo (8 em adultos e 1 em pacientes adolescentes) são mostradas na Tabela 6.
Tabela 6: Reações adversas medicamentosas relatadas com paliperidona e/ou risperidona em outros estudos clínicos mas não relatadas por pacientes tratados com Paliperidona (3 – 12 mg) em uma combinação de dados de 9 estudos clínicos, duplo-cegos, controlados por placebo de esquizofrenia e de transtorno esquizoafetivo (8 em adultos e 1 em pacientes adolescentes). Os termos de cada Sistema ou Classe de Órgão estão ordenadas alfabeticamente:
| Sistema ou classe de órgão | Reação Adversa |
| Infecções e Infestações | Infecção nos olhos. |
| Transtornos do Sistema Sanguíneo e Linfático | Contagem aumentada de eosinófilos. |
| Transtornos do Sistema Endócrino | Glicose presente na urina. |
| Transtornos Metabólicos e Nutricionais | Hiperinsulinemia, polidipsia. |
| Transtornos Psiquiátricos | Embotamento afetivo, estado confusional. |
| Transtornos do Sistema Nervoso | Transtorno de equilíbrio, transtorno vascular cerebral, coordenação anormal, nível reduzido de consciência, coma diabético, instabilidade da cabeça, síndrome neuroléptica maligna, ausência de resposta a estímulos. |
| Transtornos Oftalmológicos | Transtorno do movimento dos olhos, crise oculógira, glaucoma, hiperemia ocular. |
| Transtornos Cardíacos | Síndrome da taquicardia postural ortostática. |
| Transtornos Respiratórios, Torácicos e do Mediastino | Disfonia, pneumonia por aspiração, congestão pulmonar, estertores, congestão do trato respiratório. |
| Transtornos Gastrintestinais | Fecaloma. |
| Transtornos da Pele e do Tecido Subcutâneo | Erupção medicamentosa, hiperqueratose, urticária. |
| Transtornos do Tecido conectivo e Musculoesquelético | Postura anormal, rabdomiólise. |
| Transtornos do Sistema Reprodutivo e de Mamas | Aumento das mamas, atraso na menstruação. |
| Transtornos Gerais | Diminuição da temperatura corpórea, síndrome de retirada do medicamento, endurecimento, mal-estar. |
Pacientes idosos
A segurança de Paliperidona foi avaliada em 81 pacientes idosos com esquizofrenia (idade ≥65 anos) que receberam doses flexíveis (n=76) ou fixas (n=5) de Paliperidona na faixa de 3 a 12 mg uma vez ao dia por até 6 semanas durante os estudos duplo-cegos, controlados com placebo. Embora esse conjunto de dados não permita uma comparação direta sistemática entre pacientes idosos e não idosos, o perfil de segurança foi similar nas duas populações. No entanto, com base nesses dados limitados e consistentes com a prática clínica geral, não é possível excluir uma maior sensibilidade de indivíduos mais idosos a reações adversas.
Eventos de interesse particular para a classe
Sintomas extrapiramidais
Os dados agrupados dos 3 estudos clínicos de esquizofrenia de dose fixa, controlados com placebo, de 6 semanas de duração não revelaram diferenças nos eventos extrapiramidais que surgiram com o tratamento, comparando-se o placebo (11%) e Paliperidona 3 e 6 mg (13% e 10%, respectivamente).
Sintomas extrapiramidais relacionados à dose foram observados nas duas dosagens maiores de Paliperidona (25% e 26% para as doses de 9 e 12 mg, respectivamente). Os sintomas extrapiramidais incluíram uma análise agrupada dos seguintes termos: discinesia, distonia, hipercinesia, Parkinsonismo e tremor. Dados agrupados de 2 estudos duplo-cegos, controlados por placebo com duração de 6 semanas em pacientes com transtorno esquizoafetivo mostraram resultados similares.
Ganho de peso
Nos dados agrupados dos 3 estudos clínicos de esquizofrenia de dose fixa em adultos, controlados com placebo, de 6 semanas de duração, as proporções de pacientes que atingiram o critério de ganho de peso ≥ 7% do peso corporal foram comparadas e revelaram uma incidência similar de ganho de peso para Paliperidona 3 mg (7%) e 6 mg (6%) em comparação ao placebo (5%) e uma maior incidência de ganho de peso para 9 mg (9%) e 12 mg (9%).
O ganho de peso em pacientes adolescentes com esquizofrenia foi avaliado em um estudo duplo-cego, controlado por placebo, com duração de 6 semanas, e em uma fase de extensão aberta, cuja mediana de duração da exposição a Paliperidona foi de 182 dias.
No estudo duplo-cego, controlado por placebo, uma porcentagem mais elevada de pacientes tratados com Paliperidona em dose baixa (6%), dose média (13%) e dose alta (13%) tiveram um aumento do peso corporal ≥ 7% em relação a linha de base quando comparados aos pacientes tratados com placebo (2%).
No estudo aberto de longo prazo, a proporção dos pacientes totais tratados com Paliperidona com um aumento de peso corporal de ≥ 7% em relação a linha de base foi de 33%. Ao se tratar pacientes adolescentes com Paliperidona, o ganho de peso deveria ser avaliado levando-se em consideração o aumento esperado com o crescimento normal.
Quando se leva em consideração a duração mediana de exposição a Paliperidona no estudo aberto (182 dias) juntamente com o crescimento normal esperado nesta população, uma avaliação de escores padronizados em relação aos dados normativos fornece uma medida clinicamente mais relevante das alterações no peso.
A variação média do peso, em escores padronizados, na fase aberta, da linha de base ao desfecho, foi 0,1 (4% acima da mediana dos dados normativos). Baseando-se na comparação com os dados normativos, estas mudanças não são consideradas clinicamente significativas.
Nos dados agrupados de 2 estudos duplo-cegos em adultos, com duração de 6 semanas em pacientes com transtorno esquizoafetivo (veja o item Propriedades farmacodinâmicas – Eficácia clínica), uma porcentagem mais alta de pacientes tratados com Paliperidona (5%) teve um aumento no peso corporal de > 7% comparado com pacientes tratados com placebo (1%). No estudo que investigou grupos com doses elevadas e baixas, o aumento do peso corpóreo de > 7% era 3% no grupo de dose baixa, 7% no grupo de dose elevada e 1% no grupo placebo.
Exames laboratoriais
Prolactina sérica
Com base nos dados agrupados dos 3 estudos clínicos de esquizofrenia de dose fixa, controlados com placebo, de 6 semanas de duração, foram observados aumentos medianos na prolactina sérica em pacientes de ambos os sexos que receberam Paliperidona. Os aumentos médios máximos da concentração de prolactina sérica foram observados, em geral, no 15o dia do tratamento, mas permaneceram acima dos níveis da linha de base ao final do estudo.
Estudos Clínicos Reações adversas a medicamentos em estudo de longa-duração, controlado por placebo
A segurança de Paliperidona foi também avaliada em estudo de longa duração, delineado para avaliar manutenção do efeito de Paliperidona em adultos com esquizofrenia. Em geral, os tipos, frequências e gravidades das reações adversas à droga, relatados durante a fase inicial, aberta, de 14 semanas deste estudo, foram comparáveis àqueles relatados no estudo de curto prazo, por 06 semanas, com dose fixa, controlado por placebo. As reações adversas à droga relatadas durante a fase de longo prazo, duplo-cega deste estudo foram similares em tipo e gravidade às observadas na fase aberta, inicial, com duração de 14 semanas; entretanto, em geral ocorreram em frequências menores.
Dados pós-comercialização
Eventos adversos inicialmente identificados como Reações Adversas ao Medicamento (RAM) durante o período de pós-comercializaçao com paliperidona e/ou risperidona estão listados na tabela 7.
As frequências são fornecidas seguindo a convenção abaixo
- Muito comum >1/10;
- Comum >1/100 a <1/10;
- Incomum >1/1000 a <1/100;
- Raro >1/10000 a 1/1000;
- Muito raro <1/10000, incluindo relatos isolados.
Tabela 7: Reações adversas medicamentosas identificadas durante o período de pós-comercialização com Paliperidona e/ou risperidona por frequência da categoria a partir de relatos espontâneos:
| Sistema ou classe de órgão | Categoria de frequência | Reação Adversa |
| Transtornos do Sistema Sanguíneo e Linfático | Muito raro | Agranulocitose, trombocitopenia. |
| Transtornos do Sistema Endócrino | Desconhecido | Secreção inapropriada de hormônio antidiurético. |
| Transtornos Metabólicos e Nutricionais | Muito raro | Diabetes mellitus, cetoacidose diabética, hipoglicemia. |
| Desconhecido | Intoxicação por água. | |
| Transtornos Psiquiátricos | Muito Raro | Mania. |
| Transtornos do Sistema Nervoso | Muito Raro | Disgeusia. |
| Transtornos Oftalmológicos | Desconhecido | Síndrome de Íris Flácida (Intraoperatória). |
| Transtornos Cardíacos | Muito Raro | Fibrilação atrial. |
| Transtornos Vasculares | Muito Raro | Trombose venosa profunda, embolia pulmonar. |
| Transtornos respiratórios, torácicos e do mediastino | Muito Raro | Síndrome da apneia do sono. |
| Transtornos Gastrintestinais | Muito Raro | Pancreatite. |
| Muito Raro | Obstrução intestinal. | |
| Transtornos Hepatobiliares | Desconhecido | Icterícia. |
| Transtornos da Pele e do Tecido Subcutâneo | Raro | Angioedema. |
| Muito Raro | Alopecia. | |
| Transtornos Renais e Urinários | Muito Raro | Retenção Urinária. |
| Gravidez, Puerpério e Condições Perinatais | Muito Raro | Síndrome neonatal de retirada do medicamento. |
| Transtornos do Sistema Reprodutor e Mamário | Muito raro | Priapismo. |
| Transtornos Gerais | Muito raro | Hipotermia. |
Em casos de eventos adversos, notifique ao Sistema de Notificações em Vigilância Sanitária - NOTIVISA ou para a Vigilância Sanitária Estadual ou Municipal.
Interação medicamentosa: quais os efeitos de tomar Paliperidona com outros remédios?
Recomenda-se cautela ao prescrever Paliperidona com medicamentos conhecidos por prolongar o intervalo QT.
Potencial de Paliperidona afetar outros fármacos
Não é esperado que a paliperidona cause interações farmacocinéticas clinicamente importantes com fármacos que são metabolizados pelas isoenzimas do citocromo P-450. Estudos in vitro em microssomas hepáticos humanos mostraram que a paliperidona não inibe de forma substancial o metabolismo de fármacos metabolizados pelas isoenzimas do citocromo P-450, incluindo CYP1A2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2E1, CYP3A4 e CYP3A5.
Portanto, não se espera que a paliperidona iniba, de forma clinicamente relevante, a depuração de fármacos que são metabolizados por essas vias metabólicas. Estudos in vitro indicaram que a paliperidona não é um indutor da atividade da CYP1A2, 2C19 ou 3A4.
Em altas concentrações, a paliperidona é um fraco inibidor da glicoproteína-P (P-gp). Não há dados in vivo disponíveis e a relevância clínica é desconhecida.
Devido aos efeitos primários da paliperidona sobre o sistema nervoso central, Paliperidona deve ser usado com cautela em combinação com outros fármacos de ação central e álcool. A paliperidona pode antagonizar o efeito da levodopa e outros agonistas dopaminérgicos.
Devido ao seu potencial para induzir hipotensão ortostática, pode ser observado um efeito aditivo quando Paliperidona é administrado com outros agentes terapêuticos que possuem esse potencial.
A interação farmacocinética entre Paliperidona e lítio é improvável.
A administração concomitante de Paliperidona durante o estado de equilíbrio (12 mg, uma vez ao dia) com comprimidos de liberação prolongada de divalproato de sódio (500 mg a 2000 mg, uma vez ao dia) não afetou a farmacocinética do estado de equilíbrio do valproato.
Potencial para outros fármacos afetarem Paliperidona
A paliperidona não é um substrato da CYP1A2, CYP2A6, CYP2C9, CYP2C19 e CYP3A5. Isso sugere que não é provável a ocorrência de interação com inibidores ou indutores dessas isoenzimas.
Embora estudos in vitro indiquem que a CYP2D6 e a CYP3A4 podem estar minimamente envolvidas no metabolismo da paliperidona, não há indicações in vitro nem in vivo de que essas isoenzimas tenham um papel significativo no metabolismo da paliperidona. Estudos in vitro demonstraram que a paliperidona é um substrato da glicoproteína P.
A paliperidona é metabolizada com extensão limitada pela CYP2D6. Não foram observados efeitos clinicamente relevantes sobre a farmacocinética da paliperidona, em um estudo de interação em indivíduos saudáveis no qual Paliperidona foi administrado concomitantemente com paroxetina, um potente inibidor da CYP2D6.
A coadministração de Paliperidona uma vez ao dia com carbamazepina 200 mg duas vezes ao dia causou uma diminuição de aproximadamente 37% no estado de equilíbrio médio da Cmáx e AUC da paliperidona.
Esta diminuição é causada por um grau substancial, por um aumento de 35% na depuração renal da paliperidona provavelmente como um resultado da indução da glicoproteína P renal pela carbamazepina. Uma menor diminuição na quantidade de droga excretada inalterada na urina sugere que há um pequeno efeito sobre o metabolismo da CYP ou biodisponibilidade da paliperidona durante a coadministração da carbamazepina.
A dose de Paliperidona deve ser reavaliada e aumentada se necessário, após a introdução de carbamazepina.
De modo inverso, após a descontinuação da carbamazepina, a dose de Paliperidona deve ser reavaliada e diminuída caso necessário.
A paliperidona, um cátion em pH fisiológico, é excretada principalmente pelos rins, aproximadamente metade por filtração e metade por secreção ativa. A administração concomitante de trimetoprima, um fármaco conhecido por inibir o transporte renal ativo de fármacos catiônicos, não influenciou a farmacocinética da paliperidona.
A administração concomitante de uma dose única de Paliperidona 12 mg com comprimidos de liberação prolongada de divalproato de sódio (dois comprimidos de 500 mg, uma vez ao dia) resultou em um aumento de aproximadamente 50% na Cmáx e AUC da paliperidona.
Deve ser considerada redução na dose de Paliperidona quando for administrado concomitantemente com valproato após avaliação clínica.
A interação farmacocinética entre Paliperidona e lítio é improvável.
Uso concomitante de Paliperidona com risperidona
O uso concomitante de Paliperidona com risperidona não foi estudado. Uma exposição adicional à paliperidona deve ser considerada se a risperidona for coadministrada com Paliperidona.
Não é recomendada a utilização concomitante de Paliperidona com risperidona oral, uma vez que a paliperidona é um metabólito ativo da risperidona e a combinação dos dois fármacos pode conduzir a uma exposição adicional de paliperidona.
Uso de Paliperidona com álcool
Devido aos efeitos primários da paliperidona sobre o sistema nervoso central, Paliperidona deve ser usado com cautela em combinação com álcool.
Exames laboratoriais
Prolactina sérica
Foram observados aumentos medianos na prolactina sérica em pacientes de ambos os sexos que receberam Paliperidona. Os aumentos médios máximos da concentração de prolactina sérica foram observados, em geral, no 15º dia do tratamento, mas permaneceram acima dos níveis da linha de base ao final do estudo.
Tabagismo
Com base nos estudos in vitro utilizando enzimas hepáticas humanas, a paliperidona não é um substrato para a CYP1A2, portanto, o tabagismo, não deve afetar a farmacocinética da paliperidona. Uma análise farmacocinética da população demonstrou haver uma exposição à paliperidona ligeiramente menor em fumantes do que em não fumantes. No entanto, é improvável que esta diferença possua relevância clínica.
Interação Alimentícia: posso usar o Paliperidona com alimentos?
Paliperidona deve ser tomado toda manhã com ou sem café da manhã, porém da mesma maneira todos os dias.
Embora a presença ou ausência de alimentos no tempo de administração de Paliperidona possam aumentar ou diminuir a exposição à paliperidona, estas alterações não foram consideradas clinicamente relevantes. Os estudos clínicos que estabeleceram a eficácia e a segurança de Paliperidona foram realizados sem relação com o tempo das refeições.
Interação Alimentícia: posso usar o Paliperidona com alimentos?
Paliperidona deve ser tomado toda manhã com ou sem café da manhã, porém da mesma maneira todos os dias.
Embora a presença ou ausência de alimentos no tempo de administração de Paliperidona possam aumentar ou diminuir a exposição à paliperidona, estas alterações não foram consideradas clinicamente relevantes. Os estudos clínicos que estabeleceram a eficácia e a segurança de Paliperidona foram realizados sem relação com o tempo das refeições.
Qual a ação da substância do Paliperidona?
Resultados de eficácia
Esquizofrenia Adultos
A eficácia de Paliperidona foi estabelecida em 3 estudos clínicos controlados com placebo e com ativo (olanzapina), duplo-cegos, de 6 semanas de duração em pacientes que preenchiam os critérios estipulados pelo “Manual de Transtornos Mentais publicados pela “American Psychiatric Association (DSM-IV-TR)” para esquizofrenia.
O controle ativo foi incluído para fins de sensibilidade do teste. As doses de Paliperidona, que variaram entre os 3 estudos, foram de 3 a 15 mg uma vez ao dia.
A eficácia foi avaliada usando a Escala de Síndrome Positiva e Negativa (PANSS); o desfecho primário foi a redução nos escores totais da PANSS. Uma análise dos subgrupos populacionais não revelou qualquer evidência de resposta diferenciada em relação à idade, raça ou gênero.
Desfechos secundários também foram avaliados, incluindo a escala de Desempenho Pessoal e Social (Personal and Social Performance PSP) e escala de Impressão Clínica Global Gravidade (Clinical Global Impression – Severity: CGI-S). A escala PSP corresponde a um instrumento de avaliação clínica validado que mede quatro áreas de funcionamento pessoal e social (atividades sociais úteis incluindo trabalho, estudo, relacionamentos pessoais e sociais, cuidados pessoais, comportamento perturbado e agressivo).
A escala CGI-S corresponde a uma avaliação global de impressão clínica do investigador em relação à gravidade da doença. Em uma análise com dados agrupados (“pooled data”) destes três estudos, cada dose de Paliperidona apresentou-se de forma superior, ao ser comparado com o placebo em relação ao PSP e CGI-S. Em adição, o efeito em PSP mostrou-se distinto da melhora nos sintomas medidos como desfecho primário (PANSS total).
Em análise posterior da fase aberta de extensão destes três estudos, foi revelado que a dose flexível de Paliperidona (3 a 15 mg, dose diária), por mais de 52 semanas, estava associada com uma contínua melhora na escala PSP.
Em estudo de longo prazo, delineado para avaliar a manutenção de efeito, Paliperidona apresentou-se de maneira significativamente mais eficaz que o placebo para a manutenção do controle dos sintomas e retardando a recorrência da esquizofrenia.
Neste estudo, adultos que preencheram os critérios estabelecidos pela DSM-IV para esquizofrenia e que permaneceram clinicamente estáveis por meio de doses determinadas de Paliperidona, durante um período de 8 semanas de tratamento aberto (doses entre 3 e 15 mg uma vez ao dia), depois de receberem um tratamento para um episódio agudo para as 06 semanas prévias com Paliperidona (doses entre 3 a15 mg uma vez ao dia), foram então aleatoriamente alocados de forma duplo-cega para continuar com Paliperidona, em dose estável, ou placebo, até que fossem observados sintomas de recorrência da esquizofrenia.
O estudo foi interrompido precocemente por motivos de eficácia, quando se atingiram critérios pré-definidos.
Com base em uma análise interna foi demonstrado um tempo significativamente maior para a recorrência em pacientes tratados com Paliperidona, comparados ao placebo (p=0,0053). Baseado em uma análise final e considerando os pacientes incluídos após o ponto de corte utilizado para análise interina, a taxa de eventos recorrentes foi de 22,1% no grupo de Paliperidona, comparada à taxa de 51,5% apresentada pelo grupo placebo.
Uma significativa melhora nos sintomas foi alcançada ao final da fase aberta em estabilização (decréscimo em valores totais em PANSS de 38 pontos, com desvio padrão de ± 16,03); entretanto, após a alocação aleatória para tratamento duplo-cego, os pacientes recebendo placebo deterioraram significativamente mais que pacientes recebendo Paliperidona (p<0,001). Paliperidona também foi significativamente mais efetivo que o placebo na manutenção de desempenho pessoal e social. Durante a fase duplo-cega deste estudo, de acordo com a medida da escala CGI-S, houve uma piora da gravidade total da psicose no grupo placebo, enquanto pacientes tratados com Paliperidona permaneceram clinicamente estáveis.
A redução do risco absoluto (RRA) e número necessário para tratar (NNT), necessários para promover melhora ≥30% no escore total da escala PANSS em 03 estudos clínicos fase III comparativos com placebo (SCH-303 / SCH-304 / SCH-305) são apresentados na tabela abaixo:
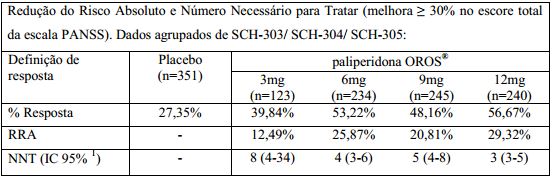 % Resposta: porcentagem de pacientes com melhora de ≥30% no escore total da escala PANSS, da linha de base ao ponto final.
% Resposta: porcentagem de pacientes com melhora de ≥30% no escore total da escala PANSS, da linha de base ao ponto final.
RRA: Redução do Risco Absoluto diferença entre a proporção de pacientes respondendo à paliperidona de liberação prolongada e placebo.
NNT: Número Necessário para Tratar: 1/RRA número de pacientes que necessitariam ser tratados para obter um desfecho positivo adicional que não ocorreria caso o paciente tivesse recebido placebo.
IC: Intervalo de Confiança.
Em resumo, a eficácia e a segurança de Paliperidona foram demonstradas em 03 estudos de fase III, com 06 semanas de duração.
A eficácia de PaliperidonaM na manutenção da estabilidade clínica foi comprovada por um período de até 11 meses. Isto foi demonstrado em um estudo para avaliar a recorrência de sintomas em pacientes com esquizofrenia clinicamente estáveis por um período de 08 semanas.
Esquizofrenia Adolescentes
A eficácia de Paliperidona em pacientes adolescentes com esquizofrenia foi estabelecida em um ensaio clínico randomizado, duplo-cego, em grupos paralelos, controlado por placebo, com duração de 6 semanas e desenho de grupo de tratamento com dose fixa baseado no peso corporal, na faixa de dose de 1,5 a 12 mg/dia.
Os pacientes tinham de 12 a 17 anos de idade e preenchiam os critérios estipulados pelo “Manual de Transtornos Mentais publicados pela “American Psychiatric Association (DSM-IV-TR)” para esquizofrenia, com confirmação do diagnóstico utilizando o questionário “Kiddie Schedule for Affective Disorders and Schizophrenia Present and Lifetime Version (K-SADS-PL)”.
Pacientes elegíveis foram aleatoriamente alocados para 1 dos 4 grupos de tratamento
Um grupo placebo ou grupos de dose baixa, média ou alta de Paliperidona. As doses foram administradas baseando-se no peso corporal para minimizar o risco de exposição de adolescentes com menor peso a doses mais elevadas de Paliperidona.
Pacientes com peso entre 29 kg e 51 kg na linha de base da visita foram aleatoriamente alocados para receber placebo ou 1,5 mg (dose baixa), 3 mg (dose média), ou 6 mg (dose alta) de Paliperidona diariamente, e os pacientes pesando pelo menos 51 kg na linha de base da visita foram aleatoriamente alocados para receber placebo ou 1,5 mg (dose baixa), 6 mg (dose média), ou 12 mg (dose alta) de Paliperidona diariamente.
A dose foi administrada pela manhã, independentemente das refeições.
A eficácia foi avaliada usando PANSS. Este estudo demonstrou a eficácia de Paliperidona em pacientes adolescentes com esquizofrenia, quando administrado em doses diárias de 3, 6 e 12 mg em grupos de tratamento baseados no peso corporal.
A dose mínima efetiva para Paliperidona nesta população foi de 3 mg/dia.
Transtorno esquizoafetivo
A eficácia de Paliperidona (3 mg a 12 mg uma vez ao dia) no tratamento de transtorno esquizoafetivo foi estabelecida em 2 estudos controlados por placebo com duração de 6 semanas em pacientes não-idosos que preencheram os critérios DSM-IV para o transtorno esquizoafetivo, confirmado pela Entrevista Clínica Estruturada paraTranstornos do DSM-IV.
Em um destes estudos, a eficácia foi avaliada em 203 pacientes que foram atribuídos a um dos dois níveis de dose de Paliperidona
6 mg com a opção de reduzir para 3 mg (n = 105) ou 12 mg com a opção de reduzir para 9 mg (n = 98) uma vez ao dia. No outro estudo, a eficácia foi avaliada em 211 pacientes que receberam doses flexíveis de Paliperidona (3 – 12 uma vez ao dia).
Ambos os estudos incluíram pacientes que receberam Paliperidona em monoterapia ou em combinação com antidepressivos e/ou estabilizadores de humor.
A dose foi administrada pela manhã, independentemente das refeições. Os estudos foram realizados nos Estados Unidos, Europa Oriental, Rússia e Ásia.
A eficácia foi avaliada utilizando a Escala da Síndrome Positiva e Negativa (PANSS), um inventário validado de múltiplos itens composto por 5 fatores para avaliar os sintomas positivos, sintomas negativos, pensamentos desorganizados, hostilidade descontrolada / excitação e ansiedade / depressão.
O grupo de doses elevadas de Paliperidona em estudo de 2 níveis de dose (12 mg/dia com opção de reduzir para 9 mg/dia) e o grupo Paliperidona em estudo de dose flexível (doses entre 3 e 12 mg/dia, dose média modal de 8,6 mg/dia) cada um era superior ao placebo no PANSS.
No grupo de dose mais baixa do estudo de 2 níveis de dose (6 mg/dia com opção de reduzir para 3 mg/dia), Paliperidona não era significativamente diferente do placebo como avaliado pela PANSS.
Avaliando os resultados de ambos os estudos em conjunto, Paliperidona melhorou os sintomas do transtorno esquizoafetivo na avaliação final em relação ao placebo quando administrado em monoterapia ou em combinação com antidepressivos e/ou estabilizadores de humor.
Uma análise dos subgrupos da população não revelou nenhuma evidência de sensibilidade diferencial com base no sexo, idade ou região geográfica. Não havia dados suficientes para explorar os efeitos diferenciais baseados na raça.
Características farmacológicas
Propriedades Farmacodinâmicas
Mecanismo de ação
A paliperidona é um antagonista de ação central de receptores D2 da dopamina, com atividade antagonista serotonérgica 5-HT2A predominante. A paliperidona também é ativa como um antagonista em receptores adrenérgicos alfa-1 e alfa-2 e histaminérgicos H1.
A paliperidona não tem afinidade para receptores colinérgicos muscarínicos ou adrenérgicos beta-1 e beta-2. A atividade farmacológica dos enantiômeros (+) e (-) da paliperidona é similar, tanto qualitativamente como quantitativamente.
O mecanismo de ação da paliperidona, como outros fármacos eficazes em esquizofrenia, é desconhecido. No entanto, foi proposto que a atividade terapêutica do fármaco em esquizofrenia é mediada através da combinação de antagonismo em receptores tipo 2 (5HT2A) de serotonina e tipo 2 (D2) de dopamina.
O antagonismo em outros receptores além do D2 e 5HT2A pode explicar alguns dos outros efeitos da paliperidona.
O tempo médio estimado para o início da ação terapêutica do medicamento é de 4 a 8 dias.
Polisonografia
Medicamentos com ação central através de seu mecanismo de ação, perfil de liberação e/ou tempo da administração da dose podem afetar o sono. Para avaliar o impacto da dose matinal de Paliperidona sobre a arquitetura e a continuidade do sono, foi conduzido um estudo controlado com placebo em 36 pacientes com esquizofrenia onde 9 mg de Paliperidona ou placebo foram administrados uma vez ao dia por 14 dias.
As seguintes observações foram feitas (dados médios em comparação ao placebo) redução de 41,0 (EP 18,70) minutos na latência para sono persistente, diminuição de 35,2 (EP 14,99) minutos na latência para início do sono, redução de 7,0 (EP 3,88) eventos no número de vezes de despertar após o início do sono, aumento do tempo total de sono em 52,8 (SE 24,01) minutos, aumento do período de sono em 41,7 (SE 18,75) minutos e aumento do índice de eficiência do sono em 11,0% (SE 5,00).
Houve também uma redução estatisticamente significativa (em relação ao placebo) no estágio 1 do sono de 11,9 (SE 4,44) minutos e aumento no estágio 2 do sono de 50,7 (SE 17,67) minutos. Não foi observado efeito clinicamente relevante sobre o sono REM.
Efeito no intervalo QT/QTc e na eletrofisiologia cardíaca
Os efeitos da paliperidona sobre o intervalo QT foram avaliados em dois estudos de fase I, randomizados, duplocegos e multicêntricos, em adultos com esquizofrenia e transtorno esquizoafetivo e em 3 estudos de eficácia, de dose fixa, controlados com placebo e com controle ativo de 6 semanas de duração em adultos com esquizofrenia.
No primeiro estudo de fase I (n=141), pacientes foram randomizados para receber igualmente 7 dias de paliperidona oral de liberação imediata uma vez ao dia (com titulação de 4 a 8 mg) ou uma dose única de moxifloxacino (400mg).
A dose de 8 mg uma vez ao dia de paliperidona oral de liberação imediata (n=44) atingiu uma concentração plasmática média no estado de equilíbrio mais de 2 vezes maior que a exposição observada com dose máxima recomendada de 12 mg de Paliperidona (Cmáx ss= 113 e 45 ng/mL, respectivamente).
No modelo de correção “linear-derived QT correction” (QTcLD), houve um aumento médio de 5,5 mseg (90% IC: 3,66; 7,25) no grupo de tratamento com Paliperidona (n=44).
No segundo estudo de fase I (n=109), os pacientes foram randomizados para receber igualmente placebo, ou a dose máxima recomendada de Paliperidona (12 mg uma vez ao dia), subsequentemente titulado a uma dose acima da faixa recomendada (18 mg uma vez ao dia), ou um controle ativo da mesma classe farmacológica de medicamento (400 mg de quetiapina 2 vezes ao dia).
A comparação primária neste estudo de não inferioridade de 10 dias foi entre Paliperidona 12 mg e quetiapina. A média dos mínimos quadrados da condição basal QTcLD a cada um dos tmáx individuais observados foi estimada para ser 5,1 ms menor para Paliperidona 12 mg (Cmáx média 34 ng/mL) comparado com 400 mg de quetiapina 2 vezes ao dia (Cmáx média 1183 ng/mL) (IC 90%: -9,2; -0,9), encontrando o critério de não inferioridade pré-especificado de 10 ms.
A alteração média da condição basal em QTcLD para cada um dos tmáx individuais observados foi estimada para ser 2,3 ms menor para Paliperidona 18 mg (Cmáx média 53 ng/mL) comparado com 400 mg de quetiapina 2 vezes ao dia (Cmáx média 1183 ng/mL) (IC 90%: -6,8; 2,3).
A alteração média da condição basal em QTcLD para cada tmáx individual observado foi estimada para 1,5 ms maior (IC 90%: -3,3; 6,2) para Paliperidona 12 mg e 8,0 ms maior (IC 90%: 3,1; 12,9) para 400 mg de quetiapina 2 vezes ao dia comparado com alteração média da condição basal em QTcLD em um tmáx mediano observado (da droga ativa na comparação) no braço placebo concorrente.
A alteração média da condição basal em QTcLD para cada tmáx individual observado foi estimada para ser 4,9 ms maior (IC 90%: -0,05; 10,3) para paliperidona de liberação prolongada 18 mg e 7,5 ms maior (IC 90%: 2,5; 12,5) para quetiapina 400 mg duas vezes ao dia comparado com a alteração média da condição basal em QTcLD no tmáx mediano observado (da droga ativa na comparação) no braço placebo concorrente.
Nenhum dos pacientes tiveram mudanças da condição basal excedendo 60 mseg ou um QTcLD excedendo 500 mseg durante o tempo de duração de qualquer destes estudos.
Para os 3 estudos de eficácia de dose fixa, medidas eletrocardiográficas extensas foram coletadas em 15 tempos de avaliação em dias determinados (incluindo os tempos de Cmáx esperada), usando metodologia padronizada.
O aumento médio do QTcLD não excedeu 5 mseg em nenhum grupo de tratamento em nenhum tempo de avaliação, com base nos dados agrupados de 836 pacientes tratados com Paliperidona, 357 pacientes tratados com olanzapina e 350 pacientes tratados com placebo.
Um paciente no grupo Paliperidona 12 mg e um paciente no grupo olanzapina tiveram uma mudança que excedeu 60 mseg em um tempo de análise durante esses estudos (aumentos de 62 mseg e 110 mseg, respectivamente).
Propriedades Farmacocinéticas
As informações farmacocinéticas apresentadas a seguir são baseadas em dados de estudos em adultos, com exceção dos casos especificados.
A farmacocinética da paliperidona após a administração de Paliperidona, cuja forma farmacêutica corresponde à de comprimido revestido de liberação prolongada (OROS Push-Pull, tecnologia desenvolvida pela Alza Corporation) é proporcional à dose dentro do intervalo recomendado (3 a 12 mg).
Absorção
Após uma dose única de Paliperidona, as concentrações plasmáticas de paliperidona sobem constantemente até atingir o pico de concentração plasmática (Cmáx) em aproximadamente 24 horas após a administração. Com a administração de Paliperidona uma vez ao dia, as concentrações do estado de equilíbrio da paliperidona são atingidas em 4-5 dias na maioria dos indivíduos.
As características de liberação de Paliperidona resultam em flutuações mínimas do pico e de vale em comparação àquelas observadas com a risperidona de liberação imediata.
Em um estudo comparando a farmacocinética no estado de equilíbrio após a administração de 12 mg de paliperidona (comprimidos de liberação prolongada), uma vez ao dia, com 4 mg de risperidona de liberação imediata em pacientes com esquizofrenia, os índices de flutuação foram 38% para a paliperidona de liberação prolongada em comparação a 125% para a risperidona de liberação imediata.
Figura 1: Perfil de concentração no estado de equilíbrio após a administração de 12 mg de paliperidona (6 comprimidos de liberação prolongada de 2 mg, uma vez ao dia) por 6 dias (as concentrações de paliperidona estão representadas) em comparação a risperidona de liberação imediata administrada como 2 mg uma vez ao dia no Dia 1 e 4 mg uma vez ao dia nos Dias 2 a 6 (as concentrações de paliperidona+risperidona estão representadas):
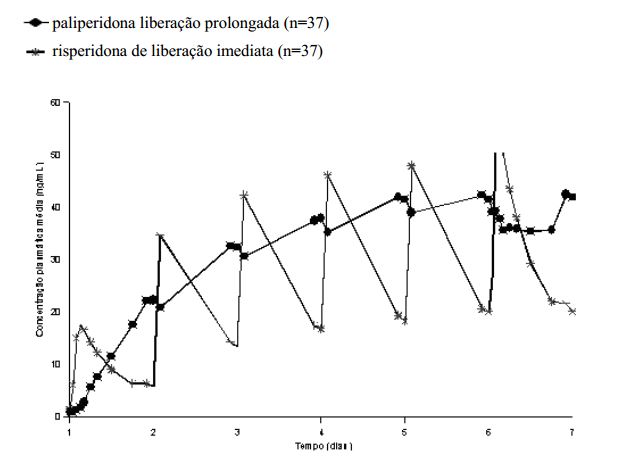
Após a administração de Paliperidona os enantiômeros (+) e (-) da paliperidona se interconvertem, alcançando uma razão de AUC (+) para (-) de aproximadamente 1,6 no estado de equilíbrio. A biodisponibilidade oral absoluta da paliperidona após a administração de Paliperidona é 28%.
Após a administração de um único comprimido de liberação prolongada de paliperidona a voluntários sadios, confinados ao leito por 36 horas, com refeição padrão com alto teor calórico/de gordura, a Cmáx e a AUC aumentaram em 42% e 46%, respectivamente, em comparação com a administração em condição de jejum.
Em outro estudo envolvendo voluntários sadios, após administração de um único comprimido de 12 mg em conjunto com uma refeição padronizada contendo elevado conteúdo de gordura e calorias, foram observados aumentos de 60% e 54% de Cmáx e AUC de paliperidona, respectivamente, comparados à administração em condições de jejum. Embora a presença ou ausência de alimentos no tempo de administração de Paliperidona possam aumentar ou diminuir a exposição à paliperidona, estas alterações não foram consideradas clinicamente relevantes.
Os estudos clínicos que estabeleceram a eficácia e a segurança de Paliperidona foram realizados sem relação com o tempo das refeições.
Distribuição
A paliperidona é rapidamente distribuída. O volume aparente de distribuição é 478 L. A ligação da paliperidona às proteínas plasmáticas é de 74%. Ela liga-se, principalmente, à glicoproteína alfa-1 ácida e à albumina.
Em condições in vitro, concentrações terapêuticas altas de diazepam (3 mcg/mL), sulfametazina (100 mcg/mL), varfarina (10 mcg/mL) e carbamazepina (10 mcg/mL) causaram um pequeno aumento na fração livre de paliperidona em 50 ng/mL. Não é esperado que essas mudanças tenham significância clínica.
Metabolismo e eliminação
Uma semana após a administração de uma dose oral única de 1 mg de 14C-paliperidona de liberação imediata, 59% da dose foi excretada inalterada na urina, indicando que a paliperidona não é extensivamente metabolizada no fígado. Aproximadamente 80% da radioatividade administrada foi recuperada na urina e 11% nas fezes.
Quatro vias metabólicas foram identificadas in vivo, nenhuma das quais representou mais de 6,5% da dose: desalquilação, hidroxilação, desidrogenação e cisão de benzisoxazol. Embora estudos in vivo tenham sugerido um papel para a CYP2D6 e a CYP3A4 no metabolismo da paliperidona, não há evidência in vivo de que essas isoenzimas representem um papel significativo no metabolismo da paliperidona.
Apesar da ampla variação na população em geral com relação à capacidade de metabolizar substratos de CYP2D6, as análises da farmacocinética da população não indicaram diferença perceptível na depuração aparente de paliperidona após a administração de Paliperidona entre metabolizadores rápidos e lentos de substratos de CYP2D6.
Estudos in vitro usando preparados de microssomas de sistemas heterólogos indicam que as CYP1A2, CYP2A6, CYP2C9, CYP2C19 e CYP3A5 não estão envolvidas no metabolismo da paliperidona. A meia-vida terminal de eliminação da paliperidona é cerca de 23 horas.
Insuficiência hepática
A paliperidona não é extensivamente metabolizada pelo fígado. Em um estudo em pacientes com insuficiência hepática moderada (Child-Pugh classe B), as concentrações plasmáticas da paliperidona livre foram similares àquelas em indivíduos sadios. A paliperidona não foi estudada em pacientes com insuficiência hepática grave.
Insuficiência renal
A dose deve ser reduzida em pacientes com insuficiência renal moderada e grave. A disposição da paliperidona foi estudada em pacientes com graus variáveis de insuficiência renal. A eliminação da paliperidona diminuiu com a diminuição da depuração da creatinina (DC).
A depuração total da paliperidona foi reduzida em pacientes com insuficiência renal
em 32% nos casos leves (DC = 50 a < 80 mL/min), 64% nos casos moderados (DC = 30 a < 50 mL/min) e 71% nos casos graves (DC = 10 a < 30 mL/min). A meia-vida de eliminação terminal da paliperidona foi 24, 40 e 51 horas em pacientes com insuficiência renal leve, moderada e grave, respectivamente, em comparação a 23 horas em indivíduos com a função renal normal (DC ≥ 80 mL/min).
Adolescentes
A exposição sistêmica à paliperidona em pacientes adolescentes foi comparável à exposição em adultos.
Em adolescentes com peso < 51 kg foi observada uma exposição 23% maior do que em adolescentes com peso ≥ 51 kg; este aumento não foi considerado clinicamente significativo. A idade, por si só, não influenciou na exposição à paliperidona.
Idosos
Os dados de um estudo de farmacocinética em indivíduos idosos (≥65 anos de idade, n=26) indicaram que a depuração aparente da paliperidona, no estado de equilíbrio após a administração de Paliperidona, foi 20% menor em comparação a indivíduos adultos (18-45 anos de idade, n=28).
No entanto, não houve efeito perceptível da idade na análise da farmacocinética da população envolvendo pacientes com esquizofrenia após a correção das reduções na depuração da creatinina relacionadas à idade.
Raça
Não é recomendado ajuste de dose com base na raça. A análise farmacocinética populacional não revelou evidências de diferenças relacionadas à raça na farmacocinética da paliperidona seguindo a administração de Paliperidona.
Em um estudo farmacocinético conduzido em japoneses e caucasianos não foram observadas diferenças na farmacocinética.
Sexo
A depuração aparente da paliperidona após a administração de Paliperidona é aproximadamente 19% menor em mulheres que em homens.
Essa diferença é amplamente explicada pelas diferenças na massa muscular corporal e na depuração da creatinina entre homens e mulheres, pois uma avaliação da farmacocinética da população não revelou evidência de diferenças clinicamente significativas relacionadas ao sexo na farmacocinética da paliperidona após a administração de Paliperidona, após correção para a massa muscular e a depuração de creatinina.
Tabagismo
Com base nos estudos in vitro utilizando enzimas hepáticas humanas, a paliperidona não é um substrato para a CYP1A2, portanto, o tabagismo, não deve afetar a farmacocinética da paliperidona.
Uma análise farmacocinética da população demonstrou haver uma exposição à paliperidona ligeiramente menor em fumantes do que em não-fumantes. No entanto, é improvável que esta diferença possua relevância clínica.
Dados de segurança pré-clinica
Toxicologia
Da mesma forma que outros fármacos antagonistas de receptores dopamina D2, a paliperidona elevou os níveis de prolactina sérica em estudos de toxicidade de dose repetida.
Em um estudo de toxicidade juvenil com 7 semanas de duração e doses orais de paliperdona de 0,16; 0,63 e 2,5 mg/dia, que correspondem, respectivamente, a 0,12; 0,5 e 1,8 vezes a dose máxima humana (12 mg/dia) recomendada para adolescentes em mg/m2, não foram observados efeitos no crescimento, maturidade sexual e desempenho reprodutivo.
Doses de até 2,5 mg/kg/dia não prejudicaram o desenvolvimento neurocomportamental em machos e fêmeas, exceto pelo efeito sobre a aprendizagem e memória em ratas fêmeas tratadas com 2,5 mg/kg/dia. Este efeito não foi observado após a descontinuação do tratamento.
Em um estudo com duração de 40 semanas em cães jovens tratados com ripseridona oral (que é extensivamente convertida a paliperidona) em doses de 0,31, 1,25, e 5 mg/kg/dia, a maturidade sexual não foi adversamente afetada com 0,31 e 1,25 mg/kg/dia. O crescimento de ossos longos não foi afetado com 0,31 mg/kg/dia; efeitos foram observados com 1,25 e 5 mg/kg/dia.
Carcinogenicidade
O potencial carcinogênico da paliperidona foi avaliado com base em estudos com a risperidona conduzidos em camundongos e ratos, uma vez que a paliperidona corresponde a um metabólito ativo da risperidona. A risperidona foi administrada em doses de até 10 mg/kg/dia por 18 meses em camundongos e 25 meses em ratos.
Houve aumentos estatisticamente significativos de adenomas de hipófise, adenomas de pâncreas endócrino e adenocarcinomas de glândulas mamárias. Um aumento de tumores mamários, hipofisários e de pâncreas endócrino foi encontrado em roedores após a administração crônica de outros antipsicóticos e é considerado como sendo mediado pelo antagonismo prolongado de dopamina D2. A relevância desses achados de tumores em roedores é desconhecida, em termos de risco para os seres humanos.
Mutagenicidade
Não foi encontrada evidência de potencial mutagênico para a paliperidona no teste de mutação reversa de Ames, no teste de linfoma de camundongo ou no teste de micronúcleo de rato.
Prejuízo da fertilidade
Embora o tratamento com a paliperidona tenha resultado em efeitos mediados pela prolactina e pelo sistema nervoso central, a fertilidade de ratos machos e fêmeas não foi afetada. Em uma dose materna tóxica, as fêmeas de ratos apresentaram um número ligeiramente menor de embriões vivos.
Qual a ação da substância do Paliperidona?
Resultados de eficácia
Esquizofrenia Adultos
A eficácia de Paliperidona foi estabelecida em 3 estudos clínicos controlados com placebo e com ativo (olanzapina), duplo-cegos, de 6 semanas de duração em pacientes que preenchiam os critérios estipulados pelo “Manual de Transtornos Mentais publicados pela “American Psychiatric Association (DSM-IV-TR)” para esquizofrenia.
O controle ativo foi incluído para fins de sensibilidade do teste. As doses de Paliperidona, que variaram entre os 3 estudos, foram de 3 a 15 mg uma vez ao dia.
A eficácia foi avaliada usando a Escala de Síndrome Positiva e Negativa (PANSS); o desfecho primário foi a redução nos escores totais da PANSS. Uma análise dos subgrupos populacionais não revelou qualquer evidência de resposta diferenciada em relação à idade, raça ou gênero.
Desfechos secundários também foram avaliados, incluindo a escala de Desempenho Pessoal e Social (Personal and Social Performance PSP) e escala de Impressão Clínica Global Gravidade (Clinical Global Impression – Severity: CGI-S). A escala PSP corresponde a um instrumento de avaliação clínica validado que mede quatro áreas de funcionamento pessoal e social (atividades sociais úteis incluindo trabalho, estudo, relacionamentos pessoais e sociais, cuidados pessoais, comportamento perturbado e agressivo).
A escala CGI-S corresponde a uma avaliação global de impressão clínica do investigador em relação à gravidade da doença. Em uma análise com dados agrupados (“pooled data”) destes três estudos, cada dose de Paliperidona apresentou-se de forma superior, ao ser comparado com o placebo em relação ao PSP e CGI-S. Em adição, o efeito em PSP mostrou-se distinto da melhora nos sintomas medidos como desfecho primário (PANSS total).
Em análise posterior da fase aberta de extensão destes três estudos, foi revelado que a dose flexível de Paliperidona (3 a 15 mg, dose diária), por mais de 52 semanas, estava associada com uma contínua melhora na escala PSP.
Em estudo de longo prazo, delineado para avaliar a manutenção de efeito, Paliperidona apresentou-se de maneira significativamente mais eficaz que o placebo para a manutenção do controle dos sintomas e retardando a recorrência da esquizofrenia.
Neste estudo, adultos que preencheram os critérios estabelecidos pela DSM-IV para esquizofrenia e que permaneceram clinicamente estáveis por meio de doses determinadas de Paliperidona, durante um período de 8 semanas de tratamento aberto (doses entre 3 e 15 mg uma vez ao dia), depois de receberem um tratamento para um episódio agudo para as 06 semanas prévias com Paliperidona (doses entre 3 a15 mg uma vez ao dia), foram então aleatoriamente alocados de forma duplo-cega para continuar com Paliperidona, em dose estável, ou placebo, até que fossem observados sintomas de recorrência da esquizofrenia.
O estudo foi interrompido precocemente por motivos de eficácia, quando se atingiram critérios pré-definidos.
Com base em uma análise interna foi demonstrado um tempo significativamente maior para a recorrência em pacientes tratados com Paliperidona, comparados ao placebo (p=0,0053). Baseado em uma análise final e considerando os pacientes incluídos após o ponto de corte utilizado para análise interina, a taxa de eventos recorrentes foi de 22,1% no grupo de Paliperidona, comparada à taxa de 51,5% apresentada pelo grupo placebo.
Uma significativa melhora nos sintomas foi alcançada ao final da fase aberta em estabilização (decréscimo em valores totais em PANSS de 38 pontos, com desvio padrão de ± 16,03); entretanto, após a alocação aleatória para tratamento duplo-cego, os pacientes recebendo placebo deterioraram significativamente mais que pacientes recebendo Paliperidona (p<0,001). Paliperidona também foi significativamente mais efetivo que o placebo na manutenção de desempenho pessoal e social. Durante a fase duplo-cega deste estudo, de acordo com a medida da escala CGI-S, houve uma piora da gravidade total da psicose no grupo placebo, enquanto pacientes tratados com Paliperidona permaneceram clinicamente estáveis.
A redução do risco absoluto (RRA) e número necessário para tratar (NNT), necessários para promover melhora ≥30% no escore total da escala PANSS em 03 estudos clínicos fase III comparativos com placebo (SCH-303 / SCH-304 / SCH-305) são apresentados na tabela abaixo:
 % Resposta: porcentagem de pacientes com melhora de ≥30% no escore total da escala PANSS, da linha de base ao ponto final.
% Resposta: porcentagem de pacientes com melhora de ≥30% no escore total da escala PANSS, da linha de base ao ponto final.
RRA: Redução do Risco Absoluto diferença entre a proporção de pacientes respondendo à paliperidona de liberação prolongada e placebo.
NNT: Número Necessário para Tratar: 1/RRA número de pacientes que necessitariam ser tratados para obter um desfecho positivo adicional que não ocorreria caso o paciente tivesse recebido placebo.
IC: Intervalo de Confiança.
Em resumo, a eficácia e a segurança de Paliperidona foram demonstradas em 03 estudos de fase III, com 06 semanas de duração.
A eficácia de PaliperidonaM na manutenção da estabilidade clínica foi comprovada por um período de até 11 meses. Isto foi demonstrado em um estudo para avaliar a recorrência de sintomas em pacientes com esquizofrenia clinicamente estáveis por um período de 08 semanas.
Esquizofrenia Adolescentes
A eficácia de Paliperidona em pacientes adolescentes com esquizofrenia foi estabelecida em um ensaio clínico randomizado, duplo-cego, em grupos paralelos, controlado por placebo, com duração de 6 semanas e desenho de grupo de tratamento com dose fixa baseado no peso corporal, na faixa de dose de 1,5 a 12 mg/dia.
Os pacientes tinham de 12 a 17 anos de idade e preenchiam os critérios estipulados pelo “Manual de Transtornos Mentais publicados pela “American Psychiatric Association (DSM-IV-TR)” para esquizofrenia, com confirmação do diagnóstico utilizando o questionário “Kiddie Schedule for Affective Disorders and Schizophrenia Present and Lifetime Version (K-SADS-PL)”.
Pacientes elegíveis foram aleatoriamente alocados para 1 dos 4 grupos de tratamento
Um grupo placebo ou grupos de dose baixa, média ou alta de Paliperidona. As doses foram administradas baseando-se no peso corporal para minimizar o risco de exposição de adolescentes com menor peso a doses mais elevadas de Paliperidona.
Pacientes com peso entre 29 kg e 51 kg na linha de base da visita foram aleatoriamente alocados para receber placebo ou 1,5 mg (dose baixa), 3 mg (dose média), ou 6 mg (dose alta) de Paliperidona diariamente, e os pacientes pesando pelo menos 51 kg na linha de base da visita foram aleatoriamente alocados para receber placebo ou 1,5 mg (dose baixa), 6 mg (dose média), ou 12 mg (dose alta) de Paliperidona diariamente.
A dose foi administrada pela manhã, independentemente das refeições.
A eficácia foi avaliada usando PANSS. Este estudo demonstrou a eficácia de Paliperidona em pacientes adolescentes com esquizofrenia, quando administrado em doses diárias de 3, 6 e 12 mg em grupos de tratamento baseados no peso corporal.
A dose mínima efetiva para Paliperidona nesta população foi de 3 mg/dia.
Transtorno esquizoafetivo
A eficácia de Paliperidona (3 mg a 12 mg uma vez ao dia) no tratamento de transtorno esquizoafetivo foi estabelecida em 2 estudos controlados por placebo com duração de 6 semanas em pacientes não-idosos que preencheram os critérios DSM-IV para o transtorno esquizoafetivo, confirmado pela Entrevista Clínica Estruturada paraTranstornos do DSM-IV.
Em um destes estudos, a eficácia foi avaliada em 203 pacientes que foram atribuídos a um dos dois níveis de dose de Paliperidona
6 mg com a opção de reduzir para 3 mg (n = 105) ou 12 mg com a opção de reduzir para 9 mg (n = 98) uma vez ao dia. No outro estudo, a eficácia foi avaliada em 211 pacientes que receberam doses flexíveis de Paliperidona (3 – 12 uma vez ao dia).
Ambos os estudos incluíram pacientes que receberam Paliperidona em monoterapia ou em combinação com antidepressivos e/ou estabilizadores de humor.
A dose foi administrada pela manhã, independentemente das refeições. Os estudos foram realizados nos Estados Unidos, Europa Oriental, Rússia e Ásia.
A eficácia foi avaliada utilizando a Escala da Síndrome Positiva e Negativa (PANSS), um inventário validado de múltiplos itens composto por 5 fatores para avaliar os sintomas positivos, sintomas negativos, pensamentos desorganizados, hostilidade descontrolada / excitação e ansiedade / depressão.
O grupo de doses elevadas de Paliperidona em estudo de 2 níveis de dose (12 mg/dia com opção de reduzir para 9 mg/dia) e o grupo Paliperidona em estudo de dose flexível (doses entre 3 e 12 mg/dia, dose média modal de 8,6 mg/dia) cada um era superior ao placebo no PANSS.
No grupo de dose mais baixa do estudo de 2 níveis de dose (6 mg/dia com opção de reduzir para 3 mg/dia), Paliperidona não era significativamente diferente do placebo como avaliado pela PANSS.
Avaliando os resultados de ambos os estudos em conjunto, Paliperidona melhorou os sintomas do transtorno esquizoafetivo na avaliação final em relação ao placebo quando administrado em monoterapia ou em combinação com antidepressivos e/ou estabilizadores de humor.
Uma análise dos subgrupos da população não revelou nenhuma evidência de sensibilidade diferencial com base no sexo, idade ou região geográfica. Não havia dados suficientes para explorar os efeitos diferenciais baseados na raça.
Características farmacológicas
Propriedades Farmacodinâmicas
Mecanismo de ação
A paliperidona é um antagonista de ação central de receptores D2 da dopamina, com atividade antagonista serotonérgica 5-HT2A predominante. A paliperidona também é ativa como um antagonista em receptores adrenérgicos alfa-1 e alfa-2 e histaminérgicos H1.
A paliperidona não tem afinidade para receptores colinérgicos muscarínicos ou adrenérgicos beta-1 e beta-2. A atividade farmacológica dos enantiômeros (+) e (-) da paliperidona é similar, tanto qualitativamente como quantitativamente.
O mecanismo de ação da paliperidona, como outros fármacos eficazes em esquizofrenia, é desconhecido. No entanto, foi proposto que a atividade terapêutica do fármaco em esquizofrenia é mediada através da combinação de antagonismo em receptores tipo 2 (5HT2A) de serotonina e tipo 2 (D2) de dopamina.
O antagonismo em outros receptores além do D2 e 5HT2A pode explicar alguns dos outros efeitos da paliperidona.
O tempo médio estimado para o início da ação terapêutica do medicamento é de 4 a 8 dias.
Polisonografia
Medicamentos com ação central através de seu mecanismo de ação, perfil de liberação e/ou tempo da administração da dose podem afetar o sono. Para avaliar o impacto da dose matinal de Paliperidona sobre a arquitetura e a continuidade do sono, foi conduzido um estudo controlado com placebo em 36 pacientes com esquizofrenia onde 9 mg de Paliperidona ou placebo foram administrados uma vez ao dia por 14 dias.
As seguintes observações foram feitas (dados médios em comparação ao placebo) redução de 41,0 (EP 18,70) minutos na latência para sono persistente, diminuição de 35,2 (EP 14,99) minutos na latência para início do sono, redução de 7,0 (EP 3,88) eventos no número de vezes de despertar após o início do sono, aumento do tempo total de sono em 52,8 (SE 24,01) minutos, aumento do período de sono em 41,7 (SE 18,75) minutos e aumento do índice de eficiência do sono em 11,0% (SE 5,00).
Houve também uma redução estatisticamente significativa (em relação ao placebo) no estágio 1 do sono de 11,9 (SE 4,44) minutos e aumento no estágio 2 do sono de 50,7 (SE 17,67) minutos. Não foi observado efeito clinicamente relevante sobre o sono REM.
Efeito no intervalo QT/QTc e na eletrofisiologia cardíaca
Os efeitos da paliperidona sobre o intervalo QT foram avaliados em dois estudos de fase I, randomizados, duplocegos e multicêntricos, em adultos com esquizofrenia e transtorno esquizoafetivo e em 3 estudos de eficácia, de dose fixa, controlados com placebo e com controle ativo de 6 semanas de duração em adultos com esquizofrenia.
No primeiro estudo de fase I (n=141), pacientes foram randomizados para receber igualmente 7 dias de paliperidona oral de liberação imediata uma vez ao dia (com titulação de 4 a 8 mg) ou uma dose única de moxifloxacino (400mg).
A dose de 8 mg uma vez ao dia de paliperidona oral de liberação imediata (n=44) atingiu uma concentração plasmática média no estado de equilíbrio mais de 2 vezes maior que a exposição observada com dose máxima recomendada de 12 mg de Paliperidona (Cmáx ss= 113 e 45 ng/mL, respectivamente).
No modelo de correção “linear-derived QT correction” (QTcLD), houve um aumento médio de 5,5 mseg (90% IC: 3,66; 7,25) no grupo de tratamento com Paliperidona (n=44).
No segundo estudo de fase I (n=109), os pacientes foram randomizados para receber igualmente placebo, ou a dose máxima recomendada de Paliperidona (12 mg uma vez ao dia), subsequentemente titulado a uma dose acima da faixa recomendada (18 mg uma vez ao dia), ou um controle ativo da mesma classe farmacológica de medicamento (400 mg de quetiapina 2 vezes ao dia).
A comparação primária neste estudo de não inferioridade de 10 dias foi entre Paliperidona 12 mg e quetiapina. A média dos mínimos quadrados da condição basal QTcLD a cada um dos tmáx individuais observados foi estimada para ser 5,1 ms menor para Paliperidona 12 mg (Cmáx média 34 ng/mL) comparado com 400 mg de quetiapina 2 vezes ao dia (Cmáx média 1183 ng/mL) (IC 90%: -9,2; -0,9), encontrando o critério de não inferioridade pré-especificado de 10 ms.
A alteração média da condição basal em QTcLD para cada um dos tmáx individuais observados foi estimada para ser 2,3 ms menor para Paliperidona 18 mg (Cmáx média 53 ng/mL) comparado com 400 mg de quetiapina 2 vezes ao dia (Cmáx média 1183 ng/mL) (IC 90%: -6,8; 2,3).
A alteração média da condição basal em QTcLD para cada tmáx individual observado foi estimada para 1,5 ms maior (IC 90%: -3,3; 6,2) para Paliperidona 12 mg e 8,0 ms maior (IC 90%: 3,1; 12,9) para 400 mg de quetiapina 2 vezes ao dia comparado com alteração média da condição basal em QTcLD em um tmáx mediano observado (da droga ativa na comparação) no braço placebo concorrente.
A alteração média da condição basal em QTcLD para cada tmáx individual observado foi estimada para ser 4,9 ms maior (IC 90%: -0,05; 10,3) para paliperidona de liberação prolongada 18 mg e 7,5 ms maior (IC 90%: 2,5; 12,5) para quetiapina 400 mg duas vezes ao dia comparado com a alteração média da condição basal em QTcLD no tmáx mediano observado (da droga ativa na comparação) no braço placebo concorrente.
Nenhum dos pacientes tiveram mudanças da condição basal excedendo 60 mseg ou um QTcLD excedendo 500 mseg durante o tempo de duração de qualquer destes estudos.
Para os 3 estudos de eficácia de dose fixa, medidas eletrocardiográficas extensas foram coletadas em 15 tempos de avaliação em dias determinados (incluindo os tempos de Cmáx esperada), usando metodologia padronizada.
O aumento médio do QTcLD não excedeu 5 mseg em nenhum grupo de tratamento em nenhum tempo de avaliação, com base nos dados agrupados de 836 pacientes tratados com Paliperidona, 357 pacientes tratados com olanzapina e 350 pacientes tratados com placebo.
Um paciente no grupo Paliperidona 12 mg e um paciente no grupo olanzapina tiveram uma mudança que excedeu 60 mseg em um tempo de análise durante esses estudos (aumentos de 62 mseg e 110 mseg, respectivamente).
Propriedades Farmacocinéticas
As informações farmacocinéticas apresentadas a seguir são baseadas em dados de estudos em adultos, com exceção dos casos especificados.
A farmacocinética da paliperidona após a administração de Paliperidona, cuja forma farmacêutica corresponde à de comprimido revestido de liberação prolongada (OROS Push-Pull, tecnologia desenvolvida pela Alza Corporation) é proporcional à dose dentro do intervalo recomendado (3 a 12 mg).
Absorção
Após uma dose única de Paliperidona, as concentrações plasmáticas de paliperidona sobem constantemente até atingir o pico de concentração plasmática (Cmáx) em aproximadamente 24 horas após a administração. Com a administração de Paliperidona uma vez ao dia, as concentrações do estado de equilíbrio da paliperidona são atingidas em 4-5 dias na maioria dos indivíduos.
As características de liberação de Paliperidona resultam em flutuações mínimas do pico e de vale em comparação àquelas observadas com a risperidona de liberação imediata.
Em um estudo comparando a farmacocinética no estado de equilíbrio após a administração de 12 mg de paliperidona (comprimidos de liberação prolongada), uma vez ao dia, com 4 mg de risperidona de liberação imediata em pacientes com esquizofrenia, os índices de flutuação foram 38% para a paliperidona de liberação prolongada em comparação a 125% para a risperidona de liberação imediata.
Figura 1: Perfil de concentração no estado de equilíbrio após a administração de 12 mg de paliperidona (6 comprimidos de liberação prolongada de 2 mg, uma vez ao dia) por 6 dias (as concentrações de paliperidona estão representadas) em comparação a risperidona de liberação imediata administrada como 2 mg uma vez ao dia no Dia 1 e 4 mg uma vez ao dia nos Dias 2 a 6 (as concentrações de paliperidona+risperidona estão representadas):

Após a administração de Paliperidona os enantiômeros (+) e (-) da paliperidona se interconvertem, alcançando uma razão de AUC (+) para (-) de aproximadamente 1,6 no estado de equilíbrio. A biodisponibilidade oral absoluta da paliperidona após a administração de Paliperidona é 28%.
Após a administração de um único comprimido de liberação prolongada de paliperidona a voluntários sadios, confinados ao leito por 36 horas, com refeição padrão com alto teor calórico/de gordura, a Cmáx e a AUC aumentaram em 42% e 46%, respectivamente, em comparação com a administração em condição de jejum.
Em outro estudo envolvendo voluntários sadios, após administração de um único comprimido de 12 mg em conjunto com uma refeição padronizada contendo elevado conteúdo de gordura e calorias, foram observados aumentos de 60% e 54% de Cmáx e AUC de paliperidona, respectivamente, comparados à administração em condições de jejum. Embora a presença ou ausência de alimentos no tempo de administração de Paliperidona possam aumentar ou diminuir a exposição à paliperidona, estas alterações não foram consideradas clinicamente relevantes.
Os estudos clínicos que estabeleceram a eficácia e a segurança de Paliperidona foram realizados sem relação com o tempo das refeições.
Distribuição
A paliperidona é rapidamente distribuída. O volume aparente de distribuição é 478 L. A ligação da paliperidona às proteínas plasmáticas é de 74%. Ela liga-se, principalmente, à glicoproteína alfa-1 ácida e à albumina.
Em condições in vitro, concentrações terapêuticas altas de diazepam (3 mcg/mL), sulfametazina (100 mcg/mL), varfarina (10 mcg/mL) e carbamazepina (10 mcg/mL) causaram um pequeno aumento na fração livre de paliperidona em 50 ng/mL. Não é esperado que essas mudanças tenham significância clínica.
Metabolismo e eliminação
Uma semana após a administração de uma dose oral única de 1 mg de 14C-paliperidona de liberação imediata, 59% da dose foi excretada inalterada na urina, indicando que a paliperidona não é extensivamente metabolizada no fígado. Aproximadamente 80% da radioatividade administrada foi recuperada na urina e 11% nas fezes.
Quatro vias metabólicas foram identificadas in vivo, nenhuma das quais representou mais de 6,5% da dose: desalquilação, hidroxilação, desidrogenação e cisão de benzisoxazol. Embora estudos in vivo tenham sugerido um papel para a CYP2D6 e a CYP3A4 no metabolismo da paliperidona, não há evidência in vivo de que essas isoenzimas representem um papel significativo no metabolismo da paliperidona.
Apesar da ampla variação na população em geral com relação à capacidade de metabolizar substratos de CYP2D6, as análises da farmacocinética da população não indicaram diferença perceptível na depuração aparente de paliperidona após a administração de Paliperidona entre metabolizadores rápidos e lentos de substratos de CYP2D6.
Estudos in vitro usando preparados de microssomas de sistemas heterólogos indicam que as CYP1A2, CYP2A6, CYP2C9, CYP2C19 e CYP3A5 não estão envolvidas no metabolismo da paliperidona. A meia-vida terminal de eliminação da paliperidona é cerca de 23 horas.
Insuficiência hepática
A paliperidona não é extensivamente metabolizada pelo fígado. Em um estudo em pacientes com insuficiência hepática moderada (Child-Pugh classe B), as concentrações plasmáticas da paliperidona livre foram similares àquelas em indivíduos sadios. A paliperidona não foi estudada em pacientes com insuficiência hepática grave.
Insuficiência renal
A dose deve ser reduzida em pacientes com insuficiência renal moderada e grave. A disposição da paliperidona foi estudada em pacientes com graus variáveis de insuficiência renal. A eliminação da paliperidona diminuiu com a diminuição da depuração da creatinina (DC).
A depuração total da paliperidona foi reduzida em pacientes com insuficiência renal
em 32% nos casos leves (DC = 50 a < 80 mL/min), 64% nos casos moderados (DC = 30 a < 50 mL/min) e 71% nos casos graves (DC = 10 a < 30 mL/min). A meia-vida de eliminação terminal da paliperidona foi 24, 40 e 51 horas em pacientes com insuficiência renal leve, moderada e grave, respectivamente, em comparação a 23 horas em indivíduos com a função renal normal (DC ≥ 80 mL/min).
Adolescentes
A exposição sistêmica à paliperidona em pacientes adolescentes foi comparável à exposição em adultos.
Em adolescentes com peso < 51 kg foi observada uma exposição 23% maior do que em adolescentes com peso ≥ 51 kg; este aumento não foi considerado clinicamente significativo. A idade, por si só, não influenciou na exposição à paliperidona.
Idosos
Os dados de um estudo de farmacocinética em indivíduos idosos (≥65 anos de idade, n=26) indicaram que a depuração aparente da paliperidona, no estado de equilíbrio após a administração de Paliperidona, foi 20% menor em comparação a indivíduos adultos (18-45 anos de idade, n=28).
No entanto, não houve efeito perceptível da idade na análise da farmacocinética da população envolvendo pacientes com esquizofrenia após a correção das reduções na depuração da creatinina relacionadas à idade.
Raça
Não é recomendado ajuste de dose com base na raça. A análise farmacocinética populacional não revelou evidências de diferenças relacionadas à raça na farmacocinética da paliperidona seguindo a administração de Paliperidona.
Em um estudo farmacocinético conduzido em japoneses e caucasianos não foram observadas diferenças na farmacocinética.
Sexo
A depuração aparente da paliperidona após a administração de Paliperidona é aproximadamente 19% menor em mulheres que em homens.
Essa diferença é amplamente explicada pelas diferenças na massa muscular corporal e na depuração da creatinina entre homens e mulheres, pois uma avaliação da farmacocinética da população não revelou evidência de diferenças clinicamente significativas relacionadas ao sexo na farmacocinética da paliperidona após a administração de Paliperidona, após correção para a massa muscular e a depuração de creatinina.
Tabagismo
Com base nos estudos in vitro utilizando enzimas hepáticas humanas, a paliperidona não é um substrato para a CYP1A2, portanto, o tabagismo, não deve afetar a farmacocinética da paliperidona.
Uma análise farmacocinética da população demonstrou haver uma exposição à paliperidona ligeiramente menor em fumantes do que em não-fumantes. No entanto, é improvável que esta diferença possua relevância clínica.
Dados de segurança pré-clinica
Toxicologia
Da mesma forma que outros fármacos antagonistas de receptores dopamina D2, a paliperidona elevou os níveis de prolactina sérica em estudos de toxicidade de dose repetida.
Em um estudo de toxicidade juvenil com 7 semanas de duração e doses orais de paliperdona de 0,16; 0,63 e 2,5 mg/dia, que correspondem, respectivamente, a 0,12; 0,5 e 1,8 vezes a dose máxima humana (12 mg/dia) recomendada para adolescentes em mg/m2, não foram observados efeitos no crescimento, maturidade sexual e desempenho reprodutivo.
Doses de até 2,5 mg/kg/dia não prejudicaram o desenvolvimento neurocomportamental em machos e fêmeas, exceto pelo efeito sobre a aprendizagem e memória em ratas fêmeas tratadas com 2,5 mg/kg/dia. Este efeito não foi observado após a descontinuação do tratamento.
Em um estudo com duração de 40 semanas em cães jovens tratados com ripseridona oral (que é extensivamente convertida a paliperidona) em doses de 0,31, 1,25, e 5 mg/kg/dia, a maturidade sexual não foi adversamente afetada com 0,31 e 1,25 mg/kg/dia. O crescimento de ossos longos não foi afetado com 0,31 mg/kg/dia; efeitos foram observados com 1,25 e 5 mg/kg/dia.
Carcinogenicidade
O potencial carcinogênico da paliperidona foi avaliado com base em estudos com a risperidona conduzidos em camundongos e ratos, uma vez que a paliperidona corresponde a um metabólito ativo da risperidona. A risperidona foi administrada em doses de até 10 mg/kg/dia por 18 meses em camundongos e 25 meses em ratos.
Houve aumentos estatisticamente significativos de adenomas de hipófise, adenomas de pâncreas endócrino e adenocarcinomas de glândulas mamárias. Um aumento de tumores mamários, hipofisários e de pâncreas endócrino foi encontrado em roedores após a administração crônica de outros antipsicóticos e é considerado como sendo mediado pelo antagonismo prolongado de dopamina D2. A relevância desses achados de tumores em roedores é desconhecida, em termos de risco para os seres humanos.
Mutagenicidade
Não foi encontrada evidência de potencial mutagênico para a paliperidona no teste de mutação reversa de Ames, no teste de linfoma de camundongo ou no teste de micronúcleo de rato.
Prejuízo da fertilidade
Embora o tratamento com a paliperidona tenha resultado em efeitos mediados pela prolactina e pelo sistema nervoso central, a fertilidade de ratos machos e fêmeas não foi afetada. Em uma dose materna tóxica, as fêmeas de ratos apresentaram um número ligeiramente menor de embriões vivos.
Doenças relacionadas
O conteúdo desta bula foi extraído manualmente da bula original, sob supervisão técnica do(a) farmacêutica responsável: Karime Halmenschlager Sleiman (CRF- PR 39421). Última atualização: 18 de Março de 2025.