Bio-Manguinhos Adalimumabe
Selecione a variação do produto
Bio-Manguinhos Adalimumabe 50mg/mL, caixa com 1 frasco-ampola com 0,8mL de solução de uso subcutâneo + 2 lenços + 1 seringa + 1 agulha + 1 adaptador
- Adalimumabe
Branca Comum (Venda Sob Prescrição Médica)
De 2 a 8°C
Não pode ser partido
Bula do Bio-Manguinhos Adalimumabe
Bio-Manguinhos Adalimumabe, para o que é indicado e para o que serve?
Este medicamento é destinado ao tratamento de:
Adultos
Artrite Reumatoide
Bio-Manguinhos Adalimumabe (adalimumabe) é destinado para reduzir os sinais e sintomas, induzir uma resposta clínica e remissão clínica maior, inibir a progressão dos danos estruturais e melhorar a capacidade física em pacientes adultos com artrite reumatoide ativa de intensidade moderada a grave que apresentaram resposta inadequada a uma ou mais drogas antirreumáticas modificadoras do curso da doença (DMARD).
Bio-Manguinhos Adalimumabe (adalimumabe) é destinado ao tratamento da artrite reumatoide grave, ativa e progressiva em pacientes não tratados com metotrexato previamente.
Bio-Manguinhos Adalimumabe (adalimumabe) pode ser utilizado isoladamente ou em combinação com metotrexato ou outra DMARD.
Artrite Psoriásica
Bio-Manguinhos Adalimumabe (adalimumabe) é destinado para reduzir os sinais e sintomas da artrite psoriásica. Bio-Manguinhos Adalimumabe (adalimumabe) pode ser utilizado isoladamente ou em combinação a drogas antirreumáticas modificadoras do curso da doença (DMARD).
Espondiloartrite Axial
Espondilite Anquilosante (EA)
Bio-Manguinhos Adalimumabe (adalimumabe) é destinado ao tratamento da espondilite anquilosante ativa em pacientes que responderam inadequadamente à terapia convencional.
Espondiloartrite axial não radiográfica (espondiloartrite axial sem evidência radiográfica de EA)
Bio-Manguinhos Adalimumabe (adalimumabe) é destinado ao tratamento de pacientes adultos com espondiloartrite axial grave sem evidência radiográfica de EA que possuam sinais objetivos de inflamação (PCR elevada e/ou ressonância magnética) e que responderam inadequadamente ou que sejam intolerantes aos medicamentos anti-inflamatórios não esteroidais.
Doença de Crohn
Bio-Manguinhos Adalimumabe (adalimumabe) é destinado para reduzir sinais e sintomas, induzir e manter a remissão clínica em pacientes adultos com Doença de Crohn ativa de intensidade moderada a grave que apresentaram resposta inadequada à terapia convencional.
Bio-Manguinhos Adalimumabe (adalimumabe) também é destinado para reduzir sinais e sintomas e induzir remissão clínica em pacientes que passaram a não responder ou que são intolerantes ao infliximabe.
Colite Ulcerativa ou Retocolite Ulcerativa
Bio-Manguinhos Adalimumabe (adalimumabe) é destinado ao tratamento da colite ulcerativa ou retocolite ulcerativa ativa moderada a grave em pacientes adultos que apresentaram uma resposta inadequada à terapia convencional incluindo corticosteroides e/ou 6-mercaptopurina (6- MP) ou azatioprina (AZA), ou em pacientes que são intolerantes ou apresentem contraindicação para estas terapias. Bio-Manguinhos Adalimumabe (adalimumabe) induz e mantém a cicatrização da mucosa nestes pacientes, reduz a hospitalização relacionada com a doença e suas causas e melhora a qualidade de vida. O uso de corticosteroide pode ser reduzido ou descontinuado.
Psoríase em placas
Bio-Manguinhos Adalimumabe (adalimumabe) é destinado ao tratamento de psoríase em placas crônica moderada a grave em pacientes adultos que têm indicação de terapia sistêmica.
Hidradenite Supurativa
Bio-Manguinhos Adalimumabe (adalimumabe) é destinado para reduzir os sinais e sintomas de hidradenite supurativa ativa moderada a grave em pacientes adultos, nos quais a terapia antibiótica foi inadequada, incluindo o tratamento de lesões inflamatórias e prevenção do agravamento de abscessos e fístulas.
Uveíte
Bio-Manguinhos Adalimumabe (adalimumabe) é destinado ao tratamento de uveíte não infecciosa intermediária, posterior ou pan-uveíte, em pacientes adultos que tenham resposta inadequada ao uso de corticosteroides, que necessitem de redução/retirada de corticosteroides (corticosteroid-sparing) ou nos pacientes nos quais o uso de corticosteroides é inapropriado.
Pediátricos
Artrite Idiopática Juvenil Poliarticular
Bio-Manguinhos Adalimumabe (adalimumabe), em combinação com metotrexato, é indicado para reduzir os sinais e sintomas da artrite idiopática juvenil poliarticular ativa moderada a grave em pacientes pediátricos acima de 02 anos de idade que apresentaram resposta inadequada a pelo menos um DMARD. Bio-Manguinhos Adalimumabe (adalimumabe) pode ser utilizado em monoterapia naqueles indivíduos intolerantes ao metotrexato ou quando o uso concomitante com metotrexato é inapropriado.
Artrite relacionada à Entesite
Bio-Manguinhos Adalimumabe (adalimumabe) é destinado ao tratamento de artrite relacionada à entesite em pacientes pediátricos acima de 06 anos que apresentaram uma resposta inadequada ou que são intolerantes à terapia convencional.
Doença de Crohn
Bio-Manguinhos Adalimumabe (adalimumabe) é destinado para reduzir sinais e sintomas e induzir e manter a remissão clínica em pacientes pediátricos a partir de 06 anos, com doença de Crohn ativa de intensidade moderada a grave, que apresentaram resposta inadequada à terapia convencional.
Colite Ulcerativa ou Retocolite Ulcerativa Pediátrica
Bio-Manguinhos Adalimumabe (adalimumabe) é indicado para o tratamento de colite ulcerativa ou retocolite ulcerativa ativa moderada a grave em pacientes pediátricos (a partir dos 6 anos de idade) que apresentaram resposta inadequada à terapia convencional, incluindo corticosteroides e/ou 6- mercaptopurina (6-MP) ou azatioprina (AZA), ou que são intolerantes ou têm contraindicações médicas para essas terapias.
Uveíte Pediátrica
Bio-Manguinhos Adalimumabe (adalimumabe) é destinado ao tratamento de uveíte não infecciosa, anterior, crônica em pacientes pediátricos com 02 anos de idade ou mais, que apresentaram uma resposta inadequada ou que são intolerantes à terapia convencional, ou quando a terapia convencional é inapropriada.
Como o Bio-Manguinhos Adalimumabe funciona?
Bio-Manguinhos Adalimumabe (adalimumabe) é um medicamento que diminui o processo inflamatório.
O princípio ativo de Bio-Manguinhos Adalimumabe (adalimumabe) é um anticorpo monoclonal totalmente humano, produzido através de cultura celular. Os anticorpos monoclonais são proteínas que reconhecem e se ligam especificamente a outras proteínas. Bio-Manguinhos Adalimumabe (adalimumabe) bloqueia uma proteína específica, o Fator de Necrose Tumoral Alfa ou TNF-α, que está presente em altos níveis em doenças inflamatórias como artrite reumatoide, artrite idiopática juvenil poliarticular, artrite psoriásica, espondilite anquilosante, espondiloartrite axial não radiográfica, doença de Crohn, colite ulcerativa ou retocolite ulcerativa, psoríase, hidradenite supurativa, uveíte e artrite relacionada à entesite.
O que é Artrite Reumatoide?
- Artrite reumatoide é uma doença inflamatória das articulações.
O que é Artrite Psoriásica?
- Artrite psoriásica é uma doença inflamatória das articulações associada com psoríase.
O que é Espondiloartrite Axial?
- Espondiloartrite axial (EpA axial) é um grupo de doenças que engloba a espondiloartrite axial não radiográfica (EpAax-nr) e a espondilite anquilosante (EA). Ocorre inflamação crônica de origem autoimunes preferencialmente na coluna vertebral e nas articulações da bacia. Na EpAax-nr há inflamação nesses locais sem alteração de EA na radiografia.
O que é Espondilite Anquilosante?
- Espondilite anquilosante é uma doença inflamatória da coluna vertebral com alteração na radiografia da bacia e coluna vertebral.
O que é Doença de Crohn?
- Doença de Crohn é uma doença inflamatória e crônica do trato gastrointestinal.
O que é Colite Ulcerativa ou Retocolite Ulcerativa?
- Colite ulcerativa ou retocolite ulcerativa é uma doença inflamatória e crônica do cólon e reto (intestino grosso).
O que é Psoríase em Placas?
- Psoríase é uma doença inflamatória da pele.
O que é Psoríase Ungueal?
- Psoríase ungueal é uma manifestação inflamatória e dolorosa da psoríase, que afeta as unhas dos dedos das mãos e/ou dos pés.
O que é Uveíte?
- Uveíte é uma doença inflamatória dos olhos, localizada no trato uveal, que é formado pela íris, corpo ciliar e a coroide (parte vascular do olho, situada próximo à retina).
O que é Artrite Idiopática Juvenil Poliarticular?
- Artrite idiopática juvenil poliarticular é uma doença inflamatória das articulações que ocorre em crianças.
O que é Hidradenite Supurativa?
- Hidradenite supurativa é uma doença inflamatória da pele que geralmente se manifesta com lesões dolorosas, profundas e inflamadas nas regiões axilar, inguinal e anogenital.
O que é Artrite relacionada à Entesite?
- Artrite relacionada à entesite é uma doença inflamatória das articulações, especificamente do ponto em que o tendão muscular se liga ao osso.
Bio-Manguinhos Adalimumabe (adalimumabe) é um medicamento de uso crônico e as concentrações farmacológicas são atingidas após a primeira dose.
Seu médico dará a orientação necessária com relação ao tempo médio estimado para o início da ação terapêutica do medicamento.
Quais as contraindicações do Bio-Manguinhos Adalimumabe?
Não use Bio-Manguinhos Adalimumabe (adalimumabe) se você for alérgico ao adalimumabe ou a qualquer outro componente da fórmula. Bio-Manguinhos Adalimumabe (adalimumabe) é contraindicado para uso em pacientes com tuberculose ativa ou outras infecções graves, nomeadamente sepse e infecções oportunistas. Bio-Manguinhos Adalimumabe (adalimumabe) é contraindicado para uso em pacientes com insuficiência cardíaca moderada a grave (classe III/IV da NYHA).
Como usar o Bio-Manguinhos Adalimumabe?
A aplicação de Bio-Manguinhos Adalimumabe (adalimumabe) pode ser feita pelo próprio paciente ou seu responsável se o médico considerar apropriado e sob orientação médica. Nesses casos, o paciente e/ou seu responsável devem receber treinamento adequado para o correto manuseio do produto no momento da aplicação. Bio-Manguinhos Adalimumabe (adalimumabe) deve ser injetado sob a pele (injeção subcutânea). Você pode aplicar Bio-Manguinhos Adalimumabe (adalimumabe) sozinho (autoaplicação) ou solicitar que outra pessoa que recebeu treinamento adequado ou seu médico aplique Bio-Manguinhos Adalimumabe (adalimumabe) para você. Você deverá utilizar Bio-Manguinhos Adalimumabe (adalimumabe) por todo o período indicado por seu médico.
As instruções presentes no final dessa bula explicam como
aplicar Bio-Manguinhos Adalimumabe (adalimumabe). Leia atentamente as instruções e siga-as passo a passo. Você deverá ser instruído por seu médico quanto à técnica correta de autoaplicação. Não aplique o medicamento até que você tenha segurança de que compreendeu corretamente as instruções. Os locais da autoaplicação são as coxas ou abdômen. Os locais de injeção devem ser alternados a cada aplicação. As novas injeções nunca devem ser administradas em áreas onde a pele estiver sensível, ferida, avermelhada ou áspera.
Este medicamento não deve ser misturado a outros medicamentos na mesma seringa.
A solução injetável deve ser inspecionada visualmente para verificar a presença de partículas ou alterações de coloração antes de ser administrada. Se partículas ou alteração de coloração forem observadas, o produto não deve ser utilizado. Bio-Manguinhos Adalimumabe (adalimumabe) não contém conservantes e, portanto, o material não utilizado que permanecer na seringa e/ou frasco-ampola deve ser adequadamente descartado.
Instruções para preparo e administração de Bio-Manguinhos Adalimumabe (adalimumabe) em seringa pronta para uso e frasco-ampola devem ser verificados no começo desse campo.
Posologia do Bio-Manguinhos Adalimumabe
Bio-Manguinhos Adalimumabe (adalimumabe) é um medicamento de uso crônico e a duração do tratamento será de acordo com cada paciente. O seu médico indicará a duração do tratamento. O limite máximo diário de administração de Bio-Manguinhos Adalimumabe (adalimumabe) não foi determinado em humanos.
O modelo populacional de farmacocinética e farmacocinética/farmacodinâmica utilizado previram exposição e eficácia comparáveis do adalimumabe em pacientes tratados com 80 mg a cada duas semanas, em comparação com 40 mg a cada semana (incluindo pacientes adultos com artrite reumatoide, hidradenite supurativa, colite ulcerativa, doença de crohn e psoríase em placas e pacientes pediátricos com peso ≥ 40 kg com doença de crohn e colite ulcerativa ou retocolite ulcerativa).
Adultos
Artrite Reumatoide
A dose recomendada de Bio-Manguinhos Adalimumabe (adalimumabe) para pacientes adultos é de 40 mg de solução injetável, administrados em dose única por via subcutânea, a cada 14 dias.
O tratamento com metotrexato, glicocorticoides, salicilatos, anti-inflamatórios não esteroidais, analgésicos ou outras drogas antirreumáticas modificadoras do curso da doença (DMARDs) pode ser mantido durante o tratamento com Bio-Manguinhos Adalimumabe (adalimumabe).
Alguns pacientes não tratados concomitantemente com metotrexato podem obter benefício adicional com o aumento da dose de Bio-Manguinhos Adalimumabe (adalimumabe) para 40 mg a cada 7 dias ou 80 mg a cada 14 dias por via subcutânea.
Os dados clínicos disponíveis para artrite reumatoide sugerem que a resposta clínica normalmente é alcançada dentro de 12 semanas de tratamento. A continuação da terapia deve ser cuidadosamente reconsiderada se um paciente não responder ao tratamento dentro deste período.
Artrite Psoriásica
A dose recomendada de Bio-Manguinhos Adalimumabe (adalimumabe) para pacientes adultos é de 40 mg de solução injetável, administrados em dose única por via subcutânea, a cada 14 dias.
O tratamento com metotrexato, glicocorticoides, salicilatos, anti-inflamatórios não esteroidais, analgésicos ou outras drogas antirreumáticas modificadoras do curso da doença (DMARDs) pode ser mantido durante o tratamento com Bio-Manguinhos Adalimumabe (adalimumabe).
Espondiloartrite Axial (Espondilite Anquilosante e Espondiloartrite Axial Não Radiográfica)
A dose recomendada de Bio-Manguinhos Adalimumabe (adalimumabe) para pacientes adultos é de 40 mg de solução injetável, administrados em dose única por via subcutânea, a cada 14 dias.
O tratamento com metotrexato, glicocorticoides, salicilatos, anti-inflamatórios não esteroidais, analgésicos ou outras drogas antirreumáticas modificadoras do curso da doença (DMARDs) pode ser mantido durante o tratamento com Bio-Manguinhos Adalimumabe (adalimumabe).
Os dados disponíveis sugerem que a resposta clínica é geralmente obtida após 12 semanas de tratamento.
A continuação do tratamento deve ser cuidadosamente considerada quando o paciente não responder durante este período de tempo.
Doença de Crohn
A dose recomendada de Bio-Manguinhos Adalimumabe (adalimumabe) para pacientes adultos com doença de Crohn é:
- Início do tratamento - Semana 0: 160 mg por via subcutânea (a dose pode ser administrada em quatro injeções de 40 mg em um dia ou duas injeções de 40 mg por dia por dois dias consecutivos);
- Semana 2: 80 mg por via subcutânea (a dose deve ser administrada em duas injeções de 40 mg no mesmo dia);
- Manutenção do tratamento: a partir da Semana 4, 40 mg de solução injetável a cada 14 dias por via subcutânea.
O tratamento com corticosteroides, aminosalicilatos e/ou agentes imunomoduladores (6- mercaptopurina e azatioprina) pode ser mantido durante o tratamento com Bio-Manguinhos Adalimumabe (adalimumabe).
Alguns pacientes que sofreram diminuição na resposta podem se beneficiar com um aumento da dose de Bio-Manguinhos Adalimumabe (adalimumabe) para 40 mg a cada 7 dias ou 80 mg a cada 14 dias por via subcutânea.
Os pacientes que não responderem ao tratamento até a Semana 4 podem continuar com a manutenção do tratamento até a Semana 12. Se não houver resposta neste período, a continuação da terapia deve ser cuidadosamente reconsiderada.
Durante a manutenção do tratamento, corticosteroides podem ser reduzidos em conformidade às diretrizes de prática clínica.
Colite Ulcerativa ou Retocolite Ulcerativa
A dose de indução recomendada de Bio-Manguinhos Adalimumabe (adalimumabe) para pacientes adultos com colite ulcerativa ou retocolite ulcerativa ativa moderada a grave é:
- Início do tratamento - Semana 0: 160 mg por via subcutânea (a dose pode ser administrada em quatro injeções de 40 mg em um dia ou duas injeções de 40 mg por dia por dois dias consecutivos);
- Semana 2: 80 mg por via subcutânea (a dose deve ser administrada em duas injeções de 40 mg no mesmo dia);
- Manutenção do tratamento: 40 mg a cada 14 dias por via subcutânea. O tratamento com aminosalicilatos, corticosteroides e/ou agentes imunomoduladores (6-mercaptopurina e azatioprina) pode ser mantido durante o tratamento com Bio-Manguinhos Adalimumabe (adalimumabe).
Durante a manutenção do tratamento, corticosteroides podem ser reduzidos em conformidade às diretrizes de prática clínica.
Alguns pacientes que sofreram diminuição na resposta podem se beneficiar com um aumento na frequência da dose de manutenção de Bio-Manguinhos Adalimumabe (adalimumabe) para 40 mg a cada 7 dias ou 80 mg a cada 14 dias por via subcutânea.
Dados disponíveis sugerem que a resposta clínica é normalmente alcançada entre 2 a 8 semanas de tratamento. Bio-Manguinhos Adalimumabe (adalimumabe) só deve ser mantido em pacientes que tiveram resposta nas primeiras 8 semanas de tratamento.
Psoríase em Placas
A dose inicial recomendada de Bio-Manguinhos Adalimumabe (adalimumabe) em pacientes adultos é de 80 mg administrada por via subcutânea, seguida de 40 mg em semanas alternadas, uma semana após a dose inicial.
Uma terapia continuada para além de 16 semanas, deve ser cuidadosamente reconsiderada em pacientes que não responderam dentro deste período de tempo.
Após 16 semanas de tratamento, os pacientes que não apresentarem uma resposta adequada podem se beneficiar de um aumento da dose para 40 mg a cada 7 dias ou 80 mg a cada 14 dias por via subcutânea.
Os benefícios e riscos do tratamento continuado com com 40 mg a cada 7 dias ou 80 mg a cada 14 dias de Bio-Manguinhos Adalimumabe (adalimumabe) deverão ser cuidadosamente considerados em pacientes com uma resposta inadequada após o aumento da dose. Se for obtida uma resposta adequada com o aumento da dose, esta pode ser reduzida, subsequentemente, para 40 mg a cada 14 dias por via subcutânea.
Hidradenite Supurativa
O esquema posológico recomendado de Bio-Manguinhos Adalimumabe (adalimumabe) para pacientes adultos com hidradenite supurativa (HS) é de 160 mg inicialmente, no Dia 1 (administrado em quatro injeções de 40 mg em um dia OU em duas injeções de 40 mg por dia durante dois dias consecutivos), seguida de 80 mg duas semanas depois, no Dia 15 (administrado em duas injeções de 40 mg em um dia). Duas semanas depois (Dia 29) continuar com uma dose de 40 mg a cada 7 dias ou 80 mg a cada 14 dias por via subcutânea.
Caso necessário, o uso de antibióticos pode ser continuado durante o tratamento com Bio-Manguinhos Adalimumabe (adalimumabe). No caso de interrupção do tratamento, Bio-Manguinhos Adalimumabe (adalimumabe) pode ser re-introduzido. Em pacientes sem qualquer benefício após 12 semanas de tratamento, a continuação da terapia deve ser reconsiderada.
Uveíte
A posologia recomendada de Bio-Manguinhos Adalimumabe (adalimumabe) para pacientes adultos com uveíte é de uma dose inicial de 80 mg, por via subcutânea (duas injeções de 40 mg), seguida de doses de 40 mg por via subcutânea administradas em semanas alternadas, começando na semana seguinte à dose inicial.
Bio-Manguinhos Adalimumabe (adalimumabe) pode ser administrado sozinho ou em combinação com corticoides, que podem ser ajustados pelo seu médico de acordo com as práticas clínicas, ou outros agentes imunomoduladores não biológicos.
Pediátricos
A apresentação seringa de Bio-Manguinhos Adalimumabe não deve ser administrada em pacientes pediátricos que requerem menos do que uma dose total de 40 mg.
Artrite Idiopática Juvenil Poliarticular
Pacientes entre 02 e 12 anos
A dose recomendada de Bio-Manguinhos Adalimumabe (adalimumabe) para pacientes com artrite idiopática juvenil poliarticular com idade entre 02 e 12 anos é de 24 mg/m2 de área de superfície corporal, até uma dose única máxima de 20 mg de adalimumabe para pacientes com idade entre 02 a < 04 anos e 40 mg de adalimumabe para pacientes entre 04 e 12 anos, administrados por via subcutânea a cada 14 dias. A apresentação em frasco-ampola está disponível para pacientes que necessitam de uma dose menor do que 40 mg.
Alternativamente, pacientes que requerem uma dose de 40 mg podem utilizar a apresentação em seringas preenchidas de Bio-Manguinhos Adalimumabe (adalimumabe).O volume da administração é selecionado baseando-se na altura e peso do paciente, conforme apresentado na tabela a seguir.
Dose de Bio-Manguinhos Adalimumabe (adalimumabe) por Altura e Peso de Pacientes com Artrite Idiopática Juvenil Poliarticular
| Altura (cm) | Peso Corporal Total (kg) | ||||||||||||
| 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 | 50 | 55 | 60 | 65 | 70 | |
| 80 | 0,2 mL (10 mg) | 0,3 mL (15 mg) | 0,3 mL (15 mg) | 0,3 mL (15 mg) | --- | --- | --- | --- | --- | --- | --- | --- | --- |
| 90 | 0,2 mL (10 mg) | 0,3 mL (15 mg) | 0,3 mL (15 mg) | 0,4 mL (20 mg) | 0,4 mL (20 mg) | 0,4 mL (20 mg) | --- | --- | --- | --- | --- | --- | --- |
| 100 | 0,3 mL (15 mg) | 0,3 mL (15 mg) | 0,3 mL (15 mg) | 0,4 mL (20 mg) | 0,4 mL (20 mg) | 0,4 mL (20 mg) | 0,5 mL (25 mg) | 0,5 mL (25 mg) | --- | --- | --- | --- | --- |
| 110 | 0,3 mL (15 mg) | 0,3 mL (15 mg) | 0,4 mL (20 mg) | 0,4 mL (20 mg) | 0,4 mL (20 mg) | 0,5 mL (25 mg) | 0,5 mL (25 mg) | 0,5 mL (25 mg) | 0,5 mL (25 mg) | 0,6 mL (30 mg) | 0,6 mL (30 mg) | --- | --- |
| 120 | 0,3 mL (15 mg) | 0,4 mL (20 mg) | 0,4 mL (20 mg) | 0,4 mL (20 mg) | 0,5 mL (25 mg) | 0,5 mL (25 mg) | 0,5 mL (25 mg) | 0,6 mL (30 mg) | 0,6 mL (30 mg) | 0,6 mL (30 mg) | 0,6 mL (30 mg) | 0,7 mL (35 mg) | 0,7 mL (35 mg) |
| 130 | --- | 0,4 mL (20 mg) | 0,4 mL (20 mg) | 0,5 mL (25 mg) | 0,5 mL (25 mg) | 0,5 mL (25 mg) | 0,6 mL (30 mg) | 0,6 mL (30 mg) | 0,6 mL (30 mg) | 0,6 mL (30 mg) | 0,7 mL (35 mg) | 0,7 mL (35 mg) | 0,7 mL (35 mg) |
| 140 | --- | 0,4 mL (20 mg) | 0,4 mL (20 mg) | 0,5 mL (25 mg) | 0,5 mL (25 mg) | 0,6 mL (30 mg) | 0,6 mL (30 mg) | 0,6 mL (30 mg) | 0,7 mL (35 mg) | 0,7 mL (35 mg) | 0,7 mL (35 mg) | 0,7 mL (35 mg) | 0,8 mL (40 mg)* |
| 150 | --- | --- | 0,5 mL (25 mg) | 0,5 mL (25 mg) | 0,6 mL (30 mg) | 0,6 mL (30 mg) | 0,6 mL (30 mg) | 0,7 mL (35 mg) | 0,7 mL (35 mg) | 0,7 mL (35 mg) | 0,7 mL (35 mg) | 0,8 mL (40 mg)* | 0,8 mL (40 mg)* |
| 160 | --- | --- | 0,5 mL (25 mg) | 0,5 mL (25 mg) | 0,6 mL (30 mg) | 0,6 mL (30 mg) | 0,7 mL (35 mg) | 0,7 mL (35 mg) | 0,7 mL (35 mg) | 0,8 mL (40 mg)* | 0,8 mL (40 mg)* | 0,8 mL (40 mg)* | 0,8 mL (40 mg)* |
| 170 | --- | --- | --- | 0,6 mL (30 mg) | 0,6 mL (30 mg) | 0,6 mL (30 mg) | 0,7 mL (35 mg) | 0,7 mL (35 mg) | 0,8 mL (40 mg)* | 0,8 mL (40 mg)* | 0,8 mL (40 mg)* | 0,8 mL (40 mg)* | 0,8 mL (40 mg)* |
| 180 | --- | --- | --- | --- | 0,6 mL (30 mg) | 0,7 mL (35 mg) | 0,7 mL (35 mg) | 0,8 mL (40 mg)* | 0,8 mL (40 mg)* | 0,8 mL (40 mg)* | 0,8 mL (40 mg)* | 0,8 mL (40 mg)* | 0,8 mL (40 mg)* |
*Dose única máxima é 40 mg (0,8 mL). Pacientes que requerem uma dose de 40 mg podem utilizar a apresentação em seringa preenchida de Bio-Manguinhos Adalimumabe.
Pacientes acima de 13 anos
O paciente adolescente com artrite idiopática juvenil poliarticular com idade superior a 13 anos deve utilizar as seringas preenchidas de Bio-Manguinhos Adalimumabe (adalimumabe).
A dose recomendada de Bio-Manguinhos Adalimumabe (adalimumabe) para esses adolescentes com idade superior a 13 anos é de 40 mg solução injetável, administrados em dose única por via subcutânea, a cada 14 dias, independente de sua superfície corporal.
Os dados disponíveis sugerem que a resposta clínica é geralmente alcançada com 12 semanas de tratamento.
A continuação do tratamento deve ser cuidadosamente reconsiderada em pacientes que não responderam dentro deste período de tempo.
Não há uso relevante de Bio-Manguinhos Adalimumabe (adalimumabe) em crianças menores de 02 anos de idade para esta indicação.
Artrite relacionada à Entesite
A dose recomendada de Bio-Manguinhos Adalimumabe (adalimumabe) para pacientes pediátricos acima de 06 anos com artrite relacionada à entesite é de 24 mg/m2 de solução injetável de área de superfície corporal até um máximo de 40 mg de adalimumabe, administrados em dose única por via subcutânea, a cada 14 dias. A apresentação em frasco-ampola está disponível para pacientes que necessitam de uma dose menor do que 40 mg. Pacientes que requerem uma dose de 40 mg podem utilizar a apresentação em seringas preenchidas ou caneta de Bio-Manguinhos Adalimumabe (adalimumabe). O volume por injeção é selecionado baseando-se na altura e peso do paciente para a apresentação em frasco-ampola (40 mg/0,8 mL), conforme tabela a seguir.
Dose de Bio-Manguinhos Adalimumabe (adalimumabe) por Altura e Peso em pacientes com Artrite relacionada à Entesite
| Altura (cm) | Peso Corporal Total (kg) | ||||||||||||
| 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 | 50 | 55 | 60 | 65 | 70 | |
| 80 | 0,2 mL (10 mg) | 0,3 mL (15 mg) | 0,3 mL (15 mg) | 0,3 mL (15 mg) | --- | --- | --- | --- | --- | --- | --- | --- | --- |
| 90 | 0,2 mL (10 mg) | 0,3 mL (15 mg) | 0,3 mL (15 mg) | 0,4 mL (20 mg) | 0,4 mL (20 mg) | 0,4 mL (20 mg) | --- | --- | --- | --- | --- | --- | --- |
| 100 | 0,3 mL (15 mg) | 0,3 mL (15 mg) | 0,3 mL (15 mg) | 0,4 mL (20 mg) | 0,4 mL (20 mg) | 0,4 mL (20 mg) | 0,5 mL (25 mg) | 0,5 mL (25 mg) | --- | --- | --- | --- | --- |
| 110 | 0,3 mL (15 mg) | 0,3 mL (15 mg) | 0,4 mL (20 mg) | 0,4 mL (20 mg) | 0,4 mL (20 mg) | 0,5 mL (25 mg) | 0,5 mL (25 mg) | 0,5 mL (25 mg) | 0,5 mL (25 mg) | 0,6 mL (30 mg) | 0,6 mL (30 mg) | --- | --- |
| 120 | 0,3 mL (15 mg) | 0,4 mL (20 mg) | 0,4 mL (20 mg) | 0,4 mL (20 mg) | 0,5 mL (25 mg) | 0,5 mL (25 mg) | 0,5 mL (25 mg) | 0,6 mL (30 mg) | 0,6 mL (30 mg) | 0,6 mL (30 mg) | 0,6 mL (30 mg) | 0,7 mL (35 mg) | 0,7 mL (35 mg) |
| 130 | --- | 0,4 mL (20 mg) | 0,4 mL (20 mg) | 0,5 mL (25 mg) | 0,5 mL (25 mg) | 0,5 mL (25 mg) | 0,6 mL (30 mg) | 0,6 mL (30 mg) | 0,6 mL (30 mg) | 0,6 mL (30 mg) | 0,7 mL (35 mg) | 0,7 mL (35 mg) | 0,7 mL (35 mg) |
| 140 | --- | 0,4 mL (20 mg) | 0,4 mL (20 mg) | 0,5 mL (25 mg) | 0,5 mL (25 mg) | 0,6 mL (30 mg) | 0,6 mL (30 mg) | 0,6 mL (30 mg) | 0,7 mL (35 mg) | 0,7 mL (35 mg) | 0,7 mL (35 mg) | 0,7 mL (35 mg) | 0,8 mL (40 mg)* |
| 150 | --- | --- | 0,5 mL (25 mg) | 0,5 mL (25 mg) | 0,6 mL (30 mg) | 0,6 mL (30 mg) | 0,6 mL (30 mg) | 0,7 mL (35 mg) | 0,7 mL (35 mg) | 0,7 mL (35 mg) | 0,7 mL (35 mg) | 0,8 mL (40 mg)* | 0,8 mL (40 mg)* |
| 160 | --- | --- | 0,5 mL (25 mg) | 0,5 mL (25 mg) | 0,6 mL (30 mg) | 0,6 mL (30 mg) | 0,7 mL (35 mg) | 0,7 mL (35 mg) | 0,7 mL (35 mg) | 0,8 mL (40 mg)* | 0,8 mL (40 mg)* | 0,8 mL (40 mg)* | 0,8 mL (40 mg)* |
| 170 | --- | --- | --- | 0,6 mL (30 mg) | 0,6 mL (30 mg) | 0,6 mL (30 mg) | 0,7 mL (35 mg) | 0,7 mL (35 mg) | 0,8 mL (40 mg)* | 0,8 mL (40 mg)* | 0,8 mL (40 mg)* | 0,8 mL (40 mg)* | 0,8 mL (40 mg)* |
| 180 | --- | --- | --- | --- | 0,6 mL (30 mg) | 0,7 mL (35 mg) | 0,7 mL (35 mg) | 0,8 mL (40 mg)* | 0,8 mL (40 mg)* | 0,8 mL (40 mg)* | 0,8 mL (40 mg)* | 0,8 mL (40 mg)* | 0,8 mL (40 mg)* |
*Dose única máxima é 40 mg (0,8 mL).Pacientes que requerem uma dose de 40 mg podem utilizar a apresentação em seringa preenchida de Bio-Manguinhos Adalimumabe.
Bio-Manguinhos Adalimumabe (adalimumabe) não foi estudado em crianças com artrite relacionada à entesite com idade menor que 6 anos.
O paciente pediátrico com atrite relacionada à entesite, cuja posologia for de 40 mg de adalimumabe deve utilizar a apresentação em seringas preenchidas de Bio-Manguinhos Adalimumabe (adalimumabe).
Doença de Crohn
O paciente pediátrico com doença de Crohn, cuja posologia for ≥ 40 mg de adalimumabe deve utilizar a apresentação em seringas preenchidas de Bio-Manguinhos Adalimumabe (adalimumabe).
A dose recomendada de Bio-Manguinhos Adalimumabe (adalimumabe) para pacientes pediátricos com 06 anos ou mais com doença de Crohn é:
Pacientes com peso corporal menor que 40 kg
A dose inicial (Dia 01) é 80 mg por via subcutânea (duas injeções de 40 mg em um dia), seguidas por 40 mg após duas semanas (Dia 15). A dose de manutenção inicia-se após duas semanas (Dia 29) conforme demonstrado a seguir.
- Para Doença de Crohn ativa com intensidade grave: 20 mg por via subcutânea, a cada 14 dias.
- Para Doença de Crohn ativa com intensidade moderada: 10 mg por via subcutânea, a cada 14 dias.
Pacientes com peso corporal maior ou igual à 40 kg
A dose inicial (Dia 01) é 160 mg por via subcutânea (quatro injeções de 40 mg em um dia ou duas injeções por dia por dois dias consecutivos), seguidas por 80 mg após duas semanas (Dia 15). A dose de manutenção inicia-se após duas semanas (Dia 29) conforme demonstrado a seguir.
- Para Doença de Crohn ativa com intensidade grave: 40 mg por via subcutânea, a cada 14 dias.
- Para Doença de Crohn ativa com intensidade moderada: 20 mg por via subcutânea, a cada 14 dias.
Alguns pacientes podem beneficiar-se com um aumento na frequência da dose de manutenção de Bio-Manguinhos Adalimumabe (adalimumabe) para uma dose por semana se houver um agravamento da doença ou para pacientes que obtiveram uma resposta inadequada durante a dose de manutenção.
Bio-Manguinhos Adalimumabe (adalimumabe) não foi estudado em crianças com doença de Crohn com idade menor que 06 anos.
Colite Ulcerativa ou Retocolite Ulcerativa Pediátrica
A dose recomendada de Bio-Manguinhos Adalimumabe (adalimumabe) para pacientes de 6 a 17 anos de idade com colite ulcerativa ou retocolite ulcerativa é baseada no peso corporal, conforme tabela a seguir.
Bio-Manguinhos Adalimumabe (adalimumabe) deve ser administrado por injeção subcutânea.
Dose de Bio-Manguinhos Adalimumabe (adalimumabe) em pacientes pediátricos com Colite Ulcerativa ou Retocolite Ulcerativa
| Peso do Paciente | Dose Inicial | Dose de Manutenção inicia-se na Semana 4 (Dia 29)* |
| < 40 kg | 80 mg - Dia 01 e 40 mg - Dia 15 |
40 mg, por via subcutânea, a cada 14 dias ou 20 mg, por via subcutânea, a cada 7 dias |
| ≥ 40 kg | 160 mg - Dia 01 80 mg - Dia 15 |
80 mg, por via subcutânea, a cada 14 dias ou 40 mg, por via subcutânea, a cada 7 dias |
*Pacientes pediátricos que completarem 18 anos de idade durante o tratamento com Bio-Manguinhos Adalimumabe (adalimumabe) devem continuar com a dose de manutenção prescrita.
Dados disponíveis sugerem que a resposta clínica é normalmente alcançada entre 2 a 8 semanas de tratamento. Bio-Manguinhos Adalimumabe (adalimumabe) só deve ser mantido em pacientes que tiveram resposta nas primeiras 8 semanas de tratamento.
Não existem dados clínicos relevantes de Bio-Manguinhos Adalimumabe (adalimumabe) em crianças com menos de 6 anos de idade nesta indicação.
Uveíte Pediátrica
A dose recomendada de Bio-Manguinhos Adalimumabe (adalimumabe) para pacientes com uveíte não infecciosa anterior crônica, com 2 anos de idade ou mais, baseia-se no peso, como é mostrado na tabela a seguir.
Bio-Manguinhos Adalimumabe (adalimumabe) deve ser administrado por injeção subcutânea. Bio-Manguinhos Adalimumabe (adalimumabe) pode ser disponibilizado em diferentes concentrações e/ou apresentações dependendo das necessidades de tratamentos individuais.
Na uveíte pediátrica, não existe experiência de utilização de Bio-Manguinhos Adalimumabe (adalimumabe) sem tratamento concomitante com metotrexato.
Dose de Bio-Manguinhos Adalimumabe (adalimumabe) para Pacientes Pediátricos com Uveíte
| Peso do Paciente | Dose |
| < 30 kg | 20 mg, por via subcutânea, a cada 14 dias em combinação com metotrexato |
| ≥ 30 kg | 40 mg, por via subcutânea, a cada 14 dias em combinação com metotrexato |
Quando se inicia o tratamento com Bio-Manguinhos Adalimumabe (adalimumabe), pode ser considerada a administração de uma dose de ataque de 40 mg para pacientes com menos de 30 kg ou 80 mg para pacientes com igual ou mais de 30 kg, uma semana antes do início do tratamento de manutenção.
Não existem dados clínicos relevantes sobre a utilização de uma dose de ataque de Bio-Manguinhos Adalimumabe (adalimumabe) em crianças < 6 anos de idade.
Não existem dados clínicos relevantes de Bio-Manguinhos Adalimumabe (adalimumabe) em crianças com menos de 02 anos de idade nesta indicação.
Recomenda-se que o risco benefício do tratamento continuado a longo prazo seja avaliado anualmente pelo médico especialista.
Siga a orientação do seu médico, respeitando sempre os horários, as doses e a duração do tratamento.
Não interrompa o tratamento sem o conhecimento do seu médico.
O que devo fazer quando me esquecer de usar o Bio-Manguinhos Adalimumabe?
Se você esquecer de tomar a injeção, aplique a próxima dose assim que se lembrar. A dose seguinte à dose esquecida deve ser aplicada seguindo o esquema original de administração (como se você não tivesse esquecido de uma dose).
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Quais cuidados devo ter ao usar o Bio-Manguinhos Adalimumabe?
Com o objetivo de melhorar a rastreabilidade de produtos biológicos, o nome comercial e o lote do medicamento utilizado devem ser registrados.
Infecções
Se você tiver alguma infecção, inclusive infecções crônicas ou localizadas, consulte seu médico antes de iniciar o tratamento com adalimumabe, pois o tratamento com este produto não deve ser iniciado em pacientes com infecções ativas até que sejam controladas. Em caso de dúvida, consulte seu médico. Durante o tratamento com adalimumabe, você pode adquirir infecções com mais facilidade. Informe seu médico o quanto antes se você apresentar sintomas como febre, ferimentos, cansaço excessivo ou problemas dentários. Como outros bloqueadores de TNF, infecções graves devido a bactérias, micobactérias, infecções fúngicas invasivas (histoplasmose disseminada ou extrapulmonar, aspergilose, coccidioidomicose), infecções virais [como pneumonia, pielonefrite (infecção do trato urinário), artrite séptica (doença infecciosa das articulações) e septicemia (infecção disseminada através da corrente sanguínea)], casos de tuberculose e infecções oportunistas [como candidíase (infecção causada pelo fungo Candida albicans), listeriose (infecção provocada pela bactéria Listeria monocytogenes), legionelose (forma de pneumonia atípica causada pela bactéria Legionella pneumophila) e pneumocistose (infecção causada pelo fungo Pneumocystis jiroveci)] foram relatados em pacientes tratados com adalimumabe. Foram relatados casos de tuberculose, incluindo reativação e nova manifestação de tuberculose, em pacientes recebendo Humira® (adalimumabe). Os relatos incluíram casos de tuberculose pulmonar e extrapulmonar (ou seja, disseminada). Seu médico verificará se você apresenta sinais ou sintomas de tuberculose antes do início do tratamento. Para isto, será necessário seu histórico médico, uma radiografia do tórax e teste de tuberculina (PPD). É muito importante que você diga a seu médico se você já teve tuberculose ou se você já teve ou tem contato muito próximo com alguém que tem ou já teve tuberculose. Se sintomas de tuberculose (tosse persistente, perda de peso, cansaço excessivo, febre, apatia) ou qualquer outra infecção aparecerem durante e após o tratamento com adalimumabe, avise seu médico imediatamente. Se a tuberculose ativa for diagnosticada, o tratamento com adalimumabe não deve ser iniciado. Se for diagnosticada tuberculose latente, antes que o tratamento com adalimumabe seja iniciado, deve-se iniciar a profilaxia antituberculose apropriada.
Avise seu médico se você apresentar histórico de infecções recorrentes ou outras condições que aumentem o risco de contrair uma infecção.
Outras Infecções Oportunistas
Infecções oportunistas, incluindo infecções fúngicas invasivas, foram observadas em pacientes que receberam adalimumabe. Pacientes que usam bloqueadores de TNF são mais suscetíveis a infecções fúngicas graves, tais como histoplasmose, coccidioidomicose, blastomicose, aspergilose, candidíase e outras infecções oportunistas. Caso você tenha febre, mal-estar, perda de peso, sudorese (suor excessivo), tosse, dispneia (falta de ar) e/ou infiltrados pulmonares, ou outras doenças sistêmicas graves, você deve imediatamente procurar o seu médico para uma avaliação diagnóstica. Para pacientes que residam ou viajem para regiões onde micoses são endêmicas, deve-se suspeitar de infecções fúngicas invasivas ao desenvolverem sinais e sintomas de possível infecção fúngica sistêmica. Pacientes que desenvolvem uma infecção fúngica grave são também advertidos a interromper o uso de bloqueadores de TNF até que a infecção seja controlada.
Reativação da Hepatite B
O uso de bloqueadores de TNF foi associado à reativação do vírus da hepatite B (HBV) em pacientes portadores crônicos deste vírus, sendo em alguns casos fatal. A maioria destes relatos ocorreu em pacientes que receberam concomitantemente outros medicamentos supressores do sistema imunológico, que também podem contribuir para a reativação do HBV. Pacientes com risco de contrair infecção por HBV devem ser avaliados pelo médico, quanto à evidência prévia de infecção por HBV, antes do início do tratamento com bloqueadores de TNF. Avise seu médico caso você seja portador do vírus da hepatite B. Pacientes portadores deste vírus e que requeiram terapia com bloqueadores de TNF devem ser cuidadosamente monitorados quanto a sinais e sintomas da infecção ativa por HBV durante a terapia e por vários meses após o término da mesma. Seu médico deverá suspender o uso de adalimumabe caso você desenvolva a reativação do vírus HBV. Neste caso, seu médico deverá iniciar terapia antiviral adequada.
Eventos Neurológicos
Os bloqueadores de TNF, incluindo adalimumabe, foram associados, em raros casos, com nova manifestação ou exacerbação de sintomas clínicos e/ou evidência radiológica de doença desmielinizante do sistema nervoso central, incluindo esclerose múltipla, neurite óptica (inflamação do nervo óptico) e doença desmielinizante periférica incluindo Síndrome de Guillain-Barré. Se você tiver esclerose múltipla (doença neurológica crônica) ou qualquer outra doença do sistema nervoso em que a bainha de mielina dos neurônios é danificada, seu médico decidirá se você deve ou não receber adalimumabe. No caso de alguma destas desordens, procure seu médico para mais informações sobre a continuidade do tratamento com adalimumabe. Existe uma associação conhecida entre a uveíte intermediária e as doenças desmielinizantes do sistema nervoso central (doença do sistema nervoso central no qual a bainha de mielina dos neurônios é danificada). A avaliação neurológica deve ser efetuada em pacientes que apresentem uveíte intermediária não infecciosa antes do início do tratamento com adalimumabe e regularmente durante o tratamento, para avaliação de doenças desmielinizantes do sistema nervoso central preexistentes ou em desenvolvimento.
Malignidades
Seu médico deverá monitorá-lo quanto ao desenvolvimento de linfomas e outras malignidades. Naspartes controladas dos estudos clínicos com antagonistas de TNF, foi observado maior número de casos de malignidades, incluindo linfoma, entre os pacientes que receberam bloqueadores de TNF do que entre os pacientes-controle. O tamanho do grupo controle e a duração limitada das partes controladas dos estudos não permitem chegar a conclusões concretas. Além disso, há maior risco de linfoma em pacientes com artrite reumatoide com doença inflamatória de longa duração, altamente ativa, o que complica a estimativa do risco. Durante os estudos abertos de longa duração com adalimumabe, a taxa total de malignidades foi similar ao que seria esperado para idade, sexo e raça na população geral. Com base no conhecimento atual, um possível risco para o desenvolvimento dos linfomas ou outras malignidades nos pacientes tratados com um antagonista de TNF não pode ser excluído. Malignidades, algumas fatais, foram relatadas entre crianças e adolescentes que foram tratados com agentes bloqueadores de TNF. A maioria dos pacientes estava tomando concomitantemente imunossupressores.
Casos muito raros de linfoma hepatoesplênico de células T, um raro e agressivo linfoma que é frequentemente fatal, foram identificados em pacientes recebendo adalimumabe. A maioria dos pacientes foi previamente tratada com infliximabe e também recebeu terapia concomitante com azatioprina ou 6- mercaptopurina para doença inflamatória intestinal. O risco potencial com a combinação de azatioprina ou 6-mercaptopurina e adalimumabe deve ser cuidadosamente considerado pelo médico. A associação causal entre este tipo de linfoma e adalimumabe não está clara. Nenhum estudo foi conduzido incluindo pacientes com histórico de malignidade ou pacientes que continuaram o tratamento após o diagnóstico de malignidade durante o tratamento com Humira® (adalimumabe). Assim, deve-se ter cautela adicional ao se considerar o tratamento com adalimumabe nestes pacientes. Todos os pacientes, em particular pacientes com histórico médico de extensa terapia imunossupressora ou pacientes com psoríase com histórico de tratamento com PUVA, devem ser examinados para a presença de câncer de pele não-melanoma antes e durante o tratamento com adalimumabe.
Casos de leucemia aguda e crônica foram relatados em associação com o uso de agentes bloqueadores de TNF em artrite reumatoide e outras indicações. Pacientes com artrite reumatoide podem estar expostos a um risco maior (até 2 vezes) do que a população geral para o desenvolvimento de leucemia, mesmo na ausência de terapia com bloqueador de TNF.
Com os dados disponíveis no momento não é sabido se o tratamento com adalimumabe influencia o risco de desenvolvimento de displasia ou câncer de cólon. Todos os pacientes com colite ulcerativa ou retocolite ulcerativa que têm risco aumentado para displasias ou carcinoma (câncer) de cólon (por exemplo, pacientes com colite ulcerativa ou retocolite ulcerativa de longa data ou colangite esclerosante primária), ou que tiveram uma história prévia de displasia ou carcinoma de cólon devem ser examinados para displasia em intervalos regulares antes da terapia e durante o curso da doença. Esta avaliação deve incluir colonoscopia e biópsias conforme recomendações de seu médico.
Em um ensaio clínico exploratório realizado para avaliar o uso de um outro bloqueador de TNF, infliximabe, em pacientes com doença pulmonar obstrutiva crônica (DPOC), moderada a grave, foram notificadas mais doenças malignas, principalmente nos pulmões ou cabeça e pescoço, no grupo de pacientes tratados com infliximabe do que no grupo de pacientes controle. Todos os pacientes tinham antecedentes de tabagismo intenso. Assim, devem ser tomadas precauções quando for usado um bloqueador de TNF em pacientes com DPOC, bem como em pacientes com risco aumentado de doenças malignas devido a tabagismo intenso.
Reações Alérgicas
Durante estudos clínicos, reações alérgicas graves associadas ao uso de adalimumabe foram raramente observadas. Relatos de reações alérgicas graves, incluindo reação anafilática, foram recebidos após o uso de adalimumabe. Se você apresentar reações alérgicas, tais como dificuldade para respirar, respiração ofegante, vertigens, inchaço ou erupções na pele, interrompa a aplicação de adalimumabe e procure seu médico imediatamente.
Alterações Hematológicas
Alterações na constituição do sangue foram raramente observadas com o uso de agentes bloqueadores de TNF. No entanto, caso você desenvolva sinais ou sintomas sugestivos de alterações hematológicas (por exemplo, febre persistente, manchas na pele, sangramento, palidez) durante o uso de adalimumabe procure o seu médico imediatamente. A descontinuação da terapia com adalimumabe deve ser considerada em pacientes com anormalidades hematológicas significativas confirmadas.
Administração concomitante de DMARDs ou bloqueador de TNF
Infecções graves foram observadas em estudos clínicos com o uso simultâneo de anacinra e outro bloqueador de TNF, etanercepte, sem benefício clínico adicional comparado com etanercepte isoladamente. Considerando-se a natureza dos eventos adversos observados na terapia combinada de etanercepte e anacinra, toxicidades similares podem também resultar da combinação de anacinra e outros bloqueadores de TNF. Portanto, a combinação de adalimumabe e anacinra não é recomendada. Informe o seu médico caso você esteja fazendo uso de medicamentos à base de anacinra. Informe seu médico se você está fazendo uso de outro DMARD (por exemplo, anacinra e abatacepte) ou outros bloqueadores de TNF, pois a administração combinada de adalimumabe com esses medicamentos não é recomendada por aumentar o risco de infecções e outras interações farmacológicas potenciais.
Imunossupressão
Em um estudo com pacientes com artrite reumatoide, tratados adalimumabe, não houve evidência de diminuição da hipersensibilidade do tipo retardada, diminuição dos níveis de imunoglobulinas ou alterações na contagem de células T, B e NK, monócitos/macrófagos e neutrófilos (células de defesa).
Vacinações
Os pacientes em tratamento com adalimumabe podem receber vacinações simultâneas, com exceção das vacinas vivas. Se possível, recomenda-se que os pacientes com artrite idiopática juvenil poliarticular estejam com todas as vacinas em dia antes de iniciar o tratamento com adalimumabe. Não é recomendado que crianças que foram expostas ao adalimumabe no útero da mãe, recebam vacinas vivas por até 05 meses após a última injeção de adalimumabe administrada na mãe durante a gravidez.
Insuficiência Cardíaca Congestiva
Adalimumabe não foi estudado em pacientes com insuficiência cardíaca congestiva (ICC).
Adalimumabe deve ser utilizado com precaução em pacientes com insuficiência cardíaca leve (classe I/II da NYHA). Adalimumabe está contraindicado na insuficiência cardíaca moderada a grave. O tratamento com adalimumabe deve ser interrompido em pacientes que desenvolvam novos sintomas ou agravamento dos sintomas de insuficiência cardíaca congestiva (incapacidade do coração de bombear o sangue em quantidade suficiente para o corpo).
Doenças Autoimunes
Seu médico deverá monitorá-lo quanto ao aparecimento de doenças autoimunes. O impacto de um tratamento prolongado com adalimumabe no desenvolvimento de doenças autoimunes é desconhecido.
Se um paciente desenvolver sintomas que sugiram Síndrome lúpus-símile durante o tratamento com adalimumabe, o tratamento deve ser descontinuado.
Cirurgia
A experiência existente, em termos de segurança de intervenções cirúrgicas em pacientes tratados com adalimumabe, é limitada. A meia-vida longa de adalimumabe deve ser levada em consideração se for planejada uma intervenção cirúrgica. Um paciente que requeira cirurgia durante o tratamento com adalimumabe, deve ser cuidadosamente monitorado para infecções, e ações apropriadas devem ser tomadas.
Capacidade de dirigir veículos e operar máquinas
Adalimumabe pode ter uma pequena influência na capacidade de dirigir veículos e operar máquinas. Após a administração de adalimumabe podem ocorrer vertigens e alterações da acuidade visual.
Carcinogenicidade, mutagenicidade e alterações na fertilidade
Não foram realizados estudos experimentais de longo prazo para avaliar o potencial carcinogênico ou os efeitos do adalimumabe sobre a fertilidade. Não foram observados efeitos clastogênicos ou mutagênicos do adalimumabe em testes específicos.
Quais as reações adversas e os efeitos colaterais do Bio-Manguinhos Adalimumabe?
Reações adversas durante os estudos clínicos
Estudos clínicos em pacientes demonstraram as seguintes reações adversas por órgão de sistema e por frequência, relacionadas ao tratamento com Humira® (adalimumabe).
Infestações e infecções*
- Reação muito comum (ocorre em mais de 10% dos pacientes que utilizam este medicamento): infecções no trato respiratório (incluindo infecção do trato respiratório inferior e superior, pneumonia, sinusite, faringite, nasofaringite e pneumonia por herpes viral).
- Reação comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento): infecções sistêmicas (incluindo sepse, candidíase e influenza), infecções intestinais [incluindo gastroenterite viral (inflamação do estômago e intestinos causada por uma infecção viral)], infecções de pele e tecidos moles [incluindo paroníquia (infecção da pele que rodeia a unha), celulite, impetigo (infecção cutânea superficial), fasciíte necrosante (infecção bacteriana destrutiva e rapidamente progressiva do tecido subcutâneo e fáscia superficial) e herpes zoster], infecções de ouvido, infecções orais (incluindo herpes simples, herpes oral e infecção dentária), infecções do trato reprodutivo (incluindo infecção vulvo vaginal micótica), infecção do trato urinário [incluindo pielonefrite (infecção que atinge os rins)], infecções fúngicas e infecções articulares.
- Reação incomum (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento): infecções oportunistas e tuberculose [incluindo coccidioidomicose e histoplasmose (doenças pulmonares causadas por um tipo de fungo) e infecção por complexo Mycobacterium avium], infecções neurológicas (incluindo meningite viral), infecções dos olhos e infecções bacterianas.
Neoplasias benignas, malignas e inespecíficas (incluindo cistos e pólipos)*
- Reação comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento): neoplasia benigna (crescimento anormal e benigno de células), câncer de pele não-melanoma (incluindo carcinoma de pele basocelular e carcinoma de pele de células escamosas).
- Reação incomum (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento): linfoma** (tipo de câncer que atinge o sistema linfático), neoplasia de órgãos sólidos (incluindo câncer de mamas, pulmonar e tireoide), melanoma** (tipo de câncer de pele).
Alterações no sistema sanguíneo e linfático*
- Reação muito comum (ocorre em mais de 10% dos pacientes que utilizam este medicamento): leucopenia (redução no número de leucócitos no sangue) [incluindo neutropenia (redução dos neutrófilos no sangue) e agranulocitose (diminuição ou ausência de granulócitos)], anemia.
- Reação comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento): trombocitopenia (redução do número de plaquetas no sangue), leucocitose (aumento no número de glóbulos brancos - células de defesa do corpo).
- Reação incomum (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento): púrpura trombocitopênica idiopática (diminuição do número das plaquetas no sangue).
- Reação rara (ocorre entre 0,01% e 0,1% dos pacientes que utilizam este medicamento): pancitopenia (diminuição global de elementos celulares do sangue).
Alterações no sistema imune*
- Reação comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento): hipersensibilidade e alergia (incluindo alergia sazonal).
Alterações no metabolismo e nutrição
- Reação muito comum (ocorre em mais de 10% dos pacientes que utilizam este medicamento): aumento de lipídeos (no sangue).
- Reação comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento): hipocalemia (baixa concentração de potássio no sangue), aumento do ácido úrico, quantidade anormal de sódio no sangue, hipocalcemia (baixa concentração de cálcio no sangue), hiperglicemia (aumento de glicose no sangue), hipofosfatemia (baixa quantidade de fósforo no sangue), desidratação.
Alterações psiquiátricas
- Reação comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento): alterações de humor (incluindo depressão), ansiedade, insônia.
Alterações no sistema nervoso*
- Reação muito comum (ocorre em mais de 10% dos pacientes que utilizam este medicamento): dor de cabeça.
- Reação comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento): parestesia (sensações cutâneas, sensações de frio, calor, formigamento, etc), incluindo hipoestesia (diminuição da sensibilidade), enxaqueca, compressão de raiz nervosa (inflamação do nervo ciático).
- Reação incomum (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento): tremor, neuropatia (doença do sistema nervoso).
- Reação rara (ocorre entre 0,01% e 0,1% dos pacientes que utilizam este medicamento): esclerose múltipla (doença neurológica crônica).
Alterações visuais
- Reação comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento): distúrbio visual, conjuntivite (inflamação da conjuntiva ocular), blefarite (inflamação das pálpebras), inchaço dos olhos.
- Reação incomum (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento): diplopia (visão dupla).
Alterações no ouvido e labirinto
- Reação comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento): vertigem.
- Reação incomum (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento): surdez, tinido.
Alterações cardíacas*
- Reação comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento): taquicardia (aumento da frequência cardíaca).
- Reação incomum (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento): arritmia (ritmo anormal dos batimentos cardíacos), insuficiência cardíaca congestiva (incapacidade do coração de bombear o sangue para o corpo em quantidade suficiente).
- Reação rara (ocorre entre 0,01% e 0,1% dos pacientes que utilizam este medicamento): parada cardíaca.
Alterações vasculares
- Reação comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento): hematoma, hipertensão (aumento da pressão arterial sanguínea), rubor (vermelhidão).
- Reação incomum (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento): oclusão arterial vascular (obstrução de uma artéria), tromboflebite (coágulo e inflamação de uma veia), aneurisma aórtico (dilatação anormal da artéria aorta).
Alterações respiratórias, torácicas e do mediastino*
- Reação comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento): tosse, asma, dispneia (falta de ar).
- Reação incomum (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento): doença pulmonar obstrutiva crônica, pneumopatia intersticial, pneumonite (inflamação do tecido pulmonar).
Alterações gastrointestinais
- Reação muito comum (ocorre em mais de 10% dos pacientes que utilizam este medicamento): náusea, vômito, dor abdominal.
- Reação comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento): hemorragia gastrointestinal (sangramento no estômago ou intestino), dispepsia (dor ou desconforto localizado na região abdominal), doença do refluxo gastroesofágico, Síndrome Sicca (doença autoimune que prejudica o funcionamento das glândulas provocando secura).
- Reação incomum (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento): pancreatite (inflamação do pâncreas), disfagia (dificuldade para engolir alimentos), edema (inchaço) facial.
Alterações hepatobiliares*
- Reação muito comum (ocorre em mais de 10% dos pacientes que utilizam este medicamento): elevação de enzimas hepáticas.
- Reação incomum (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento): colecistite (inflamação da vesícula biliar) e colelitíase (presença de cálculo(s) no interior da vesícula biliar), aumento da bilirrubina, esteatose hepática (fígado gorduroso).
Alterações na pele e tecido subcutâneo
- Reação muito comum (ocorre em mais de 10% dos pacientes que utilizam este medicamento): rash (incluindo rash esfoliativo).
- Reação comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento): prurido (coceira), urticária (alergia de pele), contusões (incluindo púrpura), dermatite (incluindo eczema), onicoclase (unhas quebradiças), hiperidrose (transpiração abundante).
- Reação incomum (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento): suores noturnos, manchas.
Alterações musculoesqueléticas e no tecido conjuntivo
- Reação muito comum (ocorre em mais de 10% dos pacientes que utilizam este medicamento): dor musculoesquelética.
- Reação comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento): espasmos musculares (incluindo aumento da creatina fosfoquinase sanguínea).
- Reação incomum (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento): rabdomiólise (síndrome resultante de danos na musculatura), lúpus eritematoso sistêmico (doença autoimune inflamatória crônica que pode afetar vários sistemas do organismo incluindo a pele, articulações e órgãos internos).
Alterações urinárias e renais
- Reação comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento): hematúria (perda de sangue pela urina), insuficiência renal.
- Reação incomum (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento): noctúria (eliminação de volume anormal de urina durante a noite).
Alterações no sistema reprodutor e mamas
- Reação incomum (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento): disfunção erétil.
Alterações gerais e no local da aplicação*
- Reação muito comum (ocorre em mais de 10% dos pacientes que utilizam este medicamento): reação no local da injeção (incluindo coloração avermelhada no local da injeção).
- Reação comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento): dor torácica, edema (inchaço).
- Reação incomum (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento): inflamação.
Investigações
- Reação comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento): alterações da coagulação e distúrbios hemorrágicos (incluindo aumento no tempo de tromboplastina parcial ativada), teste para autoanticorpos positivo (incluindo anticorpo DNA de cadeia dupla), aumento de desidrogenase lática no sangue.
Ferimentos, envenenamento e complicações durante procedimento
- Reação comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento): cicatrização prejudicada.
* Informações adicionais podem ser encontradas em outras seções desta bula.
** Inclui estudos abertos de extensão.
Uveíte
O perfil de segurança em pacientes com uveíte não infecciosa tratados adalimumabe foi consistente com o perfil de segurança do produto.
Hidradenite Supurativa
O perfil de segurança em pacientes com hidradenite supurativa tratados semanalmente com adalimumabe foi consistente com o perfil de segurança do produto.
Pacientes Pediátricos
No geral, as reações adversas em pacientes pediátricos foram similares em frequência e tipo às observadas em pacientes adultos.
Reação no local de injeção
Em estudos controlados, realizados em adultos e crianças, 12,9% dos pacientes tratados com Humira® (adalimumabe) desenvolveram reações no local da injeção [eritema e/ou prurido (coceira), hemorragia, dor ou edema], comparados com 7,2% dos pacientes que não receberam o medicamento. A maioria das reações locais foi descrita como leve e não levou à descontinuação do tratamento.
Infecções
Em estudos controlados pivotais , realizados em adultos e crianças, as infecções consistiram principalmente de nasofaringites, infecções de vias aéreas respiratórias superiores e sinusites. A maioria dos pacientes continuou o tratamento com adalimumabe depois do controle da infecção.
Em estudos controlados e abertos, realizados em adultos e crianças, com adalimumabe, infecções graves (incluindo raros casos fatais) foram reportadas, incluindo casos de tuberculose (inclusive miliar e extrapulmonar) e infecções oportunistas invasivas (por exemplo, histoplasmose disseminada, pneumonia por Pneumocystis carinii, aspergilose e listeriose).
Autoanticorpos
Amostras sanguíneas de pacientes foram testadas para autoanticorpos em diversos momentos durante os estudos clínicos para artrite reumatoide. Nestes estudos bem controlados e adequados, 11,9% dos pacientes tratados com adalimumabe e 8,1% de pacientes tratados com placebo e controle ativo que anteriormente tiveram resultado negativo para autoanticorpos reportaram resultados positivos na 24a semana. Dois dos 3989 pacientes tratados com adalimumabe em todos os estudos clínicos para artrite reumatoide, artrite psoriásica e espondilite anquilosante, desenvolveram sinais clínicos sugestivos de novo aparecimento de Síndrome lúpus-símile. Tais pacientes melhoraram após a descontinuação da terapia. Nenhum paciente desenvolveu sintomas do sistema nervoso central ou nefrite associada a lúpus.
No Estudo AIJ I, os pacientes pediátricos (04-17 anos de idade) tiveram amostras de soro de autoanticorpos coletadas em múltiplos pontos temporais. Pacientes que antes tinham testes basais negativos para anticorpos de DNA de dupla-hélice, no final da fase aberta lead-in (após 16 semanas de adalimumabe) apresentaram testes positivos em 31,8% dos pacientes tratados concomitantemente com metotrexato e 33,7% dos pacientes tratados com adalimumabe em monoterapia. No final da fase duplo-cega (após 48 semanas de tratamento), os pacientes em tratamento concomitante com metotrexato, que antes tinham testes basais negativos para anticorpos ds-DNA, apresentaram testes positivos em 54,1% dos pacientes tratados com placebo e 52,6% dos pacientes tratados com adalimumabe. Entre os pacientes não tratados concomitantemente com metotrexato, 32,1% dos pacientes tratados com placebo e 33,3% dos pacientes tratados com adalimumabe apresentaram testes positivos. No Estudo AIJ II, os pacientes pediátricos (02 a < 04 anos de idade) tiveram amostras de soro de autoanticorpos coletadas na visita basal e na Semana 24. Neste estudo aberto, 45,2% dos pacientes, que antes apresentaram anticorpos antinucleares negativos, reportaram resultados positivos na Semana 24. Nenhum destes pacientes tinham anticorpos contra de DNA de dupla-hélice . Nenhum dos 202 pacientes pediátricos tratados com adalimumabe nos Estudos AIJ I e II desenvolveram sinais clínicos sugestivos de novo aparecimento de Síndrome lúpus-símile. O impacto da terapia prolongada com adalimumabe no desenvolvimento de doenças autoimunes é desconhecido.
Psoríase: novo aparecimento e agravamento
Casos de novo aparecimento de psoríase, incluindo psoríase pustular e psoríase palmoplantar, e casos de piora de psoríase preexistente foram relatados com o uso de bloqueadores de TNF, incluindo adalimumabe. Muitos desses pacientes estavam usando concomitantemente imunossupressores (isto é, metotrexato, corticosteroides).
Alguns desses casos necessitaram de hospitalização. A maioria dos pacientes teve uma melhora da psoríase após a descontinuação do bloqueador de TNF. Alguns pacientes passaram por recorrência da psoríase quando iniciados em um diferente bloqueador de TNF. A descontinuação de Bio-Manguinhos Adalimumabe (adalimumabe) deve ser considerada em casos graves e naqueles em que não há melhora ou até piora em contrapartida ao tratamento tópico.
Elevação das enzimas do fígado
Em estudos controlados com adalimumabe em pacientes com artrite reumatoide e artrite psoriásica, as elevações da enzima aminotransferase (ALT) foram mais comuns nos pacientes tratados com adalimumabe. Uma vez que muitos pacientes nestes estudos também estavam utilizando medicamentos que causam elevações de enzimas hepáticas (por exemplo, AINEs, metotrexato) a relação entre HUMIRA® (adalimumabe) e a elevação das enzimas hepáticas não é clara.
Em estudos controlados com adalimumabe em pacientes com doença de Crohn, as elevações da ALT ocorreram em igual proporção para os pacientes tratados com adalimumabe e os pacientes tratados com a terapia controle.
Em estudos controlados com adalimumabe em pacientes com colite ulcerativa ou retocolite ulcerativa, as elevações da ALT foram mais comuns nos pacientes tratados com adalimumabe quando comparados com os pacientes tratados com a terapia controle.
Em estudos controlados com adalimumabe em pacientes com psoríase em placas, as elevações da ALT ocorreram em igual proporção para os pacientes tratados com adalimumabe e os pacientes tratados com a terapia controle.
Em estudos controlados com adalimumabe em pacientes com hidradenite supurativa e com a duração do período controle variando entre 12 e 16 semanas, as elevações da ALT foram mais comuns nos pacientes tratados com o controle quando comparados com os pacientes tratados com adalimumabe.
Em estudos controlados com adalimumabe) em pacientes com espondiloartrite axial (espondilite anquilosante e espondiloartrite axial não radiográfica), as elevações da ALT foram mais comuns nos pacientes tratados com adalimumabe) quando comparados com os pacientes tratados com a terapia controle.
Em estudo controlado em pacientes com artrite idiopática juvenil poliarticular de 04 a 17 anos, e pacientes com artrite relacionada à entesite acima de 06 anos, as elevações da ALT foram mais comuns nos pacientes tratados com adalimumabe) quando comparados com os pacientes tratados com o controle. A maior elevação da ALT ocorreu durante o uso concomitante de metotrexato.
Em estudo controlado, pacientes pediátricos tratados com adalimumabe com artrite idiopática juvenil de 02 a 04 anos não apresentaram elevações da ALT.
Em estudo controlado em pacientes pediátricos tratados com adalimumabe com doença de Crohn, as elevações da ALT ocorreram em 2,6% (5/192) dos pacientes tratados com adalimumabe dos quais 4 receberam imunossupressor concomitantemente no início do estudo.
Em estudo controlado em pacientes pediátricos com colite ulcerativa ou retocolite ulcerativa tratados com adalimumabe, as elevações da ALT ocorreram em 1,1% (1/93) dos pacientes.
Em estudos controlados em pacientes tratados com adalimumabe com uveíte, as elevações de ALT ocorreram em igual proporção para os pacientes tratados com adalimumabe e os pacientes tratados com a terapia controle.
Nos estudos clínicos, para todas as indicações, as elevações da ALT foram assintomáticas para os pacientes e, na maioria dos casos, estas elevações foram transitórias e resolvidas com a continuação do tratamento. No entanto, houve relatos muito raros na pós-comercialização, como reações hepáticas graves, incluindo insuficiência hepática (diminuição do funcionamento do fígado), em pacientes que receberam bloqueadores de TNF, incluindo adalimumabe. A relação causal com o tratamento de adalimumabe permanece incerta.
Tratamento concomitante com azatioprina/6-mercaptopurina
Nos estudos em adultos com doença de Crohn, foi observada uma incidência maior de eventos adversos relacionados às infecções graves e malignidades na combinação de adalimumabe e azatioprina/6- mercaptopurina quando comparadas com adalimumabe isoladamente.
Reações adversas adicionais na vigilância pós-comercialização ou estudos clínicos de Fase IV
Foram descritos eventos adversos durante o período de comercialização de Humira® (adalimumabe). Esses eventos são relatados voluntariamente por populações de tamanho incerto, portanto, não é possível estimar com confiança a sua frequência ou estabelecer uma relação causal à exposição de adalimumabe.
- Infecções e infestações: diverticulite (inflamação dos divertículos presentes no intestino grosso).
- Neoplasias benignas, malignas e inespecíficas (incluindo cistos e pólipos)*: linfoma hepatoesplênico de células T (tipo de linfoma das células T periféricas, que envolve o fígado e o baço), leucemia (tipo de câncer que atinge os glóbulos brancos), carcinoma de células de Merkel (carcinoma neuroendócrino cutâneo) e sarcoma de Kaposi, um cancro raro relacionado com a infeção pelo vírus herpes humano 8. O sarcoma de Kaposi aparece mais frequentemente na forma de lesões cutâneas de cor púrpura.
- Alterações do sistema imune*: anafilaxia (reação alérgica sistêmica grave), sarcoidose.
- Alterações do sistema nervoso*: doenças desmielinizantes (ex.: neurite óptica, Síndrome de Guillain-Barré), acidente vascular cerebral.
- Alterações respiratórias, torácicas e mediastinais: embolismo pulmonar (obstrução súbita de uma artéria pulmonar), derrame pleural (acumulação de líquido em excesso entre as pleuras), fibrose pulmonar (substituição do tecido pulmonar normal por um tecido de cicatrização).
- Alterações gastrointestinais*: perfuração intestinal.
- Alterações hepatobiliares*: reativação da hepatite B, insuficiência hepática (diminuição do funcionamento do fígado), hepatite.
- Alterações da pele e do tecido subcutâneo: vasculite cutânea, Síndrome de Stevens-Johnson, angioedema (inchaço subcutâneo), novo aparecimento ou piora da psoríase (incluindo psoríase pustular palmoplantar), eritema multiforme (reação imunológica das mucosas e da pele), alopecia (perda de pelos ou cabelo), reação cutânea liquenóide**.
- Alterações musculoesqueléticas ou do tecido conectivo: Síndrome lúpus-símile (desordem caracterizada pelo aparecimento de erupções cutâneas, dores articulares semelhantes ao lúpus).
- Alterações cardíacas: infarto do miocárdio.
- Alterações gerais e condições do local da administração: febre e aumento de peso (para a maioria dos pacientes, o aumento de peso foi pequeno).
* Informações adicionais podem ser encontradas em outras seções desta bula.
** Ocorre em pacientes administrando bloqueadores de TNF, incluindo Humira® (adalimumabe).
Atenção: este produto é um medicamento que possui nova indicação terapêutica no país e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, informe seu médico.
População Especial do Bio-Manguinhos Adalimumabe
Uso em idosos
A frequência de infecções graves entre pacientes com mais de 65 anos de idade tratados com adalimumabe foi maior do que para os pacientes com menos de 65 anos de idade. Não foram observadas diferenças em termos de eficácia entre essa população e a de indivíduos mais jovens. Não é necessário ajuste de dose para esta população. Devido a uma maior incidência de infecções na população idosa em geral, deve-se ter cautela quando do tratamento de pacientes idosos.
Uso pediátrico
Adalimumabe não foi estudado em crianças com menos de 02 anos de idade. A segurança e eficácia do medicamento em pacientes pediátricos não foram estabelecidas para outras indicações além da artrite idiopática juvenil (artrite idiopática juvenil poliarticular e artrite relacionada à entesite) e doença de Croh, uveíte, colite ulcerativa ou retocolite ulcerativa.
Insuficiência Renal e Hepática
Não há dados disponíveis sobre o metabolismo do medicamento em pacientes com insuficiência renal ou hepática.
Uso na gravidez
Os resultados de estudos em mulheres grávidas não revelaram evidências de danos fetais decorrentes de adalimumabe. Um estudo realizado em mulheres grávidas, pelo menos durante o primeiro trimestre, não demonstrou diferenças significativas, exceto para o parto prematuro, o que é consistente com o impacto das doenças subjacentes no parto prematuro. Não foram notificados natimortos ou neoplasias malignas. Desta forma, os dados não mostram risco aumentado de efeitos adversos na gravidez em mulheres com artrite reumatoide ou Doença de Crohn expostas ao adalimumabe em comparação com mulheres com artrite reumatoide ou Doença de Crohn não expostas ao adalimumabe. Além disso, os dados da vigilância pós-comercialização não estabelecem a presença de risco associado à droga. O adalimumabe pode atravessar a placenta e entrar em contato com recém-nascidos de mulheres tratadas com o produto durante a gravidez. Este medicamento só deve ser usado durante a gravidez quando, na opinião do médico, os benefícios potenciais claramente justificarem os possíveis riscos ao feto. Consequentemente, estas crianças podem estar sob risco de infecção aumentado. A administração de vacinas vivas em recém-nascidos expostos ao adalimumabe no útero não é recomendada por 05 meses após a última injeção recebida pela mãe mãe durante a gravidez.
Consulte seu médico sobre o uso de um método contraceptivo adequado enquanto estiver usando adalimumabe. Informe seu médico sobre a ocorrência de gravidez na vigência do tratamento ou após o seu término.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Trabalho de parto ou nascimento
Não existem efeitos conhecidos de adalimumabe sobre o trabalho de parto ou no nascimento.
Uso na lactação
Adalimumabe é excretado no leite humano em concentrações muito baixas. A presença de adalimumabe no leite humano ocorre em concentrações de 0,1% a 1% em soro materno. As imunoglobulinas ingeridas oralmente são degradadas no intestino e têm baixa disponibilidade sistêmica.
Dessa forma, os efeitos sistêmicos do adalimumabe em uma criança lactente são improváveis. Os benefícios para o desenvolvimento e para a saúde provenientes da amamentação devem ser considerados juntamente à necessidade clínica da mãe de utilizar o adalimumabe. Devem ser considerados também quaisquer efeitos adversos potenciais sobre a criança lactente causados pelo adalimumabe ou pela condição materna subjacente.
Apresentações do Bio-Manguinhos Adalimumabe
Solução injetável 40 mg/0,8mL
Apresentação de uso adulto e pediátrico acima de 6 anos
- 40 mg em seringa com 0,8 mL de dose única pronta para uso: cada caixa contém 2 seringas pré-preenchidas prontas para uso e 2 envelopes com lenço umedecido em álcool.
Via subcutânea.
Apresentação de uso pediátrico acima de 2 anos
- 40 mg em frasco-ampola com 0,8 mL de solução injetável pronta para uso: cada caixa contém um frasco-ampola, 1 seringa, 1 agulha, 1 adaptador e 2 lenços umedecidos em álcool.
Via subcutânea.
Qual a composição do Bio-Manguinhos Adalimumabe?
Cada 1 mL de solução contém:
50 mg de adalimumabe.
Cada seringa e cada frasco-ampola contém:
| Adalimumabe | 40 mg |
| Excipientes q.s.p | 0,8 mL |
Excipientes: cloreto de sódio, fosfato de sódio monobásico di-hidratado, fosfato de sódio dibásico di-hidratado, citrato de sódio di-hidratado, ácido cítrico monoidratado, manitol, polissorbato 80, hidróxido de sódio e água para injetáveis.
Superdose: o que acontece se tomar uma dose do Bio-Manguinhos Adalimumabe maior do que a recomendada?
A dose máxima tolerada de Bio-Manguinhos Adalimumabe (adalimumabe) não foi determinada em humanos. Nos estudos clínicos não foi observada toxicidade limitada por doses. Em caso de superdosagem, recomenda-se que o paciente seja monitorado quanto à presença de sinais ou sintomas de reações adversas, e que o tratamento sintomático e de suporte apropriado seja instituído imediatamente. Se você injetar Bio-Manguinhos Adalimumabe (adalimumabe) acidentalmente mais do que o recomendado, procure seu médico, levando a embalagem do produto, mesmo que esteja vazia.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Interação medicamentosa: quais os efeitos de tomar Bio-Manguinhos Adalimumabe com outros remédios?
Algumas vacinas, como a vacina oral para poliomielite (com vírus vivos), não devem ser tomadas durante o tratamento com adalimumabe. Consulte seu médico antes de tomar qualquer vacina.
Metotrexato
Adalimumabe foi estudado em pacientes com artrite reumatoide recebendo metotrexato concomitantemente. Os dados não sugerem a necessidade de ajuste de dose para nenhum dos dois medicamentos.
Outras
Não foram realizados estudos entre adalimumabe e outras substâncias. O uso combinado de adalimumabe e outros DMARDs (por exemplo, anacinra e abatacepte) não é recomendado. Vacinas vivas não devem ser administradas conjuntamente a adalimumabe. Nos estudos clínicos, não foram observadas interações quando adalimumabe foi administrado em combinação com DMARDs (sulfassalazina, hidroxicloroquina, leflunomida e ouro parenteral), glicocorticoides, salicilatos, anti-inflamatórios não esteroidais (ex.: ácido acetilsalicílico, diclofenacos, ibuprofeno) ou analgésicos.
Interação com testes laboratoriais
Não são conhecidas interferências de adalimumabe em testes laboratoriais.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
Qual a ação da substância do Bio-Manguinhos Adalimumabe?
Resultados de Eficácia
Adultos
Artrite reumatoide
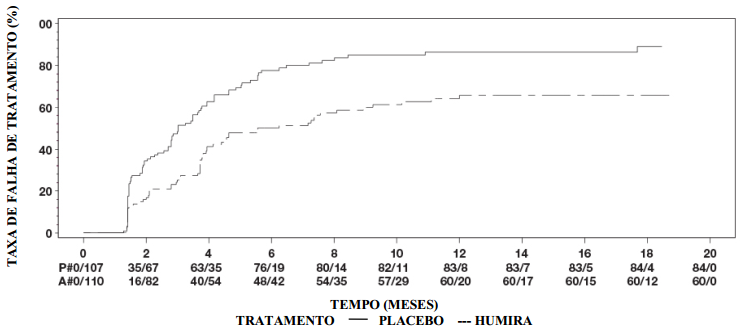
Adalimumabe foi avaliado em mais de 3000 pacientes com artrite reumatoide (AR) em estudos clínicos. Alguns pacientes foram tratados por até 120 meses. A eficácia e a segurança de Adalimumabe foram avaliados em cinco estudos clínicos controlados, duplo-cegos e randomizados.1-5 A dor no local da injeção de Adalimumabe 40 mg/0,4 mL em comparação com Adalimumabe 40mg/0,8 mL foi avaliada em dois estudos randomizados, ativos, controlados, simples cego, com dois períodos de crossover.
O estudo I (ARMADA)1 avaliou 271 pacientes com artrite reumatoide moderada a grave, com mais de 18 anos de idade, que falharam ao tratamento com pelo menos uma droga modificadora da doença (DMARD), com resposta insuficiente ao metotrexato em doses constantes de 12,5 a 25 mg/semana (ou 10 mg caso o paciente fosse intolerante ao metotrexato). Os pacientes apresentavam articulações edemaciadas ≥ 6 e articulações doloridas ≥ 9 e com AR diagnosticada de acordo com o critério ACR. Os pacientes receberam placebo ou 20, 40 ou 80 mg de Adalimumabe a cada 2 semanas, por 24 semanas, por via subcutânea (SC).
O estudo II (DE011)2 avaliou 544 pacientes com artrite reumatoide moderada a grave, com mais de 18 anos de idade, que falharam ao tratamento com pelo menos um DMARD (metotrexato, sulfassalazina, hidroxicloroquina, ouro oral ou injetável, d penicilamina, azatioprina). Os pacientes apresentaram articulações edemaciadas ≥ 10 e articulações doloridas ≥ 12 e também diagnosticados de acordo com o critério ACR. Os pacientes foram divididos em 5 grupos: placebo semanal, Adalimumabe 20 mg + placebo semanal, Adalimumabe 40 mg + placebo semanal, Adalimumabe 20 mg + placebo a cada 2 semanas, Adalimumabe 40 mg + placebo a cada 2 semanas. Todos os pacientes receberam os tratamentos por via subcutânea (SC). A duração do estudo foi de 26 semanas.
O estudo III (DE019)3 avaliou 619 pacientes com artrite reumatoide moderada a grave, com mais de 18 anos de idade, com resposta insuficiente ao metotrexato em doses constantes semanais de 12,5 a 25 mg/semana (ou 10 mg caso o paciente fosse intolerante ao metotrexato). Diferente do estudo I, os pacientes com AR do estudo III não apresentavam falhas ao tratamento com pelo menos um DMARD. Os pacientes foram divididos em grupos: injeções de placebo semanalmente, injeções de Adalimumabe 20 mg semanalmente e injeções de Adalimumabe 40 mg /0,8 mL40 mg a cada duas semanas + placebo nas semanas alternadas. Todos os pacientes receberam os tratamentos por via SC. A duração do estudo foi de 52 semanas. Após este período, os pacientes puderam entrar em um período de extensão aberto no qual avaliou-se o uso de Adalimumabe 40 mg/metotrexato a cada 2 semanas, por via SC, por até 10 anos.6
O estudo IV (STAR)4 avaliou 636 pacientes com artrite reumatoide moderada a grave, com mais de 18 anos de idade. A população do estudo incluiu pacientes que nunca haviam usado DMARDs ou que estavam em tratamento com DMARDs estável por no mínimo 28 dias. Estes tratamentos incluíram leflunomida, hidroxicloroquina, sulfassalazina e/ou sais de ouro. Os pacientes foram randomizados para receberem Adalimumabe 40 mg ou placebo, por via SC, a cada 2 semanas, por 24 semanas.
O estudo V (PREMIER)5 avaliou 799 pacientes com artrite reumatoide de início recente (duração média dos sintomas de menos de 9 meses), moderada a grave, que nunca haviam usado metotrexato. O estudo avaliou a eficácia, a segurança e a progressão radiológica da destruição articular de Adalimumabe 40 mg + metotrexato a cada 2 semanas, Adalimumabe 40 mg a cada 2 semanas e monoterapia com metotrexato, por 104 semanas. Todos os tratamentos foram por via SC. Após a conclusão das primeiras 104 semanas de tratamento, 497 pacientes foram inscritos em uma fase de extensão aberta, na qual 40 mg de Adalimumabe foram administrados a cada 15 dias por até 10 anos.
Os estudos VI e VII avaliou, cada um, 60 pacientes com artrite reumatóide moderada a grave ativa com idade ≥ 18 anos. Os pacientes inscritos ou eram usuários atuais de Adalimumabe 40 mg/0,8 mL e avaliaram sua dor média no local da injeção em pelo menos 3 cm (em uma 0-10 cm VAS) ou que nunca haviam se tratado com biológicos mas que haviam começado Adalimumabe 40 mg / 0,8 ml. Os pacientes foram randomizados para receber uma dose única de Adalimumabe 40 mg/0,8 mL ou Adalimumabe 40 mg/0,4 mL, seguido por uma injeção única do tratamento oposto no momento de sua próxima dose.
Os resultados dos estudos I-V foram expressados em porcentagem de pacientes com melhora na artrite reumatóide usando o criterio ACR de resposta.
As medidas de desfechos primárias dos estudos I, II e III e a medida de desfecho secundária do estudo IV foram a porcentagem de pacientes que atingiu respostas ACR20 nas semanas 24 ou 26 (diminuição de 20% dos critérios do American Collegge of Rheumatology). A medida de desfecho primária do estudo V foi a porcentagem de pacientes que atingiu respostas ACR50 (diminuição de 50% nos critérios do American College of Rheumatology) na semana 52. Os estudos III e V também tiveram a inibição da progressão da doença (medida por exames de raios-X) como medida de desfecho co-primária na semana 52. O estudo III também avaliou mudanças em escores de qualidade de vida como medida de desfecho co-primária.
Os principais resultados de eficácia destes estudos são apresentados a seguir.
Respostas ACR:
Tabela A: Respostas ACR nos estudos clínicos controlados por placebo (porcentagem de pacientes)1-3
| Respostas | Estudo Ia*1 | Estudo IIa*2 | Estudo IIIa*3 | |||
| Placebo + MTXc N=60 |
Adalimumabeb + MTXc N=63 |
Placebo N=110 |
Adalimumabeb N=113 |
Placebo + MTXc N=200 |
Adalimumabeb + MTXc N=207 |
|
| ACR 20 | ||||||
| 6 meses | 13,3% | 65,1% | 19,1% | 46% | 29,5% | 63,3% |
| 12 meses | ND | ND | ND | ND | 24% | 58,9% |
| ACR 50 | ||||||
| 6 meses | 6,7% | 52,4% | 8,2% | 22,1% | 9,5% | 39,1% |
| 12 meses | ND | ND | ND | ND | 9,5% | 41,5% |
| ACR 70 | ||||||
| 6 meses | 3,3% | 23,8% | 1,8% | 12,4% | 2,5% | 20,8% |
| 12 meses | ND | ND | ND | ND | 4,5% | 23,2% |
a Estudo I = 24 semanas, Estudo II = 26 semanas, Estudo III = 24 e 52 semanas.
b 40mg de Adalimumabe a cada 2 semanas.
c MTX= metotrexato.
*p<0,01, Adalimumabe versus placebo.
ND = Não disponível.
No estudo IV, a resposta ACR 20 dos pacientes tratados com Adalimumabe foi significativamente melhor do que os pacientes tratados com placebo (p<0,001).4
Nos estudos I-IV, todos os componentes individuais dos critérios de resposta ACR [número de articulações dolorosas, número de articulações edemaciadas, avaliações da atividade da doença e da dor pelo médico, avaliações da atividade da doença e da dor pelo paciente, escores do índice de incapacidade (HAQ – Health Assessment Questionnaire) e valores de PCR (proteína C reativa) em mg/dl] melhoraram em 241,3,4 ou 26 semanas2, quando comparados ao placebo. No estudo III, estas melhoras foram mantidas ao longo de 52 semanas.3
Além disto, as taxas de respostas ACR foram mantidas na maioria dos pacientes seguidos na fase de extensão aberta do estudo III.114/207 pacientes continuaram com Adalimumabe 40 mg SC a cada 2 semanas por 60 meses. Destes, 65%, 58% e 35% apresentaram respostas ACR 20/50/70, respectivamente, no mês 60.6
Nos estudos I-V, os pacientes tratados com Adalimumabe atingiram melhores respostas ACR 20 e 50, quando comparados ao placebo, de forma estatisticamente significante, após 1 ou 2 semanas após o início do tratamento.1-5
No estudo V, o tratamento combinado de Adalimumabe com metotrexato, em pacientes com artrite reumatoide inicial, levou a respostas ACR maiores e mais rápidas do que as monoterapias com Adalimumabe ou metotrexato, na semana 52, mantidas na semana 104 (Tabela B).
Tabela B: Respostas ACR no estudo V.5
| Respostas | MTX N=257 |
Adalimumabe N=274 |
Adalimumabe + MTX N=268 |
pa | pb | pc |
| ACR 20 | ||||||
| Semana 52 | 62,6% | 54,4% | 72,8% | 0,013 | <0,001 | 0,043 |
| Semana 104 | 56% | 49,3% | 69,4% | 0,002 | <0,001 | 0,140 |
| ACR 50 | ||||||
| Semana 52 | 45,9% | 41,2% | 61,6% | <0,001 | <0,001 | 0,317 |
| Semana 104 | 42,8% | 36,9% | 59% | <0,001 | <0,001 | 0,162 |
| ACR 70 | ||||||
| Semana 52 | 27,2% | 25,9% | 45,5% | <0,001 | <0,001 | 0,656 |
| Semana 104 | 28,4% | 28,1% | 46,6% | <0,001 | <0,001 | 0,864 |
a Valor de p da comparação entre monoterapia com metotrexato e tratamento combinado de Adalimumabe com metotrexato (teste U de Mann-Whitney).
b Valor de p da comparação entre monoterapia com Adalimumabe e tratamento combinado de Adalimumabe com metotrexato (teste U de Mann-Whitney).
c Valor de p da comparação entre monoterapia com metotrexato e monoterapia com Adalimumabe (teste U de Mann-Whitney).
Na fase de extensão aberta do estudo V(PREMIER)5 de AR, as taxas de resposta ACR foram mantidas quando seguidas por até 10 anos. Dos 542 pacientes que foram randomizados para o tratamento com Adalimumabe 40 mg a cada 15 dias, 170 pacientes continuaram com o tratamento com Adalimumabe 40 mg a cada 15 dias por 10 anos. Dentre esses, 154 pacientes (90,6%) apresentaram resposta ACR 20; 127 pacientes (74,7%) tiveram resposta ACR50; e 102 pacientes (60,0%) apresentaram resposta ACR 70.
Na semana 52, 42,9% dos pacientes que receberam o tratamento combinado de Adalimumabe com metotrexato atingiram remissão clínica (DAS 28 - CRP <2,6), comparados a 20,6% dos pacientes que receberam monoterapia com metotrexato e 23,4% dos que receberam monoterapia com Adalimumabe. O tratamento combinado de Adalimumabe com metotrexato foi superior às monoterapias com metotrexato e Adalimumabe (ambos p<0,001) em atingir baixa atividade da doença em pacientes com artrite reumatoide recentemente diagnosticada de moderada a grave intensidade. Dos 342 pacientes originalmente randomizados para a terapia com Adalimumabe ou a terapia combinada de Adalimumabe com metotrexato que entraram no estudo de extensão aberto, 171 pacientes completaram 10 anos de tratamento com Adalimumabe. Dentre esses, 109 pacientes (63,7%) foram reportador por apresentar remissão aos 10 anos de tratamento.
Progressão radiográfica:
No estudo III, no qual os pacientes tratados com Adalimumabe apresentaram uma duração média da artrite reumatoide de aproximadamente 11 anos, o dano articular estrutural foi avaliado radiograficamente e expresso por meio da mudança no escore total de Sharp modificado e seus componentes (escores de erosão e de estreitamento dos espaços articulares). Os pacientes tratados com Adalimumabe e metotrexato apresentaram significativamente menos progressão radiográfica do que os pacientes tratados apenas com metotrexato, após 6 e 12 meses (Tabela C).3
Tabela C: Mudanças médias nos escores de Sharp em 12 meses (estudo III)3
| - | Placebo + MTX | Adalimumabe + MTX 40 mg SC a cada 2 semanas | IC 95% | P |
| Escore de Sharp total | 2,7 | 0,1 | 2,6 (1,4-3,8) | <0,001 |
| Escore de erosão | 1,6 | 0,0 | 1,6 (0,9-2,2) | <0,001 |
| Escore de estreitamento dos espaços articulares | 1,0 | 0,1 | 0,9 (0,3-1,4) | 0,002 |
MTX = metotrexato.
IC = Intervalo de confiança.
Dados da fase de extensão indicaram que a redução na taxa de progressão do dano estrutural é mantido por 60 meses em um subgrupo de pacientes. 113/207 pacientes originalmente tratados com Adalimumabe 40 mg SC a cada 2 semanas foram avaliados após 5 anos. Destes, 66 pacientes não mostraram nenhuma progressão do dano estrutural, definida por mudança no escore total de Sharp de zero ou menos.6
No estudo V, o dano estrutural foi avaliado radiograficamente e também expresso por meio das mudanças no escore total de Sharp modificado e seus componentes, de acordo com a Tabela D.
Tabela D: Mudanças médias nos escores de Sharp na semana 52 (estudo V)5
| Respostas | MTX N=257 (IC 95) |
Adalimumabe N=274 (IC 95) |
Adalimumabe + MTX N=268 (IC 95) |
pa | pb | pc |
| Escore total de Sharp | 5,7(4,2-7,3) | 3,0(1,7-4,3) | 1,3(0,5-2,1) | <0,001 | 0,002 | <0,001 |
| Escore de erosão | 3,7(2,7-4,7) | 1,7(1,0-2,4) | 0,8(0,4-1,2) | <0,001 | 0,0082 | <0,001 |
| Escore de estreitamento dos espaços articulares | 2,0(1,2-2,8) | 1,3(0,5-2,1) | 0,5(0-1,0) | <0,001 | 0,0037 | 0,151 |
a Valor de p da comparação entre monoterapia com metotrexato e tratamento combinado de Adalimumabe com metotrexato (teste U de Mann-Whitney).
b Valor de p da comparação entre monoterapia com Adalimumabe e tratamento combinado de Adalimumabe com metotrexato (teste U de Mann-Whitney).
c Valor de p da comparação entre monoterapia com metotrexato e monoterapia com Adalimumabe (teste U de Mann-Whitney).
MTX = metotrexato.
IC = Intervalo de confiança.
Após 52 e 104 semanas de tratamento, a porcentagem de pacientes sem progressão (mudança no escore total de Sharp modificado < 0,5) foi significativamente maior no grupo de tratamento combinado de Adalimumabe mais metotrexato (63,8% e 61,2%, respectivamente), quando comparado ao grupo que recebeu monoterapia com Adalimumabe (50,7%, p<0,002, e 44,5%, p<0,001, respectivamente) e monoterapia com metotrexato (37,4% e 33,5%), respectivamente, ambos p<0,001).5
Na extensão aberta do estudo V(PREMIER)5 de AR, a variação média da linha de base no Ano 10 na Pontuação Total Sharp modificada foi de 10,8; 9,2 e 3,9 em pacientes originalmente randomizados para monoterapia com metotrexato, Adalimumabe em monoterapia e terapia combinada com Adalimumabe e metotrexato, respectivamente. As proporções correspondentes de pacientes sem progressão radiográfica foram 31,3%, 23,7% e 36,7%, respectivamente.
Qualidade de vida e função física:
Qualidade de vida e função física foram avaliados pelo HAQ (Health Assessment Questionnaire), em todos os estudos de Adalimumabe, com placebo como comparador, sendo uma medida de desfecho co-primária no estudo III. Todos os grupos tratados com Adalimumabe apresentaram melhora significativamente maior que o placebo no índice de incapacidade do HAQ, após 6 meses, o mesmo acontecendo no estudo III após 52 semanas. Nestes estudos, uma melhora do componente físico do Short Form 36 (SF-36) também suporta estes achados. No estudo V, a melhora do índice de incapacidade do HAQ e do componente físico do SF-36 foi significativamente maior para o grupo tratado com Adalimumabe e metotrexato, quando comparada aos grupos tratados com monoterapia com Adalimumabe e metotrexato (p < 0,001).1-4
Uma diminuição significativa da fadiga, medida pelo escore FACIT (Functional Assessment of Chronic Illness Therapy) foi observada nos estudos I, III e IV, onde tal instrumento foi usado.1,3,5
No estudo III, a melhora da função física foi mantida por até 60 meses da fase de extensão aberta. A qualidade de vida foi medida até a semana 156 (36 meses) e a melhora foi mantida por este período.3
Dentre os 250 pacientes que completaram o estudo de extensão aberto, as melhorias na função física foram mantidas durante 10 anos de tratamento.
Dor no local da injeção:
Para os estudos VI e VII, uma diferença estatisticamente significativa para a dor no local da injeção imediatamente após a aplicação foi observado entre Adalimumabe 40 mg/0,8 mL e Adalimumabe AC40 mg/0,4 mL (média VAS de 3,7 cm contra 1,2 cm, escala de 0 -10 cm, p <0,001). Isto representou uma redução média de 84% na dor no local da injeção.
Artrite Psoriásica
Adalimumabe 40 mg SC a cada duas semanas, foi avaliado em pacientes com artrite psoriásica moderada a grave em 2 estudos controlados por placebo. No estudo I, foram observados 313 pacientes adultos com resposta inadequada a anti-inflamatórios não esteroidais (AINES), por 24 semanas.7 No estudo II, 100 pacientes com resposta inadequada a DMARDs foram observados por 12 semanas.8 Os pacientes de ambos os estudos puderam entrar em uma fase aberta, onde todos receberam Adalimumabe 40 mg SC a cada 2 semanas, por até 144 semanas.9,10
As respostas ACR no estudo I foram semelhantes com e sem tratamento concomitante com metotrexato (aproximadamente 50% dos pacientes foram tratados concomitantemente com metotrexato) (Tabela E).
Tabela E: Respostas ACR nos estudos controlados por placebo de Adalimumabe para artrite psoriásica7
| Respostas | Estudo I7 | Estudo II8 | ||
| Placebo N=162 |
Adalimumabe N=151 |
Placebo N=49 |
Adalimumabe N=51 |
|
| ACR 20 | ||||
| Semana 12 | 14% | 58%* | 16% | 39%** |
| Semana 24 | 15% | 57%* | ND | ND |
| ACR 50 | ||||
| Semana 12 | 4% | 36%* | 2% | 25%* |
| Semana 24 | 6% | 39%* | ND | ND |
| ACR 70 | ||||
| Semana 12 | 1% | 20%* | 0% | 14%** |
| Semana 24 | 1% | 23%* | ND | ND |
ND = não disponível.
*p<0,001 para todas as comparações entre Adalimumabe e placebo.
**p<0,05 para todas as comparações entre Adalimumabe e placebo.
As respostas ACR foram mantidas na fase de extensão aberta por até 136 semanas.9
As mudanças radiográficas também foram avaliadas nos estudos de artrite psoriásica. Radiografias de mãos, punhos e pés foram obtidas no início do estudo e nas semanas 24 (fase duplo-cega do estudo I)7 e semana 48 (fase aberta).10 Um escore de Sharp modificado (mTSS), que incluiu as articulações interfalangianas distais, foi usado para medir a progressão radiográfica. Adalimumabe reduziu a taxa de progressão do dano articular periférico, quando comparado com o placebo (mudança média do mTSS = 0,8 ± 2,42 no grupo placebo na semana 24 comparado a 0,1± 1,95 no grupo tratado com Adalimumabe na semana 48, p < 0,001).9,10 Nos pacientes tratados com Adalimumabe sem progressão radiográfica do início do estudo até a semana 48 (n=102), 84% continuaram a demonstrar ausência de progressão por até 144 semanas de tratamento.9,10
Os pacientes tratados com Adalimumabe demonstraram melhora significativa na função física, avaliada pelo HAQ e pelo SF-36 comparados aos pacientes que receberam placebo, na semana 24.7 A melhora da função física continuou durante a fase de extensão aberta até a semana 136.9
Espondilite Anquilosante
Adalimumabe 40 mg SC a cada duas semanas foi avaliado em dois estudos duplocegos, placebo-controlados, de 24 semanas, em pacientes com espondilite anquilosante ativa, sem resposta adequada ao tratamento convencional.11-13 O período cego foi seguido de uma fase de extensão aberta, na qual os pacientes receberam apenas Adalimumabe 40 mg SC a cada 2 semanas.14
No estudo I, com 315 pacientes, os resultados apresentaram melhora significativa dos sinais e sintomas da espondilite anquilosante nos pacientes tratados com Adalimumabe, quando comparados aos tratados com placebo. Uma resposta significativa foi observada na semana 2, e mantida ao longo de 24 semanas (Tabela F).11
Tabela F: Respostas de eficácia em estudos controlados por placebo de Adalimumabe para espondilite anquilosante 11
| Resposta | Adalimumabe N=208* |
Placebo N=107 |
| ASAS 20a | ||
| Semana 2 | 42%* | 16% |
| Semana 12 | 58%* | 21% |
| Semana 24 | 51%* | 19% |
| ASAS 50 | ||
| Semana 2 | 16%* | 3% |
| Semana 12 | 38%* | 10% |
| Semana 24 | 35%* | 11% |
| ASAS 70 | ||
| Semana 2 | 7%** | 0% |
| Semana 12 | 23%* | 5% |
| Semana 24 | 24%* | 8% |
| BASDAI 50b | ||
| Semana 2 | 20%* | 4% |
| Semana 12 | 45%* | 16% |
| Semana 24 | 42%* | 15% |
*, ** Estatisticamente significante, com p<0,001, <0,001 para todas as comparações entre Adalimumabe e placebo, nas semanas 2, 12 e 24.
A melhora nas respostas ASAS e nos escores BASDAI foi mantida por até 2 anos.14
Pacientes tratados com Adalimumabe apresentaram melhora significativamente maior nos escores de dor, fadiga e rigidez,15 e nos escores de qualidade de vida (SF-36 e ASQoL – Questionário de Qualidade de Vida para Espondilite Anquilosante), quando comparados aos que receberam placebo, na semana 24.16
Tendências semelhantes (nem todas estatisticamente significantes) foram observadas no estudo II, realizado com 82 pacientes adultos com espondilite anquilosante ativa.12,13
Espondiloartrite Axial Não Radiográfica (Espondiloartrite axial sem evidência radiográfica de EA)
A segurança e eficácia de Adalimumabe foram avaliadas em dois estudos randomizados, duplo cego controlados por placebo, em pacientes com espondiloartrite axial não-radiográfica (nr-axSpA). O estudo nr-axSpA I avaliou pacientes com nr-axSpA ativa. O estudo nraxSpA II foi um estudo de descontinuação de tratamento em pacientes com nr-axSpA ativa que atingiram a remissão durante o tratamento aberto com Adalimumabe.
Estudo n-axSpA I:
No estudo nr-axSpA I, Adalimumabe 40 mg a cada duas semanas foi avaliado em 185 pacientes por 12 semanas, em um estudo randomizado, duplo cego, placebo-controlado, em pacientes com nr-axSpA ativa[média basal da atividade da doença (BASDAI – Bath Ankylosing Spondylitis Disease Activity Index) de 6,4 para pacientes tratados com Adalimumabe e 6,5 para pacientes recebendo placebo] que responderam inadequadamente ou que são intolerantes a ≥ 1 AINEs, ou que apresentam contraindicação a AINES. Os pacientes incluídos foram classificados de acordo com o critério ASAS de EpA axial, excluindo pacientes que satisfizeram os critérios de New York modificados para espondilite anquilosante e aqueles com psoríase ou artrite psoriásica. O objetivo primário foi a porcentagem de pacientes que alcançaram o critério de resposta ASAS40 na semana 12.17
Trinta e três (18%) dos pacientes foram tratados concomitantemente com drogas modificadoras do curso da doença (DMARDs), e 146 (79%) dos pacientes, com AINEs no baseline. O período duplocego foi seguido de uma fase de extensão aberta, no qual, os pacientes receberam Adalimumabe 40mg, por via subcutânea, a cada duas semanas por 144 semanas adicionais. A semana 12 mostrou uma melhora estatisticamente significante dos sinais e sintomas da nr-axSpA ativaem pacientes tratados com Adalimumabe comparado com placebo tanto na população geral quanto em pacientes com Ressonância nuclear magnética (RNM) positivo ou PCR elevada (Tabelas G e H). Variáveis que demonstram uma redução dos sinais e sintomas da nraxSpA ativaforam sustentadas ou continuaram a melhorar na semana 24 e na Semana 68 e foram mantidas até a Semana 156 (Tabelas G e H).17-19
Tabela G: Respostas de eficácia no estudo nr-axSpA I placebo-controlado de Adalimumabe18, 19
| Duplo-cego - Resposta na semana 12 | Placebo N=94 |
Adalimumabe N=91 |
| ASASa 40 | 15% | 36%*** |
| ASAS 20 | 31% | 52%** |
| ASAS 5/6 | 6% | 31%*** |
| ASAS Remissão Parcial | 5% | 16%* |
| BASDAIb 50 | 15% | 35%** |
| ASDASc,d,e | -0,3 | -1.0*** |
| ASDAS Doença Inativa | 4% | 24%*** |
| SF-36 PCSd, f | 2,0k | 5,5** |
| HAQ-Sd,g | -0,1 | -0,3* |
| PCR-usd,h,i | -0,3 | -4,7*** |
| SPARCCj RNM articulações sacroilíacasd,k | -0,6 | -3,2** |
| SPARCC RNM colunad, l | -0,2 | -1,8** |
a Avaliação da Sociedade Internacional de Espondiloartrites.
b Bath Ankylosing Spondylitis Disease Activity Index.
c Score da Atividade da Doença Espondilite Anquilosante.
d Alteração média do baseline.
e n=91 no placebo e n=87 para Adalimumabe.
f Short Form-36 Health Status SurveyTM Versão 2 pontuação de componente físico.
g Health Assessment Questionnaire modificado pela espondiloartropatias.
h Proteína C-Reativa ultra-sensível(mg/L).
i n = 73 no placebo e n=70 para Adalimumabe.
j Spondyloarthritis Research Consortium of Canada.
k n = 84 no placebo e para Adalimumabe.
l n = 82 no placebo e n = 85 para Adalimumabe.
m n = 93.
*** Valor p < 0,001.
** Valor p < 0,01.
* Valor p < 0,05.
# Análises NRI para todos os endpoints categóricos, análise LOCF para HAQ-S e PCR-us e análise de casos observados para SF-36 e pontuação SPARCC RNM.
Tabela H: Respostas de eficácia no estudo nr-axSpA I placebo-controlado de Adalimumabe para (População com RNM positivo e/ou PCR elevado)#17,19
| Duplo-cego- Resposta na semana 12 | Placebo N=73 |
Adalimumabe N=69 |
| ASASa 40 | 14% | 41%*** |
| ASAS 20 | 32% | 59%*** |
| ASAS 5/6 | 8% | 35%*** |
| ASAS Remissão Parcial | 5% | 19%* |
| BASDAIb 50 | 14% | 39%*** |
| ASDASc,d,e | -0,3 | -1,2*** |
| ASDAS Doença Inativa | 4% | 29%*** |
| SF-36 PCSd,f | 2,3l | 6,9*** |
| HAQ-Sd,g | -0,1 | -0,3** |
| PCR-usd,h, i | -0,8 | -6,5*** |
| SPARCCj RNM articulações sacroilíacasdk | -0,9 | -4,3** |
| SPARCC RNM colunad,l | -0,5 | -2,3** |
a Avaliação da Sociedade Internacional de Espondiloartrites.
b Bath Ankylosing Spondylitis Disease Activity Index.
c Score da Atividade da Doença Espondilite Anquilosante.
d Alteração média do baseline.
e n=72 no placebo e n=66 para Adalimumabe.
f Short Form-36 Health Status SurveyTM Versão 2 pontuação de componente físico.
g Health Assessment Questionnaire modificado pela espondiloartropatias.
h Proteína C-Reativa ultra-sensível (mg/L).
i n = 54 no placebo e n=50 para Adalimumabe.
j = Spondyloarthritis Research Consortium of Canada.
k n = 64 no placebo e para Adalimumabe.
l n = 62 no placebo e n = 65 para Adalimumabe.
m n=72.
*** valor p < 0,001.
** valor p < 0,01.
* valor p < 0,05.
# Análises NRI para todos os endpoints categóricos e análise de casos observados para HAQ-S, PCR-us, SF-36 e pontuação SPARCC RNM.
Tabela I: Respostas de eficácia no estudo nr-axSpA I aberto de extensão de Adalimumabe18,19
| Endpoint | Semana 24 N=171 |
Semana 68 N=145 |
Semana 156 N=122 |
| ASASa 40 | 89 (52,0%) | 97 (66,9%) | 81 (66,4%) |
| ASAS 20 | 117 (68,4%) | 116 (80,0%) | 101 (82,8%) |
| ASAS 5/6 | 74 (43,3%) | 72 (49,7%) | 58 (47,5%) |
| ASAS remissão parcial | 45 (26,5%)g | 53 (36,6%) | 52 (43,3%) |
| BASDAIb 50 | 86 (50,3%) | 93 (64,8%) | 85 (69,7%) |
| ASDASc,d | -1,5j | -1,8k | -1,7l |
| ASDAS Doença Inativa | 60(35,3%)h | 69 (47,6%) | 55 (45,8%)i |
| SF-36 PCSd,e | 7,2m | 9,6n | 10,5o |
| HAQ-Sd,f | -0,39 | -0,47 | -0,48 |
| hs-CRPd,g | -4,6p | -4,1q | -3.3r |
a Avaliação da Sociedade Internacional de Espondiloartrites.
b Bath Ankylosing Spondylitis Disease Activity Index.
c Score da Atividade da Doença Espondilite Anquilosante.
d Alteração média do baseline.
e Short Form-36 Health Status SurveyTM Versão 2 pontuação de componente físico.
f Health Assessment Questionnaire modificado pela espondiloartropatias.
g Proteína C-Reativa ultra-sensível (mg/L).
h n = 170.
i n = 120.
j n = 163.
k n = 140.
l n = 118.
m n = 177.
n n = 151, semana 52.
o n 121.
p n = 131.
q n = 112.
r n = 97.
# Análise dos casos observados.
Tabela J: Respostas de eficácia no estudo nr-axSpA I aberto de extensão de Adalimumabe para (População com RNM positivo e/ou PCR elevado)18,19
| Endpoint | Semana 24 N=133 |
Semana 68 N=111 |
Semana 156 N=97 |
| ASASa 40 | 70 (52,6%) | 78 (69,6%) | 67 (69,1%) |
| ASAS 20 | 96 (72,2%) | 94 (83,9%) | 83 (85,9%) |
| ASAS 5/6 | 61 (46,6%) | 63 (56,3%) | 49 (50,5%) |
| ASAS Remissão Parcial | 37 (27,8%) | 45 (40,2%) | 45 (46,9%) |
| BASDAIb 50 | 68 (51,1%) | 75 (67,0%) | 70 (72,2%) |
| ASDASc,d | -1,6i | -1,9j | -1,9k |
| ASDAS Doença Inativa | 48 (36,1%) | 54 (48,2%) | 45 (47,4%)l |
| SF-36 PCSd,e | 7,7m | 10,5n | 11,5o |
| HAQ-Sd,f | -0,39 | -0,48 | -0,50 |
| hs-CRPd,g | -6,0p | -5,9q | -4,2r |
a Avaliação da Sociedade Internacional de Espondiloartrites.
b Bath Ankylosing Spondylitis Disease Activity Index.
c Score da Atividade da Doença Espondilite Anquilosante.
d Alteração média do baseline.
e Short Form-36 Health Status SurveyTM Versão 2 pontuação de componente físico.
f Health Assessment Questionnaire modificado pela espondiloartropatias.
g Proteína C-Reativa ultra-sensível (mg/L).
h n = 96.
i n = 129.
j n = 110.
k n = 93.
l n = 95.
m n = 138.
n n = 116, semana 52.
o n = 96 p = n = 97.
q n = 83.
r n = 75.
# Análise dos casos observados.
Inibição da inflamação:
Foram mantidas melhoras significantes dos sinais da inflamação como medidos pelo hs-CRP e MRI para as articulações sacroilíacas e a coluna em pacientes tratados com Adalimumabe durante a Semana 156 e Semana 104, respectivamente. SPARCC MRI para articulações sacroilíacas estavam disponíveis para 131 pacientes e SPARCCC MRI para coluna estavam disponíveis para 130 pacientes com uma alteração média do baseline de -3,8 e -1,4, respectivamente, na Semana 104.
Qualidade de vida e capacidade física:
A qualidade de vida relacionada com a saúde e a capacidade física foram avaliadas através dos questionários HAQ-S e SF-36. Adalimumabe mostrou uma melhora estatisticamente significativa na nota total do HAQ-S e na pontuação do componente físico do SF-36 (PCS) do início até a semana 12 comparados com o placebo. Os resultados para SF-36 (PCS) e HAQ-S foram sustentados durante as Semanas 52, 68 e 156, respectivamente.17-19
Estudo nr-axSpA II:
673 pacientes com nr-axSpA ativa (atividade média base da doença [BASDAI] foi de 7,0) os quais tiveram uma resposta inadequada a ≥ 2 AINEs ou uma intolerância ou contraindicação para os AINEs incluídos no período de estudo aberto nr-axSpA II durante o qual receberam Adalimumabe 40 mg a cada duas semanas durante 28 semanas. Esses pacientes também apresentaram evidência objetiva de inflamação nas articulações sacroilíacas ou coluna vertebral na ressonância magnética ou elevação da PCR (proteína C reativa). Os pacientes que alcançaram remissão sustentada durante pelo menos 12 semanas (N = 305) (ASDAS <1,3 nas semanas 16, 20, 24 e 28) durante o período aberto foram então aleatorizados para receberem tratamento continuado com Adalimumabe 40 mg a cada duas semanas (N = 152) ou placebo (N = 153) por um período adicional de 40 semanas em um período duplo-cego, controlado por placebo (duração total do estudo de 68 semanas). Pacientes que apresentaram flare da doença durante o período duplo-cego foram autorizados a terapia de resgate Adalimumabe 40 mg por pelo menos 12 semanas.
O desfecho primário de eficácia foi à proporção de pacientes sem agravamento na Semana 68 do estudo. O agravamento foi definido como ASDAS ≥ 2,1 em duas visitas consecutivas com quatro semanas de intervalo. Uma proporção maior de pacientes em uso de Adalimumabe não apresentou agravamento da doença durante o período duplo-cego, quando comparados com os que receberam placebo (70,4% vs. 47,1%, p <0,001) (Figura 1).
Figura 1: Curvas de Kaplan-Meier Resumindo o Tempo de Remissão no Estudo nr-axSpA II
Nota: P = Placebo (Número em Risco (flared)); A = Adalimumabe (Número em risco (flared)).
Entre os 68 pacientes que apresentaram flare da doença no grupo alocado para descontinuação do tratamento, 65 completaram 12 semanas de terapia de resgate com Adalimumabe, dos quais 37 (56,9%) haviam recuperado a remissão (ASDAS <1,3) após 12 semanas de reinício do tratamento aberto.
Na Semana 68, os pacientes que receberam tratamento contínuo com Adalimumabe apresentaram melhora estatisticamente significativa maior dos sinais e sintomas de nr-axSpA ativa em comparação com os pacientes alocados para descontinuação do tratamento durante o período duplo-cego do estudo (Tabela K).
Tabela K: Resposta à Eficácia no Período Controlado por Placebo para o Estudo nr axSpA II
| Duplo-cego - Resposta na semana 68 | Placebo N=153 |
Adalimumabe N=152 |
| ASASa,b 20 | 47.1% | 70.4%*** |
| ASASa,b 40 | 45.8% | 65.8%*** |
| ASASa Remissão Parcial | 26.8% | 42.1%** |
| ASDASc Doença Inativa | 33.3% | 57.2%*** |
| Agravamento Parciald | 64.1% | 40.8%*** |
a Avaliação da Sociedade Internacional de Espondiloartrites.
b Baseline é definida como baseline aberta quando os pacientes tem doença ativa. A linha is defined as open label baseline when patients have active disease.
c Score da Atividade da Doença Espondilite Anquilosante.
d Agravamento Parcial é definido com ASDAS ≥ 1.3 a < 2.1 em 2 visitas consecutivas.
*** Valor p < 0.001.
** Valor p < 0.01.
Doença de Crohn
A segurança e a eficácia de Adalimumabe foram avaliadas em mais de 1400 pacientes com doença de Crohn (DC) ativa, moderada a grave (Crohn’s Disease Activity Index (CDAI) ≥ 220 e ≤ 450) em estudos duplo-cegos, randomizados, controlados por placebo. Nestes estudos foi permitido o uso concomitante de doses estáveis de aminossalicilatos, corticosteroides e/ou agentes imunomoduladores.
A indução de remissão clínica (definida como CDAI < 150) foi avaliada em dois estudos, Estudo I20 de DC (M02-403) e Estudo II21 de DC (M04-691). No Estudo I20 de DC, 299 pacientes virgens de antagonistas de TNF foram randomizados para um de quatro grupos de tratamento: placebo nas semanas 0 e 2, 160 mg de Adalimumabe na semana 0 e 80 mg na semana 2, 80 mg na semana 0 e 40 mg na semana 2, e 40 mg na semana 0 e 20 mg na semana 2. No Estudo II21 de DC, 325 pacientes que tinham perdido resposta ou eram intolerantes ao infliximabe foram randomizados para receber ou 160 mg Adalimumabe na semana 0 e 80 mg na semana 2 ou placebo nas semanas 0 e 2. Em ambos estudos os resultados clínicos foram avaliados na semana 4.
Uma maior porcentagem de pacientes tratados com 160/80 mg de Adalimumabe alcançou a indução de remissão clínica, em comparação com o placebo na semana 4, independentemente dos pacientes serem virgens de tratamento com bloqueadores de TNF (Estudo I20 de DC), ou terem perdido resposta ou terem sido intolerantes ao infliximabe (Estudo II21 de DC) - Tabela L.
Tabela L: Indução de Remissão e Resposta Clínica nos Estudos I20 e II21 de DC (Porcentagem de Pacientes)
| - | Estudo I de DC | Estudo II de DC | ||
| Placebo N=74 |
Adalimumabe 160/80 mg N=76 |
Placebo N=166 |
Adalimumabe 160/80 mg N=159 |
|
| Semana 4 | ||||
| Remissão Clínica | 12% | 36%* | 7% | 21%* |
| Resposta Clínica (CDAI ≥ 70) | 34% | 58%** | 34% | 52%** |
Remissão clínica corresponde a CDAI < 150 e resposta clínica a diminuição de pelo menos 70 pontos no CDAI em relação à avaliação inicial.
* p < 0.001.
** p < 0.01.
A manutenção da remissão clínica foi avaliada no Estudo III22 de DC (M02-404). No Estudo III22 de DC, 854 pacientes receberam de forma aberta 80 mg de Adalimumabe na semana 0 e 40 mg na semana 2. Na semana 4 os pacientes foram randomizados para receber 40 mg em semanas alternadas, 40 mg todas as semanas, ou placebo com uma duração total do estudo de 56 semanas. Pacientes com resposta clinica (CR-70 = diminuição do CDAI ≥ 70) na semana 4 foram estratificados e analisados separadamente daqueles sem resposta clínica na semana 4.
No Estudo III22 de DC (CHARM), na semana 4, 58% (499/854) dos pacientes apresentavam resposta clínica e foram avaliados na análise primária. Os índices de manutenção da remissão e de resposta clínica estão representados na Tabela M. Os índices de remissão clínica permaneceram relativamente constantes independentemente de uma exposição prévia a um antagonista de TNF.
Tabela M: Manutenção de Remissão e Resposta Clínica no Estudo III22 de DC (Porcentagem de Pacientes)
| - | Placebo | 40 mg Adalimumabe em semanas alternadas | 40 mg Adalimumabe semanal |
| Semana 26 | N=170 | N=172 | N=157 |
| Remissão Clínica | 17% | 40%* | 47%* |
| Resposta Clínica (CDAI ≥ 70) | 28% | 54%* | 56%* |
| Semana 56 | N=170 | N=172 | N=157 |
| Remissão Clínica | 12% | 36%* | 41%* |
| Resposta Clínica (CDAI ≥ 70) | 18% | 43%* | 49%* |
Remissão clínica corresponde a CDAI < 150 e resposta clínica a diminuição de pelo menos 70 pontos no CDAI em relação à avaliação inicial.
* p < 0.001 para Adalimumabe vs placebo.
Nos Estudos I20 e II21 de DC, foi observada melhora estatisticamente significante na pontuação total do questionário específico para a doença inflamatória intestinal (IBDQ) alcançada na semana 4 nos pacientes randomizados para Adalimumabe 80/40 mg e 160/80 mg comparada a placebo. A melhora também foi vista nas semanas 26 e 56 no Estudo III de DC entre os grupos de tratamento Adalimumabe comparados com o grupo placebo. No Estudo III, houve também uma diminuição estatisticamente significante de hospitalização e cirurgias relacionadas à doença quando comparada com o placebo na Semana 5623.
No Estudo I20, 117/276 pacientes com DC e 272/777 pacientes do Estudo II21 e III22 foram acompanhados por pelo menos 3 anos em terapia aberta com Adalimumabe.
Respectivamente 88 (75,2%) e 189 (69,5%) pacientes, continuaram com remissão clínica. A resposta clínica foi mantida em 107 (91,5%) e 248 (91,2%) pacientes, respectivamente.
Os 117/854 pacientes (a partir de estudo DC III) apresentaram fístulas drenadas tanto na seleção como no baseline. Para a avaliação da cicatrização das fístulas, os dados de ambas as doses de Adalimumabe utilizados no estudo foram agrupados. A proporção de pacientes com cicatrização das fístulas na semana 26 foi estatística e significativamente maior em pacientes tratados com Adalimumabe [21/70 (30,0%)] em comparação com placebo [6/47 (12,8%)]. A cicatrização completa das fístulas foi mantida até a Semana 56 em 23/70 (32,9%) pacientes no grupo com Adalimumabe e 6/47 (12,8%) no grupo placebo.
Um estudo endoscópico (M05-769) que envolveu 135 pacientes, indicou um efeito de Adalimumabe na cicatrização da mucosa. 27,4% dos pacientes tratados com Adalimumabe tinham cicatrização da mucosa na semana 12 comparados com 13,1% dos pacientes-placebo (p=0,056), e 24,2% dos pacientes tratados com Adalimumabe na semana 52 contra 0% dos pacientes-placebo (p < 0,001)24.
Colite Ulcerativa ou Retocolite Ulcerativa
A segurança e eficácia de múltiplas doses de Adalimumabe foi testada em pacientes adultos com colite ulcerativa ou retocolite ulcerativa ativa moderada a grave (escore Mayo de 6 a 12 e com subtotal de endoscopia de 2 a 3 pontos) em dois estudos randomizados, duplo-cego, placebo controlados. Os pacientes tinham de ter um diagnóstico de colite ulcerativa por mais de 90 dias, confirmado por endoscopia. Eles tinham de ter a doença ativa apesar do tratamento com pelo menos um dos seguintes corticosteroides orais ou imunossupressores: prednisona, azatioprina ou 6 - mercaptopurina . Os pacientes foram excluídos da participação nos estudos se eles tinham uma história de colectomia subtotal com ileostomia ou proctocolectomia com reservatório ileal e anastomose ileoanal, bolsa de Koch ou ileostomia para retocolite ulcerativa ou se estava planejando uma cirurgia intestinal, ou se eles tinham um diagnóstico vigente de colite fulminante e / ou megacólon tóxico, colite indeterminada, ou doença de Crohn , se sua doença estava limitada ao reto (proctite ulcerativa), ou se eles estavam recebendo nutrição parenteral.
Pacientes com Clostridium difficile positivo no exame de fezes, infecções que requerem tratamento intravenoso , que tinha um histórico de malignidade tratada com sucesso diferente de carcinoma cutâneo de celulas escamosas não metastáticas ou basocelular e/ou carcinoma localizado no colo do útero , ou uma história de listeria, histoplasmose, infecção crônica ou ativa da hepatite B, vírus da imunodeficiência humana, síndrome da imunodeficiência, doenças desmielinizantes do sistema nervoso central, ou tuberculose não tratada (TB) também foram excluídos , bem como os pacientes cuja endoscopia mostrou evidências de displasia ou malignidade. No estudo UC-I25, 390 pacientes que nunca foram tratados com antagonistas de TNF foram randomizados para receber: placebo nas semanas 0 e 2 ou 160 mg de Adalimumabe na semana 0 seguido por 80 mg na semana 2, ou 80 mg Adalimumabe na semana 0 seguindo por 40 mg na semana 2. Depois da semana 2, pacientes que receberam Adalimumabe nas semanas anteriores, receberam 40 mg de Adalimumabe a cada 14 dias. A remissão clínica (definida como escore Mayo≤ 2 sem subtotal > 1) foi avaliada na semana 8.
No estudo UC-II26, 248 pacientes receberam 160 mg de Adalimumabe na semana 0, 80 mg na semana 2 e 40 mg a cada 14 dias nas semanas seguintes, e, 246 pacientes receberam placebo. Os resultados clínicos foram avaliados para indução de remissão na semana 8 e para manutenção da remissão na semana 52.
Indivíduos induzidos com 160/80 mg de Adalimumabe atingiram a remissão clínica versus o placebo na semana 8 em porcentagens estatistica e significativamente maiores no estudo UC-I (18% vs 9%, respectivamente, p=0.031) e no estudo UC-II (17% vs 9%, respectivamente, p=0,019). No estudo UC-II, entre os tratados com Adalimumabe que estavam em remissão na semana 8, 21/41 (51%) estavam em remissão na semana 52. Os resultados do estudo UC-II são apresentados na Tabela N tanto para população total quanto para pacientes que tinham respondido na semana 8 de tratamento por escore total Mayo.
Tabela N: Resposta, Remissão e Cicatrização de mucosa no estudo UC-II (Percentual de pacientes)
| - | Placebo | 40 mg de Adalimumabe em semanas alternadas, no geral | 40 mg de Adalimumabe em semanas alternadas, Responsivos na Semana 8 |
| Semana 52 | N=246 | N=248 | N=125 |
| Resposta Clínica | 18% | 30%* | 47% |
| Remissão Clínica | 9% | 17%* | 29% |
| Cicatrização de Mucosa | 15% | 25,0%* | 41% |
| Remissão sem esteroides para ≥ 90 diasa | 6% (N=140) |
13%* (N=150) |
20,0% |
|
Semana 8 e 52 |
N=246 |
N=248 |
N=125 |
| Resposta sustentada | 12% | 24%* | - |
| Remissão sustentada | 4% | 8%* | - |
| Cicatrização da mucosa sustentada | 11% | 19%* | - |
Remissão Clínica definida como escore Mayo ≤ 2 na ausência de subescore > 1.
Resposta clínica definida como diminuição do valor basal no escore Mayo ≥ 3 pontos e ≥ 30% além de um decréscimo no subescore de sangramento retal [SSR] ≥ 1 ou um SSR absoluto de 0 ou 1.
*p< 0,05 para Adalimumabe vs. Placebo em comparação pareada de proporção.
**p< 0,001 para Adalimumabe vs. Placebo em comparação pareada de proporção.
a Daqueles que recebiam corticosteroides no início do tratamento.
Aproximadamente 40% dos pacientes do estudo UC-II apresentaram falha da terapia primeiro com o tratamento com anti-TNF infliximabe. A eficácia de Adalimumabe nestes pacientes foi reduzida, quando comparada com os pacientes que não tiveram um tratamento prévio com antiTNF. Entre estes pacientes que haviam falhado no tratamento previo com anti-TNF, a remissão foi alcançada na semana 52 por 3% no grupo placebo e 10% no grupo com Adalimumabe.
Os pacientes dos estudos UC-I e UC-II tiveram a opção de continuar um estudo aberto de extensão de longo prazo (UC-III). Após três anos de tratamento com Adalimumabe, 74% (268/360) continuaram em remissão clínica por escore parcial Mayo.
Qualidade de Vida:
No estudo UC-II, uma melhora maior na nota total do questionário de doença específica para doença inflamatória intestinal (IBDQ) foi alcançada na semana 52 em pacientes randomizados para 160/80 mg de Adalimumabe comparado com placebo (p= 0,007).
Psoríase em Placas
A segurança e eficácia de Adalimumabe foram avaliadas em estudos duplo-cegos, randomizados, realizados em pacientes adultos com psoríase crônica em placas (envolvimento ≥ 10% BSA e Psoriasis Area and Severity Index (PASI) ≥ 12 ou ≥ 10) que eram candidatos a terapia sistêmica ou fototerapia. 73% dos pacientes envolvidos nos estudos de psoríase fase I e II receberam terapia sistêmica prévia ou fototerapia. A segurança e eficácia de Adalimumabe também foram avaliadas em estudos duplo-cegos, randomizados, realizado em pacientes adultos com psoríase crônica em placas moderada a grave com acometimento das mãos e/ou pés que eram candidatos a terapia sistêmica.27
O Estudo I28 de Psoríase (M03-656) avaliou 1212 pacientes durante três períodos de tratamento. No período A, os pacientes receberam placebo ou Adalimumabe na dose inicial de 80 mg seguida por 40 mg em semanas alternadas começando na semana 1, após a dose inicial. Após 16 semanas de terapia, os pacientes que alcançaram pelo menos uma resposta PASI 75 (melhora da pontuação PASI de pelo menos 75% em relação à avaliação inicial), entraram no período B e receberam de forma aberta 40 mg de Adalimumabe em semanas alternadas. Os pacientes que mantiveram resposta PASI ≥75 na semana 33 e que haviam sido originariamente randomizados para terapia ativa no Período A, foram novamente randomizados no Período C para receber 40 mg Adalimumabe em semanas alternadas ou placebo por mais 19 semanas.
Considerando os três grupos de tratamento, a pontuação PASI média, na avaliação inicial, foi de 18.9 e a Avaliação Médica Global (Physician’s Global Assessment - PGA) inicial variou de “moderada” (53% dos indivíduos incluídos), a “grave” (41%) e a “muito grave” (6%).
O Estudo II29 de Psoríase (M04-716) comparou a eficácia e segurança de Adalimumabe com metotrexato (MTX) e placebo em 271 pacientes. Os pacientes receberam placebo, uma dose inicial de MTX de 7.5 mg e, posteriormente, a dose era aumentada até a semana 12, com a dose máxima de 25 mg ou uma dose inicial de 80 mg de Adalimumabe seguida por 40 mg em semanas alternadas (iniciando uma semana após a dose inicial) durante 16 semanas. Não existem dados disponíveis sobre a comparação de Adalimumabe e MTX para além de 16 semanas de tratamento. Os pacientes recebendo MTX que atingissem uma resposta PASI ≥ 50 na semana 8 e/ou 12 não recebiam futuros aumentos de dose. Considerando os três grupos de tratamento, a pontuação PASI média, na avaliação inicial, foi de 19.7 e a Avaliação Médica Global (Physician’s Global Assessment - PGA) inicial variou de “moderada” (48% dos indivíduos incluídos), a “grave” (46%) e a “muito grave” (6%).
Pacientes dos Estudos de Psoríase de Fase II e III foram eleitos a participar de um estudo clínico de extensão aberto (M03-658), onde Adalimumabe foi administrado por pelo menos mais 108 semanas.
Nos Estudo I28 e II29 de Psoríase, o desfecho primário foi a proporção de pacientes que atingiram uma resposta PASI 75 na semana 16, em relação à avaliação inicial (ver Tabelas O e P).
Tabela O: Estudo I28 de Psoríase (REVEAL) - Resultados de Eficácia na Semana 16
| - | Placebo N=398 n (%) |
Adalimumabe 40 mg esa |
| PASI ≥ 75a | 26 (6,5) | 578 (70,9)b |
| PASI 100 | 3 (0,8) | 163 (20)b |
| PGA: Claro/mínimo | 17 (4,3) | 506 (62,2)b |
a A porcentagem de pacientes que atingiram resposta PASI 75 foi calulada como uma taxa centro ajustada.
b p<0.001 Adalimumabe vs. Placebo.
Tabela P: Estudo II29 de Psoríase (CHAMPION) - Resultados de Eficácia na Semana 16
| - | Placebo N=53 n (%) |
MTX N=110 n (%) |
Adalimumabe 40 mg esa N=108 n (%) |
| PASI ≥ 75 | 10 (18.9) | 39 (35.5) | 86 (79.6)a,b |
| PASI 100 | 1 (1.9) | 8 (7.3) | 18 (16.7)c,d |
| PGA: Claro/mínimo | 6 (11,3) | 33 (30,0) | 79 (73,1)a,b |
a p<0.001 Adalimumabe vs. placebo.
b p<0.001 Adalimumabe vs. MTX.
c p<0.01 Adalimumabe vs. placebo.
d p<0.05 Adalimumabe vs. MTX.
Um total de 233 de pacientes que atingiram a resposta PASI 75 na semana 16 e na semana 33 receberam continuamente Adalimumabe por 52 semanas no Estudo I de Psoríase e continuaram com a terapia em um estudo de extensão aberto. Após administração adicional por mais 108 semanas (no total de 160 semanas), 74,7% dos pacientes atingiram a resposta PASI 75 e 59,0% dos pacientes atingiram a Avaliação Médica Global (Physician’s Global Assessment - PGA) com resposta mínima ou nenhuma. Já no Estudo II de Psoríase, dos 94 pacientes, 58,1% atingiram a resposta PASI 75 e 46,2% atingiram a Avaliação Médica Global (Physician’s Global Assessment - PGA) com resposta mínima ou sem psoríase.
Um total de 347 pacientes estáveis e que responderam ao tratamento participaram de uma avaliação de retirada e retratamento em um estudo de extensão aberto. O tempo médio de recidiva (para PGA "moderado" ou pior) foi de aproximadamente 5 meses. Nenhum destes pacientes relatou efeito rebote durante o período de retirada. Um total de 76,5% (218/285) dos pacientes que iniciaram o período de retratamento obtiveram uma resposta da PGA "sem psoríase" ou "mínima", após 16 semanas de retratamento, independentemente de recaída durante a retirada [69,1% (123/178) e 88,8% (95/107) para pacientes que recaíram e que não recaíram durante o período de suspensão, respectivamente].
Em um estudo de extensão aberto, para pacientes que tiveram a frequência de dose aumentada de 40 mg a cada 14 dias para 40 mg semanal devido a uma resposta PASI abaixo de 50%, 26,4% (92/349) e 37,8% (132/349) dos pacientes atingiram uma resposta PASI 75 nas semanas 12 e 24, respectivamente.
Na semana 16 foram observadas melhoras estatisticamente significantes no Dermatology Life Quality Index (DLQI), em relação aos valores basais quando comparadas com placebo (Estudos I30 e II31) e MTX (Estudo II31). No Estudo I28 também foram evidenciadas melhoras no componente físico e mental da pontuação do SF-36 de forma estatisticamente significante, quando comparado ao placebo.
Em pacientes com psoríase em placas em monoterapia com Adalimumabe a longo prazo que participaram de um estudo de retirada e de retratamento, a taxa de anticorpos de Adalimumabe após o retratamento (2,3%) foi semelhante à taxa observada antes da retirada (1,9%).
O Estudo III27 de psoríase (REACH) comparou a eficácia e segurança de Adalimumabe versus placebo em 72 pacientes com psoríase em placas crônica moderada a grave e com psoríase nas mãos e/ou pés. Os pacientes receberam uma dose inicial de 80 mg de Adalimumabe seguido de 40 mg a cada duas semanas (começando uma semana após a dose inicial) ou placebo durante 16 semanas. Na semana 16, uma proporção estatísticamente significativa de pacientes que receberam Adalimumabe atingiram PGA de "claro" ou "quase claro" para as mãos e /ou pés em comparação com pacientes que receberam placebo (30,6% versus 4,3%, respectivamente [P = 0,014]).
O Estudo IV na Psoríase comparou a eficácia e segurança de Adalimumabe versus placebo em 217 pacientes adultos com psoríase ungueal moderada a grave. Os pacientes receberam uma dose inicial de 80 mg de Adalimumabe seguida de 40 mg em semanas alteradas (uma semana após a dose inicial) ou placebo durante 26 semanas seguidas de um tratamento em fase aberta com Adalimumabe durante mais 26 semanas.
Os pacientes do estudo tinham que ter psoríase em placas crônica de grau pelo menos moderado na escala PGA, comprometimento da unha de grau pelo menos moderado na Avaliação Médica Global da Psoríase Ungueal (PGA-F), um Índice de Gravidade da Psoríase Ungueal Modificado (mNAPSI) para a unha-alvo ≥ 8, e um envolvimento de BSA da pele de pelo menos 10% ou um envolvimento de BSA da pele de pelo menos 5% com uma pontuação mNAPSI total para todas as unhas ≥ 20.
As avaliações da psoríase ungueal incluíram o Índice de Gravidade da Psoríase Ungueal Modificada (mNAPSI) e a Avaliação Médica Global de Psoríase Ungueal (PGA-F). Uma proporção estatistica e significativamente maior de pacientes no grupo Adalimumabe atingiram pelo menos 75% de melhora na mNAPSI (mNAPSI 75) e uma PGA-F de “claro” ou “mínimo” com pelo menos 2 pontos de melhora em relação ao basal na Semana 26 quando comparado com placebo. A melhora percentual no NAPSI foi estatística e significativamente maior em pacientes com Adalimumabe quando comparados com placebo na Semana 16 (44,2% vs. 7,8%) e na Semana 26 ( 56,2% vs 11,5%).
Uma proporção estatística e significativamente maior de pacientes no grupo de Adalimumabe atingiram uma PGA-F de “claro” ou “mínimo” com pelo menos dois pontos de melhora a partir do baseline na Semana 26 quando comparado com placebo. Neste estudo, Adalimumabe demonstrou um tratamento benéfico para pacientes com psoríase ungueal com diferentes graus de envolvimento da pele (BSA ≥ 10% E BSA < 10% e ≥ 5%) e uma melhora estatistica e significativa em psoríase no couro cabeludo quando comparado com placebo.
Tabela Q: Resultados de Eficácia na Semana 26
|
Endpoint |
Placebo N = 108 |
Adalimumabe 40 mg semanas alternadas |
| ≥ mNAPSI 75 (%) | 3,4 | 46,6a |
| PGA-F claro/ mínimo e ≥ 2 pontos de melhora em relação ao basal (%) | 6,9 | 48,9a |
a p< 0.001, Adalimumabe vs. Placebo.
Os pacientes tratados com Adalimumabe mostraram uma melhora no Índice de Qualidade de Vida em Dermatologia (DLQI), na Semana 26, a partir da linha de base, quando comparados com o placebo. Entre aqueles pacientes que continuaram recebendo o tratamento com Adalimumabe até a Semana 52, as respostas mNAPSl 75 e PGA-F claro/ mínimo e > 2 pontos de melhora em relação ao basal foram mantidas.
Entre aqueles pacientes que continuaram recebendo o tratamento com Adalimumabe até a Semana 52, 65,0 % atingiram resposta em mNAPSI 75 e 61,3% atingiram resposta em PGA-F claro/ mínimo e ≥ 2 pontos de melhora em relação ao basal.
Hidradenite Supurativa
A segurança e eficácia de Adalimumabe foi avaliada através de estudos placebocontrolado, duplo cego e um estudo aberto de extensão em pacientes adultos com hidradenite supurativa (HS) moderada a grave que foram intolerantes, contraindicados ou com uma resposta inadequada à terapia antibiótica sistêmica. Os pacientes nos estudos HS-I e HS-II tiveram Estágio de Hurley II ou III com no mínimo três abcessos ou nódulos inflamatórios.
O estudo HS-I (M11-313) avaliou 307 pacientes em dois períodos de tratamento. No Período A, os pacientes receberam placebo ou Adalimumabe em uma dose inicial de 160 mg na Semana 0, 80 mg na Semana 2 e 40 mg a cada semana a partir da Semana 4 até a Semana 11. O uso concomitante de antibióticos não foi permitido durante o estudo. Após 12 semanas de tratamento, pacientes que receberam Adalimumabe no Período A foram randomizados novamente no Período B para um dos três grupos de tratamento (40 mg de Adalimumabe a cada semana, 40 mg de Adalimumabe em semanas alternadas ou placebo da Semana 12 à Semana 35). Os pacientes que foram randomizados para o placebo no Período A foram designados a receber 40 mg de Adalimumabe a cada semana no Período B.
O estudo HS-II (M11-810) avaliou 326 pacientes em dois períodos de tratamento. No Período A, pacientes receberam placebo ou Adalimumabe em uma dose inicial de 160 mg na Semana 0, 80 mg na Semana 2 e 40 mg a cada semana a partir da Semana 4 até a Semana 11. 19.3% dos pacientes continuaram a terapia oral de base com antibióticos durante o estudo. Após 12 semanas de tratamento, pacientes que receberam Adalimumabe no Período A foram randomizados novamente no Período B para um dos três grupos de tratamento (40 mg de Adalimumabe a cada semana, 40 mg de Adalimumabe em semanas alternadas ou placebo da Semana 12 à Semana 35). Os pacientes que foram randomizados para o placebo no Período A foram designados a receber placebo no Período B.
Os pacientes que participaram dos estudos HS-I e HS-II foram elegíveis para se inscrever em um estudo aberto de extensão no qual 40 mg de Adalimumabe foi administrado a cada semana. A exposição média em toda a população de Adalimumabe foi de 762 dias. Ao longo dos três estudos, os pacientes realizaram diariamente uma lavagem com antisséptico tópico.
Resposta Clínica:
A resposta clínica das lesões inflamatórias foi avaliada utilizando a Resposta Clínica de Hidradenite Supurativa (HiSCR: pelo menos uma redução de 50% na contagem total de abcessos e nódulos inflamatórios com nenhum aumento na contagem de abcessos e nenhum aumento na contagem de fístulas com relação ao baseline).
A redução da dor na pele relacionada com a HS foi avaliada em pacientes que entraram no estudo com uma pontuação inicial de 03 ou mais utilizando uma Escala de Classificação Numérica de 11 pontos.
Na Semana 12, um proporção significamente maior de pacientes tratados com Adalimumabe versus o placebo alcançaram a HiSCR. Na Semana 12, uma proporção significamente maior de pacientes no Estudo HS-II experimentaram uma diminuição clinicamente relevante da dor na pele relacionada com a HS (veja tabela a seguir). Os pacientes tratados com Adalimumabe apresentaram redução significativa no risco de agravamento da doença durante as primeiras 12 semanas de tratamento.
Tabela R: Resultados de Eficácia na Semana 12 nos Estudos HS-I e HS-II
| Desfecho | Estudo HS-I | Estudo HS-II | ||
| Placebo | 40 mg de Adalimumabe semanalmente | Placebo | 40 mg de Adalimumabe semanalmente | |
| Resposta Clínica de Hidradenite Supurativa (HiSCR)a | N = 154 40 (26,0%) |
N = 153 64 (41,8%)* |
N = 163 45 (27,6%) |
N = 163 96 (58,9%)*** |
| Redução da dor > 30%b | N = 109 27 (24,8%) |
N = 122 34 (27,9%) |
N = 111 23 (20,7%) |
N = 105 48 (45,7%)*** |
*P < 0,05, ***P< 0,001 para Adalimumabe vs. Placebo.
a Entre todos os pacientes randomizados.
b Entre os pacientes com baseline de avaliação de dor na pele relacionada a HS > 3, baseado na Escala de Classificação Numérica de 0-10 onde 0 = sem dor cutânea e 10 =a pior dor cutânea imaginável.
Entre os pacientes que foram randomizados para Adalimumabe com dose semanal contínua, a taxa de HiSCR global da Semana 12 foi mantida até a Semana 96. O tratamento à longo prazo com Adalimumabe 40 mg semanalmente por 96 semanas identificou novos achados de segurança.
Melhorias mais significativas na Semana 12 do baseline comparado com o placebo foram demonstrados em: qualidade de vida relacionado à saúde específica da pele, medida pelo Índice de Qualidade de Vida em Dermatologia (DLQI; Estudos HS-I e HS-II); a satisfação global do paciente com o tratamento medida pelo Questionário de Satisfação do Tratamento com o Medicamento (TSQM; Estudos HS-I e HS-II) e a saúde física, conforme medida pelo resumo do componente físico SF-36 (Estudo HS-I).
Uveíte
A segurança e eficácia de Adalimumabe foram avaliadas em pacientes adultos com uveíte não infecciosa intermediária, posterior e pan-uveíte (também conhecida como uveíte não infecciosa que afeta o segmento posterior), excluindo os pacientes com uveíte anterior isolada, em dois estudos randomizados, duplo cegos, placebo-controlados (Estudo UV I (M10-877) e Estudo UV II (M10-880)). Os pacientes receberam placebo ou Adalimumabe em uma dose inicial de 80 mg seguidos de 40 mg a cada duas semanas iniciando-se na semana seguinte à dose inicial. Foram permitidas doses concomitantes estáveis de imunossupressores não biológicos. O desfecho primário de eficácia em ambos os estudos foi o tempo para a falha do tratamento.
Seguindo o controle inicial da doença, um prolongamento no tempo para a falha do tratamento resultará na redução do risco de reaparecimento da inflamação, inflamação e perda de visão.
A falha do tratamento foi definida por um resultado multi-componente baseado em novas lesões ativas inflamatórias (coreorretinite), grau celular da câmara anterior (AC), grau de turvação vítrea (VH) e melhor correção da acuidade visual (BCVA).
O Estudo UV I avaliou 217 pacientes com uveíte ativa, apesar do tratamento com corticóides (prednisona oral com dose de 10 a 60 mg/dia). Todos os pacientes receberam uma dose padronizada de 60 mg/dia de prednisona no início do estudo seguidos por uma programação de redução obrigatória, até a completa descontinuação do corticoide na Semana 15.
O Estudo UV II avaliou 226 pacientes com uveíte inativa que exigiam tratamento crônico com corticóides (prednisona oral de 10 a 35 mg/dia) no baseline para controle da sua doença. Os pacientes foram submetidos posteriormente a uma programação de redução obrigatória até a completa descontinuação do corticóide na Semana 19.
Resposta Clínica:
Os resultados de ambos os estudos demonstratam uma redução estatisticamente significante do risco de falha do tratamento em pacientes tratados com Adalimumabe versus os pacientes que receberam placebo (veja tabela S). Os dois estudos demonstraram um efeito rápido e sustentado de Adalimumabe na taxa de falha do tratamento versus placebo.
Tabela S: Tempo para a Falha do Tratamento nos Estudos UV I e UV II
| Análise do tratamento | N | Falha N (%) | Média do tempo de falha (meses) | HRa | CI 95% para HR | Valor pb |
|
Tempo para Falha do Tratamento a partir da Semana 06 no Estudo UV I |
||||||
|
Análise Primária (ITT) |
||||||
| Placebo | 107 | 84 (78,5) | 3,0 | -- | -- | -- |
|
Adalimumabe |
110 | 60 (54,5) | 5,6 | 0,50 | 0,36; 0,70 | < 0,001 |
|
Tempo para Falha do Tratamento a partir da Semana 02 no Estudo UV II |
||||||
|
Análise Primária (ITT) |
||||||
| Placebo | 111 | 61 (55,0) | 8,3 | -- | -- | -- |
|
Adalimumabe |
115 | 45 (39,1) | NEc | 0,57 | 0,39; 0,84 | 0,004 |
Nota: A falha do tratamento a partir da Semana 06 (Estudo UV I), ou a partir da Semana 02 (Estudo UV II) foi considerada como um evento. Desistências devido à outras razões que não a falha do tratamento foram censuradas no momento da desistência.
a HR (hazard ratio) de Adalimumabe vs placebo de regressão de riscos proporcionais com o tratamento como fator.
b 2-side P value a partir do teste log rank.
c NE = não estimado. Menos da metade dos pacientes em situação de risco teve um evento.
Figura 02: Curvas de Kaplan-Meier resumindo o tempo para a falha do tratamento a partir da Semana 06 (Estudo UV I) ou a partir da Semana 02 (Estudo UV II)
Em ambos os estudos, todos os componentes para o desfecho primário contribuíram acumulativamente para a diferença global entre os grupos Adalimumabe e placebo (Tabela T).
Tabela T: Componentes de Falha do Tratamento nos Estudos UV I e UV II
| - | UV I | UV II | ||||
| Componente de Tempo para Falha do Tratamento | HRa | CI | Valor pb | HRa | CI | Valor pb |
| Novas Lesões Ativas Inflamatórias | 0,38 | (0,21 – 0,69) | 0,001 | 0,55 | (0,26 – 1,15) | 0,105 |
| Grau celular da câmara anterior | 0,51 | (0,30 – 0,86) | 0,01 | 0,7 | (0,42 – 1,18) | 0,18 |
| Grau de turvação vitrea | 0,32 | (0,18 – 0,58) | < 0,001 | 0,79 | (0,34 – 1,81) | 0,569 |
| Melhor Correção da Acuidade Visual | 0,56 | (0,32 – 0,98) | 0,04 | 0,33 | (0,16 – 0,70) | 0,002 |
Nota: A falha do tratamento a partir da Semana 06 (Estudo UV I), ou a partir da Semana 02 (Estudo UV II) foi considerada como um evento. Desistências devido à outras razões que não a falha do tratamento foram censuradas no momento da desistência.
a HR (hazard ratio) de Adalimumabe vs placebo de regressão de riscos proporcionais com o tratamento como fator.
b 2-side P value a partir do teste log rank.
Adicionalmente, no Estudo UV I, uma diferença estatisticamente relevante a favor de Adalimumabe versus o placebo foi observada para mudanças no grau celular de AC, grau de turvação vítrea e logMAR BCVA (média da alteração do melhor estado antes da Semana 06 até a visita final; Valores p: 0,011, < 0,001 e 0,003, respectivamente.
Dos 417 indivíduos incluídos na extensão sem controle a longo prazo dos Estudos UV I e UV II, 46 indivíduos foram considerados inelegíveis (por exemplo, desenvolveram complicações secundárias à retinopatia diabética, devido a cirurgia de catarata ou vitrectomia) e foram excluídos da análise primária de eficácia. Dos 371 pacientes restantes, 276 pacientes avaliáveis atingiram 78 semanas de tratamento com tratamento aberto de Adalimumabe. Com base na abordagem de dados observados, 222 (80,4%) estavam em quiescência (sem lesões inflamatórias ativas, grau de células AC ≤ 0,5+, grau VH ≤ 0,5+) com dose concomitante de esteróides ≤ 7,5 mg por dia e 184 (66,7%) estavam em quiescência livre de esteróides. O BCVA foi melhorado ou mantido (deterioração <5 letras) em 88,4% dos olhos na semana 78. Entre os pacientes que interromperam o estudo antes da semana 78, 11% interromperam devido a eventos adversos e 5% devido à resposta insuficiente ao tratamento com Adalimumabe.
Qualidade de Vida:
No Estudo UV I, o tratamento com Adalimumabe resultou em manutenção das funções relacionadas à visão e a qualidade de vida relacionada à saúde, como medido pela NEI VFQ-25.
Pediátricos
Artrite Idiopática Juvenil Poliarticular
A segurança e eficácia de Adalimumabe foi avaliada em dois estudos (AIJp I e II) em crianças com artrite idiopática juvenil poliarticular (AIJ) ativa ou em curso, que tiveram uma variedade de tipos de início de AIJ (mais frequentemente poliartrite com fator reumatoide negativo ou positivo e oligoartrite estendida).
AIJp I:
A segurança e eficácia de Adalimumabe foram avaliadas em um estudo34 multicêntrico, randomizado, duplo-cego, de grupos paralelos, em 171 crianças (de 04 a 17 anos de idade) com artrite idiopática juvenil poliarticular (AIJ). Na fase aberta introdutória (OL LI), os pacientes foram divididos em 2 grupos, os tratados com MTX (metotrexato) e os não tratados com MTX. Os pacientes que estavam no grupo dos não tratados com MTX, eram pacientes que nunca tinham recebido MTX ou que haviam suspendido o seu uso por pelo menos 2 semanas antes da administração da droga do estudo. Os pacientes mantiveram as doses regulares de AINEs e/ou prednisona (≤ 0,2 mg/Kg/ dia ou 10 mg/dia no máximo). Na fase OL LI, todos os pacientes receberam 24 mg/m2 até no máximo 40 mg de Adalimumabe, a cada 14 dias por 16 semanas. A distribuição dos pacientes por idade e dose mínima, média e máxima recebida durante a fase OL LI está descrita na tabela U.
Tabela U: Distribuição de pacientes por idade e dose recebida de Adalimumabe durante a fase OL-LI
| Idade do grupo | Número de pacientes no início (%) | Dose mínima, média e máxima |
| 04 a 07 anos | 31 (18,1) | 10, 20 e 25 mg |
| 08 a 12 anos | 71 (41,5) | 20, 25 e 40 mg |
| 13 a 17 anos | 69 (40,4) | 25, 40 e 40 mg |
Pacientes que demonstraram uma resposta pediátrica ACR 30 na 16º semana foram elegíveis para serem randomizados para a fase duplo-cego e receberam Adalimumabe 24 mg/ m2 até o máximo de 40 mg ou placebo, a cada 14 dias por um período adicional de 32 semanas ou até o agravamento da doença. O critério para o agravamento da doença foi definido como uma piora de ≥ 30% em relação à avaliação inicial em ≥ 3 de 6 critérios principais do ACR pediátrico, ≥ 2 articulações ativas, e melhora > 30% em não mais que 1 dos 6 critérios. Após 32 semanas ou até o agravamento da doença, os pacientes foram eleitos para se inscreverem na fase de extensão aberta.
Tabela V: Resposta Ped ACR 30 nos estudo AIJ
a Resposta Ped ACR 30/50/70 na 48º semana significativamente superior que aqueles pacientes tratados com placebo.
b p = 0,015.
c p = 0,031.
Entre aqueles que responderam até a 16º semana (n = 144), a resposta pediátrica ACR 30/50/90 foi mantida por até seis anos na fase OLE em pacientes que receberam Adalimumabe ao longo do estudo. No geral, 19 pacientes foram tratados por seis anos ou mais, sendo 11 dos 19 pacientes estando no grupo de faixa etária de 04 a 12 anos e os oito restantes, no grupo de faixa etária entre 13 e 17 anos.
As respostas gerais foram geralmente melhores, e menos pacientes desenvolveram anticorpos quando tratados com a combinação de Adalimumabe e MTX comparados com Adalimumabe isoladamente. 27 dos 171 pacientes (15,8%) apresentaram pelo menos um teste positivo para anticorpos anti-adalimumabe nas primeiras 48 semanas do estudo. A porcentagem foi de 5,9% (5/85) na população que recebeu MTX e de 25,6% (22/86) na população sem MTX. A taxa total foi maior que aquela observada nos estudos em adultos com artrite reumatoide (RA). As concentrações médias de Adalimumabe nos indivíduos anticorpos anti-adalimumabe positivos foi menor que nos negativos e declinaram a níveis negligenciáveis na maioria dos pacientes anticorpos anti-adalimumabe positivos após a identificação da primeira amostra positiva. Isso pode ter tido impacto na eficácia do produto nessa população, pois a proporção de indivíduos que alcançaram resposta PedACR30 na semana 16 foi menor nos pacientes anticorpos anti-adalimumabe positivos (63,2% comparado a 86,8% nos pacientes anticorpos anti-adalimumabe negativos). Isso também refletiu nos resultados da semana 48 (42,9% vs 64,8%). As taxas de descontinuação devido a eventos adversos, inclusive os graves, foram semelhantes nos pacientes anticorpos anti-adalimumabe positivos e negativos. Considerando estes resultados, Adalimumabe é recomendado para o uso em combinação com MTX e para o uso como monoterapia em pacientes cujo o uso de MTX não é apropriado.
AIJp II:
A segurança e eficácia de Adalimumabe foram avaliadas em um estudo aberto, multicêntrico35 com 32 crianças (2 a < 4 anos de idade ou com idade acima de 4 e peso < 15 kg) com AIJ poliarticular ativa de intensidade moderada a grave. Os pacientes receberam 24 mg/m2 de área de superfície corporal (ASC) de Adalimumabe até um máximo de 20 mg a cada 14 dias em dose única por via subcutânea, por um período mínimo de 24 semanas. Durante o estudo, a maioria dos pacientes utilizaram metotrexato concomitantemente, com pouco reporte de uso de corticosteróides ou AINEs.
Na Semana 12 e na Semana 24, a resposta ACR Pediátrica 30 foi de 93,5% e 90,0%, respectivamente, utilizando a abordagem dos dados observados. As proporções dos pacientes com ACR Pediátrica de 50/70/90 na Semana 12 e na Semana 24 foi de 90,3%/61,3%/38,7% e 83,3%/73,3%/36,7%, respectivamente. Entre aqueles que responderam (ACR Pediátrica 30) na Semana 24 (n=27 dos 30 pacientes), a resposta ACR Pediátrica 30 foi mantida por até 60 semanas, na fase aberta do estudo, em pacientes que receberam Adalimumabe durante este período de tempo. Em geral, 20 pacientes foram tratados durante 60 semanas ou mais.
Artrite relacionada a Entesite
A segurança e eficácia de Adalimumabe foram avaliadas em um estudo multicêntrico, randomizado, duplo-cego, em 46 pacientes pediátricos (com 6 a 17 anos de idade) com artrite relacionada à entesite. Os pacientes foram distribuídos aleatoriamente para receber cada um 24 mg/m2 de área de superfície corporal (ASC) de Adalimumabe até um máximo de 40 mg, ou placebo a cada 14 dias, durante 12 semanas. O período duplo-cego foi seguido por um período aberto (OL), durante o qual os pacientes receberam 24 mg/m2 por ASC de Adalimumabe até um máximo de 40 mg por via subcutânea a cada 14 dias por um período adicional de até 192 semanas. O endpoint primário foi definido pela alteração da porcentagem, do número de articulações ativas com artrite (inchaço não devido à deformidade ou articulações com perda de movimento somado à dor e/ou sensibilidade), até a Semana 12 a partir do baseline, que foi alcançada com a diminuição percentual média de -62,6% em pacientes no grupo Adalimumabe comparado a -11,6% em pacientes do grupo placebo. Melhora no número de articulações ativas com artrite foi mantida durante o período aberto do estudo até a semana 156. A maioria dos pacientes demonstraram melhora clínica nos endpoints secundários, tais como número de locais com entesite, contagem de articulações sensíveis (TJC), contagem de articulações inchadas (SJC), resposta pediátrica ACR 50 e resposta pediátrica ACR 70, mantendo-se essas melhorias durante o período OL até a Semana 156 do estudo.
Doença de Crohn
Adalimumabe foi avaliado em um estudo clínico duplo-cego, randomizado, multicêntrico36 desenhado para avaliar a eficácia e segurança na indução e no tratamento de manutenção com doses dependentes do peso corporal (< 40 kg ou ≥ 40 kg) em 192 pacientes pediátricos entre 06 e 17 (inclusive) anos, com doença de Crohn de intensidade moderada a grave classificada como PCDAI > 30 (Pediatric Crohn’s Disease Activity Index - PCDAI). Neste estudo, os pacientes tiveram que apresentar falha com a terapia convencional (incluindo um corticosteroide e/ou um imunomodulador) para Doença de Crohn. Além disso, os pacientes incluídos no estudo tiveram ou não tratamento prévio com infliximabe. Aqueles pacientes tratados previamente com infliximabe também deveriam apresentar perda de resposta prévia ou serem intolerantes ao infliximabe, no entanto aqueles que não apresentaram uma resposta inicial, foram excluídos do estudo.
Todos os pacientes receberam terapia de indução no braço aberto do estudo com dose baseada no peso corporal: 160 mg na Semana 0 e 80 mg na Semana 2 para pacientes com peso ≥ 40 kg e, 80 mg e 40 mg respectivamente, para pacientes com peso < 40kg.
Na semana 4, os pacientes foram randomizados 1:1 com base no seu peso corporal, no momento do regime de manutenção, com Dose Inferior ou Dose Padrão, conforme apresentado na tabela a seguir.
Tabela W: Regimes de Manutenção
| Peso do Paciente | Dose Inferior | Dose Padrão |
| < 40 kg | 10 mg a cada 14 dias | 20 mg a cada 14 dias |
| ≥ 40 kg | 20 mg a cada 14 dias | 40 mg a cada 14 dias |
Os pacientes incluídos no estudo puderam escalonar a dose em caso de não resposta até a semana 12. O escalonamento de dose não foi permitido antes da semana 12 no estudo.
Resultados de Eficácia:
O endpoint primário do estudo foi a remissão clínica na Semana 26, definida como PCDAI ≤ 10.
As taxas de remissão clínica e resposta clínica (definida como redução no PCDAI para no mínimo 15 pontos do baseline) são apresentadas na Tabela V. Taxas de descontinuação de corticosteróides ou imunomoduladores são apresentados na Tabela X.
Tabela X: Estudo de DC na Pediatria - Remissão e Resposta Clínica por PCDAI (população ITT, NRI)
| - | Dose Padrão 40/20 mg a cada 14 dias N = 93 |
Dose Inferior 20/10 mg a cada 14 dias N = 95 |
Resultado geral N = 188 |
Valor p* |
| Semana 26 | ||||
| Remissão Clínica | 38,7% | 28,4% | 33,5% | 0,075 |
| Resposta Clínica | 59,1% | 48,4% | 53.7% | 0,073 |
| Semana 52 | ||||
| Remissão Clínica | 33,3% | 23,2% | 28.2% | 0,100 |
| Resposta Clínica | 41,9% | 28,4% | 35.1% | 0,038 |
* Valor p de comparação da Dose Padrão versus Dose Inferior.
Para pacientes com PCDAI Baseline (Mediano) ≥ 40 (pacientes com doença de Crohn grave), a Dose Padrão foi mais efetiva do que a Dose Inferior na Semana 52 para a remissão clínica e resposta clínica (Tabela Y).
Tabela Y: Manutenção da Remissão e Resposta Clínica pelo PCDAI Baseline na Semana 52 no Estudo de DC na Pediatria
| - | PCDAI Baseline < 40 (Doença de Crohn Moderada) | PCDAI Baseline ≥ 40 (Doença de Crohn Grave) | ||||
| Dose Padrão (40/20 mg a cada 14 dias) N=39) |
Dose Inferior (20/10 mg a cada 14 dias) N=41) |
Valor P | Dose Padrão (40/20 mg a cada 14 dias) N=54) |
Dose Inferior (20/10 mg a cada 14 dias) N=54) |
Valor p* | |
| Remissão Clínica | 35,9% | 36,6% | 0,949 | 31,5% | 13,0% | 0,021* |
| Resposta Clínica | 46,2% | 41,5% | 0,673 | 38,9% | 18,5% | 0,019* |
* Valor p de comparação da Dose Padrão versus Dose Inferior pelo teste Chi-Square.
Tabela Z: Estudo de DC Pediátrico – Descontinuação de Corticosteróides ou Imunomoduladores e Remissão das Fístulas
| - | Dose Padrão (40/20 mg a cada 14 dias | Dose Inferior (20/10 mg a cada 14 dias | Valor p1 |
| Descontinuação de corticosteróides | N=33 | N=38 | - |
| Semana 26 | 84,8% | 65,8% | 0,066 |
| Semana 52 | 69,7% | 60,5% | 0,420 |
| Descontinuação de Imunomodulador2 | N=60 | N=57 | - |
| Semana 52 | 30,0% | 29,8% | 0,983 |
| Remissão das fístulas3 | N=15 | - | - |
| Semana 26 | 46,7% | 38,1% | 0,608 |
| Semana 52 | 40,0% | 23,8% | 0,303 |
1 valor de p para doses padronizadas versus dose baixa de comparação.
2 A terapia imunosupressora apenas poderia ser descontinuada durante ou após a semana 26 a critério do investigador se o sujeito alcançar o critério de resposta clínica.
3 definido como um fechamento de todas as fístulas que estavam drenando no baseline durante pelo menos 2 visitas consecutivas após o baseline.
Aumentos estatisticamente significantes (melhoria) do Baseline até a Semana 26 e 52 no índice de massa corporal e na velocidade do crescimento foram observados em ambos os grupos de tratamento. Melhorias estatística e clinicamente significantes do Baseline foram também observadas em ambos os grupos de tratamento para os parâmetros de qualidade de vida (incluindo IMPACT III).
Os pacientes do Estudo de doença de Crohn Pediátrico tiveram a opção de continuar em um estudo aberto de longo prazo de extensão. Após 05 anos de terapia com Adalimumabe, 74% (37/50) dos pacientes continuaram a apresentar remissão clínica e 92% (46/50) dos pacientes contiruaram a manter uma resposta clínica para PCDAI.
Uveíte Pediátrica
A segurança e eficácia de Adalimumabe foram avaliadas em um estudo controlado37, randomizado, duplo-cego, realizado em 90 pacientes pediátricos de 02 a < 18 anos com uveíte não infecciosa anterior, associada à AIJ ativa, que foram refratários a pelo menos 12 semanas de tratamento com metotrexato. Os pacientes receberam placebo ou 20 mg de Adalimumabe (se < 30 kg) ou 40 mg de Adalimumabe (se > 30 kg) em semanas alternadas em associação com a dose inicial de metotrexato.
O desfecho primário foi o "tempo até falha do tratamento". Os critérios que determinaram a falha do tratamento foram a piora ou a ausência de melhora sustentada da inflamação ocular, ou melhora parcial com desenvolvimento de comorbilidades oculares sustentadas, ou agravamento das comorbilidades oculares, o uso de medicamentos concomitantes não permitidos e suspensão do tratamento por um longo período de tempo.
Resposta Clínica:
O Adalimumabe retardou significativamente o tempo até a falha do tratamento, quando comparado com o placebo (veja Figura 3, p <0,0001 a partir do teste Log Rank). O tempo médio até a falha do tratamento foi de 24,1 semanas para os indivíduos tratados com placebo, enquanto que o tempo médio até a falha do tratamento não foi calculável para os pacientes tratados com Adalimumabe porque menos da metade destes indivíduos experimentaram falha do tratamento. O Adalimumabe diminuiu significativamente o risco de falha do tratamento em 75% em relação ao placebo, conforme demonstrado pela razão de risco (HR = 0,25 [95% CI: 0,12; 0,49]).
Figura 3: Curvas de Kaplan-Meier resumindo o tempo de falha do tratamento no estudo UV Pediátrico
Imunogenicidade
A formação de anticorpos anti-adalimumabe está associada ao aumento da depuração e redução da eficácia de Adalimumabe. Não há aparente correlação entre a presença destes anticorpos e eventos adversos.
Considerando que a análise da imunogenicidade é específica ao produto, a comparação das taxas de anticorpos com aqueles de outros medicamentos não é apropriada.
Adultos
Pacientes que participaram dos estudos I, II e III de artrite reumatoide foram testados para formação de anticorpos anti-adalimumabe em diversos pontos durante o período de 6 a 12 meses. Nos estudos pivotais, anticorpos anti-adalimumabe foram identificados em 5,5% (58/1053) dos pacientes tratados com Adalimumabe, em comparação com 0,5% (2/370) em pacientes que receberam placebo. Em pacientes que não fizeram uso concomitante de metotrexato, a incidência foi de 12,4% em comparação com 0,6% quando o Adalimumabe foi utilizado em associação com metotrexato.
Em pacientes com artrite psoriásica, anticorpos anti-adalimumabe foram identificados em 10% (38/376) de pacientes tratados com Adalimumabe. Em pacientes que não fizeram uso concomitante de metotrexato, a incidência foi de 13,5% (24/178), em comparação com 7% (14/198) em pacientes que receberam Adalimumabe em associação com metotrexate.
Para pacientes com espondilite anquilosante, os anticorpos anti-adalimumabe foram identificados em 8,3% (17/204) dos pacientes sob terapia com Adalimumabe. Pacientes que não receberam tratamento concomitante de metotrexato apresentaram incidência de 8,6% (16/185), em comparação com 5,3% (1/19) quando o metotrexato foi utilizado juntamente ao Adalimumabe.
Em pacientes com espondiloartrite axial não radiográfica, anticorpos anti-adalimumabe foram identificados em 8/152 indivíduos (5,3%) que foram tratados continuamente com adalimumabe.Em pacientes com doença de Crohn, anticorpos anti-adalimumabe foram identificados em 2,6% (7/26.9) dos pacientes tratados com Adalimumabe, enquanto que nos pacientes com colite ulcerativa ativa moderada a grave, a taxa de desenvolvimento de anticorpos anti-adalimumabe foi de 5,0%.
Em pacientes com psoríase anticorpos, anti-adalimumabe foram identificados em 8,4% (77/920) dos pacientes tratados com Adalimumabe sem uso concomitante de metotrexato. Em pacientes com psoríase em placas, sob uso prolongado de Adalimumabe sem administração concomitante de metotrexato que participaram de estudo de retirada e retomada de tratamento, a taxa de anticorpos anti-adalimumabe após a retomada da terapia foi de 2,3% e foi similar à taxa de 1,9% observada antes da retirada do tratamento
Em pacientes com hidradenite supurativa moderada a grave, anti-adalimumabe foram identificados em 10.1% (10/99) dos pacientes tratados com Adalimumabe.
Em pacientes com uveíte não infecciosa, anticorpos anti-adalimumabe foram identificados em 4,8% (12/249) dos pacientes tratados com Adalimumabe.
Pediátricos
Em pacientes com artrite idiopática juvenil poliarticular com idade entre 04 a 17 anos, foram identificados anticorpos anti-adalimumabe em 16% dos pacientes tratados com Adalimumabe. Em pacientes que não receberam metotrexato concomitantemente à terapia com Adalimumabe, a incidência foi de 26% em comparação a incidência de 6% observada quando o Adalimumabe foi utlizado juntamente ao metotrexato. Em pacientes com idade entre 02 a 04 anos ou com mais de 04 anos de idade e com peso abaixo de 15 kg, anticorpos anti-adalimumabe foram identificados em 7% (1/15) dos pacientes e este único paciente também recebeu metotrexato concomitantemente ao tratamento com Adalimumabe.
Em pacientes pediátricos com doença de Crohn ativa moderada a grave, a taxa de desenvolvimento de anticorpos anti-adalimumabe em pacientes tratados com Adalimumabe foi de 3,3%.
Referências Bibliográficas
Reumatologia
1. Weinblatt ME, Keystone EC, Furst DE, et al. Adalimumab, a fully human anti-tumor necrosis factor monoclonal antibody, for the treatment of rheumatoid arthritis in patients taking concomitant methotrexate: the ARMADA trial. Arthritis Rheum. 2003;48(1):35-45.
2. van de Putte LB, Atkins C, Malaise M, et al. Efficacy and safety of adalimumab as monotherapy in patients with rheumatoid arthritis for whom previous disease modifying antirheumatic drug treatment has failed. Ann Rheum Dis. 2004;63(5):508–16.
3. Keystone EC, Kavanaugh AF, Sharp JT, et al. Radiographic, clinical, and functional outcomes of treatment with adalimumab (a human anti-tumor necrosis factor monoclonal antibody) in patients with active rheumatoid arthritis receiving concomitant methotrexate therapy: a randomized, placebo-controlled, 52-week trial. Arthritis Rheum. 2004;50(5):1400-11.
4. Furst DE, Schiff MH, Fleischmann RM, et al. Adalimumab, a fully human anti tumor necrosis factor-alpha monoclonal antibody, and concomitant standard antirheumatic therapy for the treatment of rheumatoid arthritis: results of STAR (Safety Trial of Adalimumab in Rheumatoid Arthritis). J Rheumatol. 2003;30(12):2563-71.
5. Breedveld FC, Weisman MH, Kavanaugh AF, et al. The PREMIER study: A multicenter, randomized, double-blind clinical trial of combination therapy with adalimumab plus methotrexate versus methotrexate alone or adalimumab alone in patients with early, aggressive rheumatoid arthritis who had not had previous methotrexate treatment. Arthritis Rheum. 2006;54(1):26-37.
6. Keystone EC, et al. Inhibition of radiographic progression in patients with longstanding rheumatoid arthritis treated with adalimumab plus methotrexate for 5 Years. Ann Rheum Dis. 2007;66(Suppl II):176.
7. Mease PJ, Gladman DD, Ritchlin CT, et al. A. Adalimumab for the treatment of patients with moderately to severely active psoriatic arthritis: results of a double blind, randomized, placebo-controlled trial. Arthritis Rheum. 2005;52(10):3279-89.
8. Genovese MC, Mease PJ, Thomson GT, et al. Safety and efficacy of adalimumab in treatment of patients with psoriatic arthritis who had failed disease modifying antirheumatic drug therapy. J Rheumatol. 2007;34(5):1040-50.
9. Mease PJ, Ory P, Sharp JT, et al. Adalimumab for long-term treatment of psoriatic arthritis: two-year data from the Adalimumab Effectiveness in Psoriatic Arthritis Trial (ADEPT). Ann Rheum Dis. 2009 May;68(5):702-9.
10. Gladman DD, Mease PJ, Ritchlin CT, et al. Adalimumab for long-term treatment of psoriatic arthritis: forty-eight week data from the adalimumab effectiveness in psoriatic arthritis trial. Arthritis Rheum. 2007;56(2):476-88.
11. van der Heijde D, Kivitz A, Schiff MH, et al. Efficacy and safety of adalimumab in patients with ankylosing spondylitis: Results of a multicenter, randomized, double blind, placebo-controlled trial. Arthritis Rheum. 2006;54(7):2136-46.
12. Lambert RG, Salonen D, Rahman P, et al. Adalimumab significantly reduces both spinal and sacroiliac joint inflammation in patients with ankylosing spondylitis: a multicenter, randomized, double-blind, placebo-controlled study. Arthritis Rheum. 2007;56(12):4005-14.
13. Maksymowych WP, Rahman P, Shojania K, et al. Beneficial effects of adalimumab on biomarkers reflecting structural damage in patients with ankylosing spondylitis. J Rheumatol. 2008;35(10):2030-7.
14. van der Heidje D, et al. Adalimumab effectiveness for the treatment of ankylosing spondylitis is maintained for up to 2 years: long-term results from the ATLAS trial. Ann Rheum Dis. Publicado online em 13/08/2008. doi:10.1136/ard.2007.087270
15. Revicki DA, Luo MP, Wordsworth P, et al. Adalimumab reduces pain, fatigue, and stiffness in patients with ankylosing spondylitis: results from the adalimumab trial evaluating long-term safety and efficacy for ankylosing spondylitis (ATLAS). J Rheumatol. 2008;35(7):1346-53.
16. Davis JC Jr, Revicki D, van der Heijde DM, et al. Health-related quality of life outcomes in patients with active ankylosing spondylitis treated with adalimumab: results from a randomized controlled study. Arthritis Rheum. 2007;57(6):1050-7.
17. Sieper J, van der Heijde D, Dougados M et al. Efficacy and safety of adalimumab in patients with non-radiographic axial spondyloarthritis: results of a randomised placebocontrolled trial (ABILITY-1). Ann Rheum Dis 2012;0:1–8. doi:10.1136/annrheumdis-2012-201766.
18. Sieper J., van der Heijde D, Dougados M. et al. Sustained efficacy of adalimumab in patients with non-radiographic axial spondyloarthritis: Week 68 results from Ability 1. Ann Rheum Dis 2012;71(Suppl3):248.
19. Dados de arquivo.
Doença de Crohn adulto
20. Hanauer SB, Sandborn WJ, Rutgeerts P, et al. Human anti-tumor necrosis factor monoclonal antibody (adalimumab) in Crohn's disease: the CLASSIC-I trial. Gastroenterology. 2006;130(2):323–33.
21. Sandborn WJ, Rutgeerts P, Enns R, et al. Adalimumab induction therapy for Crohn disease previously treated with infliximab: a randomized trial. Ann Intern Med. 2007;146(12):829-38.
22. Colombel JF, Sandborn WJ, Rutgeerts P, et al. Adalimumab for maintenance of clinical response and remission in patients with Crohn's disease: the CHARM trial. Gastroenterology. 2007;132(1):52-65.
23. Feagan BG, Panaccione R, J Sandborn WJ, et al. Effects of Adalimumab Therapy on Incidence of Hospitalization and Surgery in Crohn’s Disease: Results From the CHARM Study. Gastroenterology. 2008;135:1493–9.
24. Rutgeerts P, D'Haens GR, Van Assche GA, et al. Adalimumab Induces and Maintains Mucosal Healing in Patients with Moderate to Severe Ileocolonic Crohn's Disease - First Results of the Extend Trial. Gastroenterology. 2009;136 (5 Suppl 1):A-116.
Colite ulcerativa ou retocolite ulcerativa
25. Reinisch W, Sandborn WJ, Hommes DW, et al. Adalimumab for induction of clinical remission in moderately to severely active ulcerative colitis: results of a randomised controlled trial. Gut. 2011 Jun;60(6):780-7.
26. Sandborn WJ, van Assche G, Reinisch W, el al. Adalimumab Induces and Maintains Clinical Remission in Patients With Moderate-to-Severe Ulcerative Colitis. Gastroenterology. 2012 Feb;142(2):257-65.e1-3.
Psoríase
27. Poulin Y, Crowley J.J, Langley R.G, et al. Efficacy of adalimumab across subgroups of patients with moderate-to-severe chronic plaque psoriasis of the hands and/or feet: post hoc analysis of REACH. J EU Acad Dermatol. Venereol. 2014;28: 882-890.
28. Menter A, Tyring SK, Gordon K, et al. Adalimumab therapy for moderate to severe psoriasis: A randomized, controlled phase III trial. J Am Acad Dermatol. 2008;58(1):106-15.
29. Saurat JH, Stingl G, Dubertret L, et al. Efficacy and safety results from the randomized controlled comparative study of adalimumab vs. methotrexate vs.placebo in patients with psoriasis (CHAMPION). Br J Dermatol. 2008;158(3):558–66.
30. Revicki D, Willian MK, Saurat JH, et al. Impact of adalimumab treatment on healthrelated quality of life and other patient-reported outcomes: results from a 16 week randomized controlled trial in patients with moderate to severe plaque psoriasis. Br J Dermatol. 2008;158(3):549–57.
31. Revicki DA, Willian MK, Menter A, et al..Impact of adalimumab treatment on patientreported outcomes: results from a Phase III clinical trial in patients with moderate to severe plaque psoriasis. J Dermatolog Treat. 2007;18(6):341-50.
Uveíte
32. Jaffe, Glenn J; Thorne, Jennifer E.; Scales David; et al. Adalimumab in Patients With Active, Non-infectious Uveitis Requiring High-dose Corticosteroids: the VISUAL-1 Trial. Investigative Ophthalmology & Visual Science June 2015, Vol.56, 3115.
33. Nguyen QD, Kurup SK, Merrill P, Sheppard J, Van Calster J, Dick AD, Jaffe G, Mackensen F, Rosenbaum JT, Schlaen A, Camez A, Tari S, Kron M, Song A, Brezin A. Adalimumab in Patients with Inactive, Non-Infectious Uveitis Requiring Systemic Treatment [abstract]. Arthritis Rheumatol. 2015; 67 (suppl 10).
Artrite idiopática juvenil poliarticular
34. Lovel DJ, Ruperto N, Goodman S, Reiff A, Jung L, Jarosova K, et al. Adalimumab with or without Methotrexate in Juvenile Rheumatoid Arthritis. N Engl J Med 2008;359:810-20.
35. Daniel J., Kingsbury, Pierre Quartier, Vipin Arora, et al.Safety and Effectiveness Of Adalimumab In Children With Polyarticular juvenile Idiopathic Arthritis Aged 2 To < 4 Years Or >= 4 Years Weighing < 15 Kg.. Arthritis & rheumatism; [0004-3591] Volume: 65; Issue: Suppl. 10; Year: 203; Pages: S117.
Doença de Crohn pediatrico
36. Hyams JS1, Griffiths A, Markowitz J,et al. Safety and efficacy of adalimumab for moderate to severe Crohn's disease in children. Gastroenterology. 2012 Aug;143(2):365-74.
Uveíte pediátrica
37. Ramanan AV, Dick AD, Jones AP, et al. Adalimumab plus methotrexate for uveitis in juvenile idiopathic arthritis. NEJM 2017; 376;17:1637-46.
Características Farmacológicas
Adalimumabe é um anticorpo monoclonal recombinante da imunoglobulina humana (IgG1) contendo apenas sequências humanas de peptídeos. Adalimumabe foi desenvolvido a partir de técnica utilizando um fago contendo regiões variáveis de cadeias leves e pesadas totalmente humanas, o que confere especificidade ao fator de necrose tumoral (TNF), e sequências de cadeias pesadas e de cadeias leves capa (κ) de IgG1 humana. Adalimumabe liga-se com alta afinidade e alta especificidade ao fator de necrose tumoral alfa (TNF-alfa), mas não à linfotoxina (TNF-beta).
O Adalimumabe é produzido por tecnologia de DNA recombinante em sistema de expressão de células de mamíferos. Consiste de 1330 aminoácidos e apresenta um peso molecular de aproximadamente 148 quilodaltons.
Adalimumabe é um medicamento de uso crônico e, portanto, o tempo estimado para início da ação terapêutica não é relevante. Considerando a monoterapia com dosagem de 40 mg, as concentrações séricas mínimas duas semanas após a primeira dose são de 2,9 μg/mL, valor que excede a EC50 (1 μg/mL), sugerindo que as concentrações farmacológicas são atingidas após a primeira dose.
Farmacologia clínica
Mecanismo de ação
O Adalimumabe liga-se especificamente ao TNF, neutralizando sua função biológica através do bloqueio de sua interação com os receptores de TNF (p55 e p75) presentes na superfície celular. O TNF é uma citocina de ocorrência natural, envolvida nas respostas inflamatórias e imunes normais.
Níveis elevados de TNF são encontrados no líquido sinovial de pacientes com artrite reumatoide, incluindo artrite idiopática juvenil poliarticular, artrite psoriásica e espondilite anquilosante, desempenhando um papel importante tanto na inflamação patológica quanto na destruição da articulação, características destas doenças. Níveis elevados de TNF também são encontrados nas placas psoriásicas. Nestas placas, o tratamento com Adalimumabe pode reduzir a espessura da epiderme e infiltração de células inflamatórias. O aumento dos níveis de TNF são também encontrados nas lesões de hidradenite supurativa (HS). A relação entre estas atividades farmacodinâmicas e o mecanismo de ação de Adalimumabe é desconhecida.
O Adalimumabe também modula respostas biológicas induzidas ou reguladas pelo TNF, incluindo alterações nos níveis de moléculas de adesão, responsáveis pela migração de leucócitos (ELAM-1, VCAM-1 e ICAM-1 com IC50 de 1-2 X 10-10 M).
Farmacodinâmica
Após o tratamento com Adalimumabe, observou-se uma rápida diminuição em relação aos níveis basais dos marcadores de fase aguda da inflamação (proteína C reativa, velocidade de hemossedimentação, e citocinas séricas como a IL-6) em pacientes com artrite reumatoide. Uma diminuição nos níveis de proteína C-reativa também foi observada em pacientes com artrite idiopática juvenil poliarticular ou doença de Crohn, colite ulcerativa ou retocolite ulcerativa ou hidradenite supurativa, bem como uma significativa redução na expressão de TNF e nos marcadores inflamatórios como o antígeno leucócitário humano (HLA-DR) e a mieloperoxidase (MPO) no cólon de pacientes com doença de Crohn. Observou-se também uma diminuição dos níveis séricos de metaloproteinases matriciais (MMP-1 e MMP-3), responsáveis pela remodelação tissular e pela destruição da cartilagem. Os pacientes com artrite reumatoide, artrite psoriásica e espondilite anquilosante frequentemente apresentam anemia leve a moderada e redução da contagem de linfócitos, bem como aumento do número de neutrófilos e de plaquetas. Os pacientes tratados com Adalimumabe geralmente apresentam melhora nesses parâmetros hematológicos de inflamação crônica.
Estimativas da EC50 do Adalimumabe variando de 0,8 a 1,4 mcg/mL foram obtidas através da modelagem farmacocinética / farmacodinâmica de contagem de articulações inchadas, contagem de articulações doloridas e da resposta ACR 20 dos pacientes que participam dos estudos fase II e III.
Farmacocinética
Absorção
Após administração de dose única de 40 mg de Adalimumabe por via subcutânea (SC) em 59 indivíduos adultos saudáveis, observou-se absorção e distribuição lenta do Adalimumabe, com pico de concentração plasmática médio em cerca de cinco dias após a administração. A biodisponibilidade média absoluta do Adalimumabe estimada a partir de três estudos após dose única subcutânea de 40 mg foi de 64%.
Distribuição e eliminação
A farmacocinética de dose única do Adalimumabe foi determinada em vários estudos com doses intravenosas (IV) variando entre 0,25 a 10 mg/kg. O volume de distribuição variou de 4,7 a 6,0 litros, indicando que o Adalimumabe se distribui de modo similar nos líquidos vascular e extravascular. O Adalimumabe é eliminado lentamente, com depuração tipicamente abaixo de 12 mL/h. A meia-vida média da fase terminal foi de aproximadamente duas semanas, variando de 10 a 20 dias. A depuração e a meia-vida permaneceram relativamente inalteradas no intervalo de doses estudado, e a meia-vida terminal foi semelhante após administração intravenosa e subcutânea. As concentrações do Adalimumabe no líquido sinovial de vários pacientes com artrite reumatoide (AR) variou de 31 a 96% da concentração plasmática.
Farmacocinética no estado de equilíbrio
O acúmulo do Adalimumabe foi previsível com base na meia-vida após administração SC de 40 mg de Adalimumabe a cada 14 dias em pacientes com AR atingindo, em média, concentrações mínimas no estado de equilíbrio de aproximadamente 5 mcg/mL (sem administração concomitante de metotrexato) e de 8 a 9 mcg/mL (com administração concomitante de metotrexato). Os níveis plasmáticos do Adalimumabe no estado de equilíbrio aumentaram quase proporcionalmente com a dose após administração SC de 20, 40 e 80 mg semanalmente ou a cada 14 dias. Em estudos de longa duração com administração por mais de dois anos, não houve evidência de alterações na depuração em função do tempo.
Em pacientes com psoríase, a concentração média no estado de equilíbrio é 5 mcg/mL durante o tratamento de Adalimumabe 40 mg sem tratamento concomitante com metotrexato a cada duas semanas.
Em pacientes com hidradenite supurativa, a dose de 160 mg de Adalimumabe na semana 0 seguida por 80 mg na Semana 2 alcançou uma concentração sérica de Adalimumabe de aproximadamente 7 a 8 mcg/ml na Semana 2 e na semana 4. A concentração média no estado de esquilíbrio na Semana 12 para Semana 36 foi aproximadamente 8 a 10 mcg/ml durante o tratamento com Adalimumabe 40 mg por semana.
Em pacientes com uveíte, uma dose de ataque de 80 mg de Adalimumabe na Semana 0 seguidos de 40 mg em semanas alternadas, iniciando na Semana 01, resultou na concentração média no estado de equilíbrio de aproximadamente 8 a 10 mcg/mL.
O modelo populacional de farmacocinética/farmacodinâmica utilizado previram exposição e eficácia comparáveis do Adalimumabe em pacientes tratados com 80 mg a cada duas semanas, em comparação com 40 mg a cada semana (incluindo pacientes adultos com artrite reumatoide, hidradenite supurativa, colite ulcerativa, doença de crohn e psoríase em placas e pacientes pediátricos com doença de crohn ≥ 40 kg.
A análise populacional de farmacocinética, com dados de mais de 1200 pacientes, revelou que a administração concomitante de metotrexato apresentou um efeito intrínseco sobre a depuração aparente do Adalimumabe. Conforme esperado, houve uma tendência a aumento da depuração aparente do Adalimumabe com o aumento do peso corporal e com a presença de anticorpos anti-adalimumabe.
Foram identificados também outros fatores de menor importância: foi prevista maior depuração aparente em pacientes recebendo doses menores do que a dose recomendada, e em pacientes com altas concentrações de fator reumatoide ou de proteína C-reativa. Esses fatores não parecem ser clinicamente relevantes.
Após a administração subcutânea de 40 mg de Adalimumabe a cada duas semanas em pacientes adultos com espondiloartrite axial não radiográfica, a média (± DP) através da concentração no estado de equilíbrio na Semana 68 foi de 8,0 ± 4,6 µg / mL.
Em pacientes com doença de Crohn , com a dose inicial de 160 mg via SC na Semana 0, seguida de 80 mg na Semana 2, o Adalimumabe atingiu nível sérico médio de aproximadamente 12 mcg/mL na Semana 2 e Semana 4. Nível médio do estado de equilíbrio (steady-state) de aproximadamente 7 mcg/mL foi observado na Semana 24 e Semana 56 em pacientes com doença de Crohn após receberem a dose de manutenção de 40 mg de Adalimumabe a cada 14 dias.
Em pacientes com colite ulcerativa ou retocolite ulcerativa, com a dose inicial de 160 mg via SC na Semana 0, seguida de 80 mg na Semana 2, o Adalimumabe atingiu nível sérico médio de aproximadamente 12 mcg/mL no período de indução clínica. Nível médio do estado de equilíbrio (steady-state) de aproximadamente 8 mcg/mL foi observado em pacientes com colite ulcerativa ou retocolite ulcerativa após receberem a dose de manutenção de 40 mg de Adalimumabe a cada 14 dias.
Populações especiais
Geriatria:
A idade parece exercer um efeito mínimo sobre a depuração aparente do Adalimumabe.
Em análise populacional, a depuração média (ajustada segundo peso corpóreo), em pacientes de 40 a 65 anos (n= 850) e ≥ 65 anos (n= 287) foi de 0,33 e 0,30 mL/h/kg, respectivamente.
Pediatria:
Após a administração subcutânea de 24 mg/m2 (até no máximo de 40 mg) a cada 14 dias a pacientes com artrite idiopática juvenil poliarticular (AIJ) a média no estado de equilíbrio estável (valores medidos para da 20º semana à 48º semana) da concentração sérica de Adalimumabe foi 5,6 ± 5,6 µg/mL (102% CV) na terapia de Adalimumabe sem tratamento concomitante com metotrexato e 10,9 ± 5,2 µg/mL (47,7% CV) com metotrexato concomitante. A média no estado de equilíbrio estável da concentração sérica de Adalimumabe para pacientes pesando < 30 kg recebendo 20 mg de Adalimumabe via subcutânea a cada 14 dias como monoterapia ou com metotrexato concomitante foi 6,8 µg/mL e 10,9 µg/mL, respectivamente. A média no estado de equilíbrio estável da concentração sérica de Adalimumabe para sujeitos pesando > 30 kg recebendo 40 mg de Adalimumabe via subcutânea a cada 14 dias sem ou com metotrexato concomitante foi 6,6 µg/mL e 8,1 µg/mL, respectivamente.
Em pacientes com AIJ poliarticular com idade de 2 < 4 anos ou 4 anos pesando menos que 15 kg, após a administração subcutânea de 24 mg/m2 a média no estado de equilíbrio estável da concentração sérica de Adalimumabe foi 6,0 ± 6,1 µg/mL (101% CV) na terapia de Adalimumabe sem tratamento concomitante com metotrexato e 7,9 ± 5,6 µg/mL (71,2% CV) com metotrexato concomitante.
Em pacientes pediátricos com doença de Crohn ativa moderada a grave, a dose de indução de Adalimumabe foi de 160/80 mg ou 80/40 mg nas Semanas 0 e 2, respectivamente, dependentes de um peso corporal de 40 kg. Na Semana 4, os pacientes foram randomizados 1: 1, seja na dose padrão (40/20 mg a cada 14 dias) ou na dose baixa de manutenção (20/10 mg a cada 14 dias) com base em seu peso corporal. A média (± DP) de concentrações séricas de Adalimumabe alcançadas na Semana 4 foram de 15,7 ± 6,6 µg/mL para pacientes com ≥ 40 kg (160/80 mg) e 10,6 ± 6,1 µg/mL para pacientes com <40 kg (80/40 mg). Para os pacientes que ficaram em sua terapia randomizado, a média (± SD) de concentrações séricas de Adalimumabe alcançadas na Semana 52 foram de 9,5 ± 5,6 µg/mL para o grupo dose padrão e 3,5 ± 2,2 µg/mL para o grupo de baixa dose.
As concentrações médias foram mantidas em pacientes que continuaram a receber tratamento com Adalimumabe a cada 14 dias durante 52 semanas. Para os pacientes que tiveram a dose escalonada de a cada 14 dias para um regime semanal, a média (± SD) de soro de concentrações séricas de Adalimumabe alcançadana Semana 52 foram de 15,3 ± 11,4 µg/mL (40/20 mg, semanalmente) e 6,7 ± 3,5 µg/mL (20/10 mg, semanalmente.
Após a administração por via subcutânea de 24 mg/m2 (até um máximo de 40 mg) a cada 14 dias em pacientes com artrite relacionada à entesite, as concentrações séricas médias de Adalimumabe no estado de equilíbrio (valores medidos na Semana 24) foram 8,8 ± 6,6 µg/mL para Adalimumabe sem metotrexato concomitante e 11,8 ± 4,3 µg/mL para Adalimumabe com metotrexato concomitante.A exposição de Adalimumabe em pacientes pediátricos com uveíte não infecciosa anterior crônica foi avaliada utilizando modelos farmacocinéticos e de simulação na população, baseados na farmacocinética nas várias indicações em outros pacientes pediátricos (psoríase pediátrica, artrite idiopática juvenil, doença de Crohn pediátrica e artrite relacionada à entesite).
Não existem dados clínicos de exposição sobre a utilização de uma dose de ataque em crianças < 06 anos de idade.
As exposições avaliadas indicam que na ausência de metotrexato, uma dose de ataque pode levar a um aumento inicial da exposição sistêmica.
Sexo:
Não foram observadas diferenças farmacocinéticas relacionadas ao sexo do paciente após correção para o peso corporal.
Etnia:
Não são esperadas diferenças na depuração de imunoglobulinas entre indivíduos de diferentes etnias. Com base em dados de pacientes não caucasianos, não foram observadas diferenças farmacocinéticas importantes para o Adalimumabe.
Insuficiência renal e hepática:
Nenhum dado de farmacocinética está disponível em pacientes com insuficiência renal ou hepática.
Pacientes com artrite reumatoide:
A farmacocinética foi a mesma em voluntários sadios e em portadores de artrite reumatoide.
Como devo armazenar o Bio-Manguinhos Adalimumabe?
Bio-Manguinhos Adalimumabe (adalimumabe) deve ser mantido em sua embalagem original e armazenado entre 2 e 8°C (na geladeira). Não congelar.
Alternativamente, Bio-Manguinhos Adalimumabe (adalimumabe) pode ser armazenado, protegido da luz, em temperaturas de no máximo 30°C por um período de até 2 semanas. O produto deve ser descartado se não utilizado dentro do período de 2 semanas.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use o medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Após aberto, este medicamento deve ser utilizado imediatamente. A parte da solução não utilizada e todo o material utilizado para a injeção devem ser adequadamente descartados.
Características físicas e organolépticas
Bio-Manguinhos Adalimumabe (adalimumabe) é fornecido sob a forma de solução estéril, livre de conservantes, para administração subcutânea. A solução de Bio-Manguinhos Adalimumabe (adalimumabe) é límpida e praticamente livre de partículas visíveis, com um pH de 5,2.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Dizeres Legais do Bio-Manguinhos Adalimumabe
M.S – 1.1063.0163
Resp. Téc.:
Maria da Luz F. Leal
CRF/RJ 3726
Importado por:
Fundação Oswaldo Cruz - Fiocruz
Instituto de Tecnologia em Imunobiológicos - Bio-Manguinhos
Av. Brasil, 4365 - Manguinhos - Rio de Janeiro-RJ – Brasil
CEP: 21045-900
CNPJ: 33.781.055/0001-35
Frasco-ampola
Fabricado por:
Merck Serono S.A.
Aubonne – Suíça
Seringa preenchida
Fabricado por:
Merck Serono S.p.A.
Bari – Itália
Embalado por:
Fresenius Kabi Austria GmbH.
Werndorf – Áustria
Ou
Merck Serono S.A.
Aubonne – Suíça
SAC
0800 021 0310
Uso sob prescrição médica.
Proibida venda ao comércio.
Especificações sobre o Bio-Manguinhos Adalimumabe
Caracteristicas Principais
| Fabricante: | Fiocruz |
| Necessita de Receita: | Branca Comum (Venda Sob Prescrição Médica) |
| Princípio Ativo: | Adalimumabe |
| Categoria do Medicamento: | Artrite |
| Especialidades: | Reumatologia, Gastroenterologia, Coloproctologia, Dermatologia, Oftalmologia |
| Doenças Relacionadas: | Doença de Crohn, Espondilite Anquilosante, Artrite, Uveíte, Espondiloartrite Axial, Psoríase, Colite Ulcerativa, Artrite Idiopática Juvenil Poliarticular, Retocolite Ulcerativa |
| Bula do Paciente: | Bula do Bio-Manguinhos Adalimumabe |
| Bula do Profissional: | Bula do Profissional do Bio-Manguinhos Adalimumabe |
| Tipo do Medicamento: | Biológico |
| Registro no Ministério da Saúde: | 1106301630012 |
| Código de Barras: | 7898168491159 |
| Temperatura de Armazenamento: | De 2 a 8°C |
| Produto Refrigerado: | Este produto precisa ser refrigerado |
| Modo de Uso: | Uso injetável (subcutâneo) |
| Pode partir: | Esta apresentação pode ser partida |
Sobre a Fiocruz
A Fundação Oswaldo Cruz teve seu início em 1900, inicialmente para fabricar soros e vacinas contra a peste bubônica. Desde então, a instituição participa intensamente do desenvolvimento da saúde pública no país.
Sua missão é produzir, disseminar e compartilhar os conhecimentos e tecnologias para fortalecer o Sistema Único de Saúde (SUS), além de poder contribuir para a promoção da saúde e qualidade de vida da população brasileira.
Com mais de cem anos de história, foi responsável por grandes avanços científicos e teve uma trajetória de expansão, criando um caminho que se alimenta sempre de conquistas e desafios para defender o direito à saúde.
Que tal conferir outros itens? Temos outras opções que podem te interessar!